代謝工程改造Escherichiacoli生產3-羥基丙酸
程秀麗,秦海彬,熊濤,牛坤*
1(浙江工業大學, 浙江省生物有機合成技術研究重點實驗室,浙江 杭州,310014) 2(浙江工業大學, 生物轉化與生物凈化教育部工程研究中心,浙江 杭州,310014)
研究報告
代謝工程改造Escherichiacoli生產3-羥基丙酸
程秀麗1, 2,秦海彬1, 2,熊濤1, 2,牛坤1, 2*
1(浙江工業大學, 浙江省生物有機合成技術研究重點實驗室,浙江 杭州,310014) 2(浙江工業大學, 生物轉化與生物凈化教育部工程研究中心,浙江 杭州,310014)
以提高3-羥基丙酸的產量為目標,對實驗室構建的基因工程大腸桿菌進行改造,敲除形成副產物1,3-丙二醇的主要酶基因——乙醛脫氫酶基因yqhD,得到E.coliW3110ΔyqhD (pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4),該工程菌搖瓶發酵產量達到2.53 g/L,相比未敲除yqhD基因的菌株,產量提高了5.8倍。另外,敲除了甘油代謝途徑中的抑制因子glpR基因,得到E.coliW3110ΔglpR(pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4),該工程菌搖瓶發酵產量達到2.86 g/L,相比未敲除glpR基因的菌株,產量提高了6.7倍。后經5 L罐發酵培養后,3-羥基丙酸的產量提升到15.4 g/L。該實驗為進一步利用大腸桿菌工程菌發酵生產3-羥基丙酸提供了研究基礎。
3-羥基丙酸;甘油代謝;基因敲除;重組大腸桿菌
隨著石油資源的日漸減少及其導致的溫室效應等環境問題日益嚴重,生物柴油應運而生。然而,生物柴油產業的迅速發展產生了大量副產物甘油,使得甘油的價格急劇下降[1]。許多研究者都致力于利用生物柴油產業中產生的大量甘油來生產高附加值的產品。因此,利用甘油生物轉化為高附加值的生物化工產品已成為一個高度活躍的研究領域[2]。當前利用甘油為底物生產的下游產物主要有:1,3-丙二醇(1,3-propanediol, 1,3-PDO)、環氧氯丙烷、乙二醇、乳酸、二羥基丙酮及3-羥基丙酸(3-hydroxypropionic acid, 3-HP)等[3]。
3-HP是一種重要的平臺化合物,是一種無色無味的油狀液體,可與水、醇、醚等多種有機溶劑互溶。由于其具有羧基和羥基兩種官能團,因而在化學反應中是多種化工原料的合成前體物質[4],如脫水生成丙烯酸,氧化生成丙二酸,與醇脂化作用生成酯,還可以通過還原作用生成1,3- PDO等[5-6]。同時3-HP還可以用來生產可降解環保塑料及醫用生物材料等[7]。基于3-HP在商業上的巨大開發價值,2004年8月美國能源部將3-HP列為當今世界上12種最具開發潛力的化工產品之一[8]。
3-HP的生物合成方法按照底物的不同,主要分為兩種類型:分別以葡萄糖和甘油為底物[9-11]。由于甘油目前產能過剩,且合成3-HP的路徑比較簡單,近年來得到了廣泛而深入的研究。采用大腸桿菌產3-HP 的代謝途徑如圖1所示[12]。
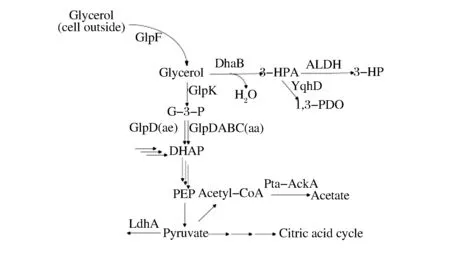
縮寫:G-3-P, 甘油三磷酸;DHAP, 二羥丙酮磷酸;PEP, 磷酸烯醇丙酮酸圖1 大腸桿菌利用甘油的部分代謝途徑Fig.1 The partial pathways involved in the respiratory utilization of glycerol in E. coli
目前文獻中對大腸桿菌重組發酵合成3-HP的研究主要集中在新型高活力的醛脫氫酶的篩選、甘油代謝途經改造和NAD+輔酶再生等方面[12-14]。CHU等[13]篩選到來源于鉤蟲貪銅菌 (Cupriavidusnecator) 的新型醛脫氫酶GabD4,同時敲除了E.coliW3110(DE3)基因組中合成乙酸的關鍵基因ackA-pta以及催化3-羥基丙醛 (3-hydroxypropionaldehyde,3-HPA)合成1,3-PDO的關鍵基因yqhD后,利用葡萄糖和甘油進行雙底物發酵,3-HP的產量提高到71.9 g/L。
KIM等[14]篩選到來源于銅綠假單胞菌 (PseudomonasaeruginosaPSPA7_3072) 的半醛脫氫酶PSALDH,將其與短乳桿菌 (Lactobacillusbrevis) 的甘油脫水酶DhaB-DhaR共表達于E.coliBL21 (DE3)中構建重組菌株,又敲除了甘油競爭途徑中合成3-磷酸甘油的glpK基因、甘油脫氫酶glpA基因和催化3-HPA合成1,3-PDO的yqhD基因,使3-HP產量達到57.3 g/L。
本研究以實驗室構建的產3-HP的工程菌E.coliW3110 (pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4)為出發菌株,擬通過控制甘油代謝途徑,減少甘油抑制因子的抑制作用[12,15-16],并阻斷代謝過程中副產物1,3-PDO的形成途徑,使3-HPA在醛脫氫酶的作用下更多的轉化為3-HP。從而獲得具有工業應用價值、性能優良的工程菌,進一步提高3-HP 的產量。
1 材料與方法
1.1材料與試劑
1.1.1 菌株與質粒
本實驗所用質粒與菌株見表1。

表1 本研究中所用的菌株和質粒
1.1.2 試劑
Phamta super-Fidelity DNA polymerase購自諾維贊公司;限制性內切酶EcoRI、HindIII、XhoI、NcoI、NdeI 、TaqDNA聚合酶及T4DNA連接酶、IPTG均購自Thermo生物公司;卡那霉素、氯霉素、鏈霉素和氨芐青霉素購自北京Solarbio公司;DNA Marker、protein Marker和染色劑Gold View購自大連TaKaRa公司;質粒提取試劑盒及凝膠回收試劑購自杭州Axygen生物技術有限公司;PCR引物由生工生物工程(上海)股份有限公司合成;進口蛋白胨、進口酵母粉購自北京Oxoid公司;3-HP標準品購自上海百靈威化學技術有限公司,其他試劑均為市售分析純試劑。
1.1.3 培養條件和菌株培養條件
LB培養基:胰蛋白胨 10 g/L,酵母提取物5 g/L,NaCl 10 g/L,調pH值7.0左右,根據需要加入相應抗生素。固體培養基則添加瓊脂粉20 g/L。
初始發酵培養基:甘油 30 g/L,NaCl 1 g/L,MgSO4·7H2O 0.25 g/L,Na2HPO4·12H2O 22.7 g/L,KH2PO43 g/L,酵母膏4 g/L,(NH4)2SO43.2 g/L。121 ℃滅菌20 min,需添加氯霉素100 mg/L、鏈霉素100 mg/L、VB120.02 g/L,pH 7.0左右。
試管培養條件:單菌落接種到試管中,30 ℃(37 ℃),200 r/min,培養過夜;搖瓶發酵培養條件:種子液接種搖瓶,37 ℃(28 ℃),150 r/min,培養35 h;5 L罐發酵培養條件:種子液接種到發酵罐,37 ℃(28 ℃),400 r/min,控制pH 7.0左右,培養45 h。
1.1.4 儀器和設備
PCR擴增儀,Biometra TProfessional standard 96 Gradient;全自動凝膠成像系統,Bio-Rad Moleculat Imager Gel DOCTM XR+;電轉儀,BIO-RAD MicroPulser;臺式高速離心機,Eppendorf AG 22331 Hamburg;高速冷凍離心機,BECKMAN COULTER Avanti J-26S XP;酶標儀,SpectraMax M5;高效液相色譜,Waters,Milford,USA。
1.2方法
1.2.1 線性打靶片段的獲得
glpR基因敲除菌構建方法為:以E.coliK12-glpR::kan基因組DNA為模版,利用PCR擴增出glpR::kan打靶片段并進行純化。同樣,利用此方法得到yqhD的線性打靶片段。本實驗所用引物如表2所示。
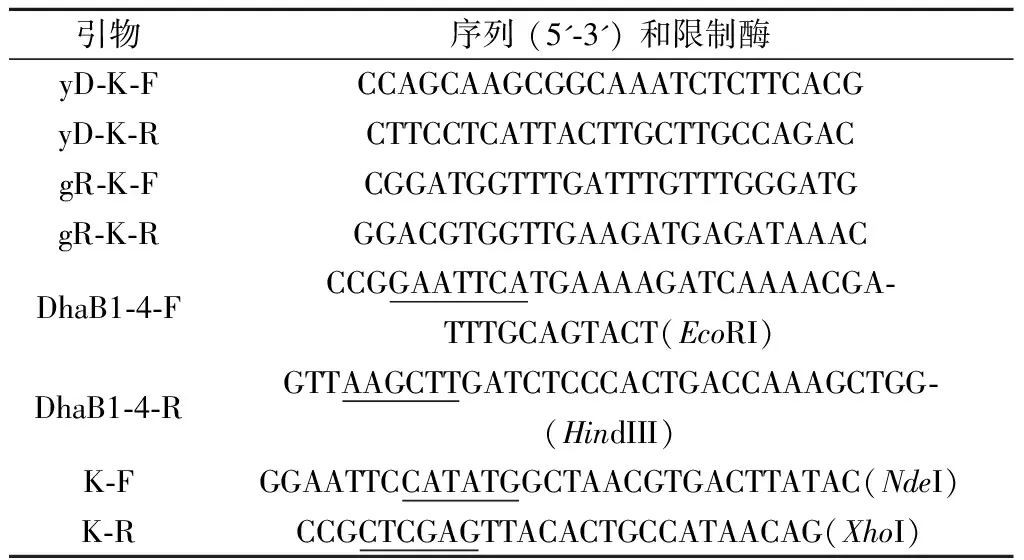
表2 本實驗所用引物
1.2.2 電擊感受態的制備及電轉化方法
將輔助質粒pKD46轉化入E.coliW3110,培養溫度30 ℃,添加50μg/mL氨芐青霉素。大腸桿菌化學感受態、電轉化感受態的制備參見《分子克隆實驗指南》[17]。
1.2.3 工程菌的轉化
產3-HP的大腸桿菌工程菌種的構建是利用同源重組的方法進行基因敲除來實現的[18-19],以敲除菌株E.coliW3110ΔglpR構建為例,首先將glpR::kan打靶片段經電擊轉化(電擊條件:2.5 kV/cm,2 mm電擊杯)轉化到工程菌E.coliW3110-pKD46的感受態細胞中,經過電轉化的細胞在1 mL LB液體培養基37 ℃恒溫培養1 h,再把培養液涂布在含有50 μg/mL卡那霉素的LB固體培養基37 ℃恒溫培養12~16 h。
1.2.4 陽性轉化子的鑒定
通過菌落PCR驗證篩選出同源重組的工程菌,即Kan抗性基因經同源重組已整合到染色體上。將獲得的E.coliW3110Δgene::kan制備成化學感受態;再將質粒pCP20轉化到E.coliW3110Δgene::kan感受態中,涂布Amp抗性的LB固體培養基,30 ℃恒溫培養16~24 h。挑取單菌落在kan平板上劃線檢測kan抗性是否消除;利用pCP20含有的溫度敏感基因repA101(Ts)來消去該質粒,挑取在Amp抗性平板上生長而不能在Kan抗性平板上生長的單菌落,接種到LB無抗試管中,37 ℃培養8 h,然后42 ℃ 10 h左右,涂布與LB無抗平板上劃線分離單菌落;挑取單菌落在Amp和Kan平板上劃線驗證,在兩種平板上均不生長的單菌落,利用菌落PCR驗證篩選出陽性工程菌E.coliW3110ΔyqhD和E.coliW3110ΔglpR。
1.2.5 高效液相色譜檢測3-HP及其他副產物的方法
將待檢測的發酵液經轉速12 000 r/min離心2 min,取上清液經0.22 μm聚醚砜微孔濾膜過濾后,利用高效液相色譜法分析3-HP和其他副產物的含量。檢測條件為:Waters 高效液相色譜儀,紫外檢測器與折光示差檢測器,色譜柱為Aminex HPX-87H柱,柱溫60 ℃,流動相為5 mmol/L H2SO4,流速0.6 mL/min。進樣量20 μL,采用外標法定量。
1.2.6 工程菌株生長及發酵產3-HP的研究
將質粒pCDFDuet-tac-gpd1-Tukgsadh和pACYCDuet-tac-dhaB1-4共轉化至驗證正確的敲除菌E.coliW3110ΔglpR和E.coliW3110ΔyqhD中,通過菌落PCR驗證得到工程菌E.coliW3110ΔglpR (pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet- tac-dhaB1-4) 和E.coliW3110ΔyqhD (pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4)。將上述2株工程菌同未敲除菌一起接種培養,在搖瓶和5L發酵罐中分別進行發酵培養,定時取樣測定OD值,并留存樣品進行高效液相色譜的檢測。
2 結果與分析
2.1glpR基因敲除菌株的構建與驗證
甘油抑制因子glpR屬于細菌調控蛋白DeoR超家族,它抑制了整個甘油代謝路徑,YANG等發現該基因調控著整個甘油代謝途徑,且與甘油磷酸脫氫酶glpD的基因序列相似[15-16]。JUNG等人比較了甘油代謝途徑中的glpR基因對甘油三磷酸脫氫酶基因glpT、厭氧甘油三磷酸脫氫酶基因glpA、好氧甘油三磷酸脫氫酶基因glpD、甘油異化蛋白因子glpF和甘油激酶基因glpK等基因表達水平的影響,結果顯示在敲除glpR基因后,上述酶的表達量都有明顯提升[12]。因此為了解除glpR對甘油代謝中的抑制作用,本實驗中考察了在宿主菌基因組中敲除glpR基因對甘油代謝和3-HP產量的影響。
2.1.1 篩選陽性克隆E.coliW3110ΔglpR
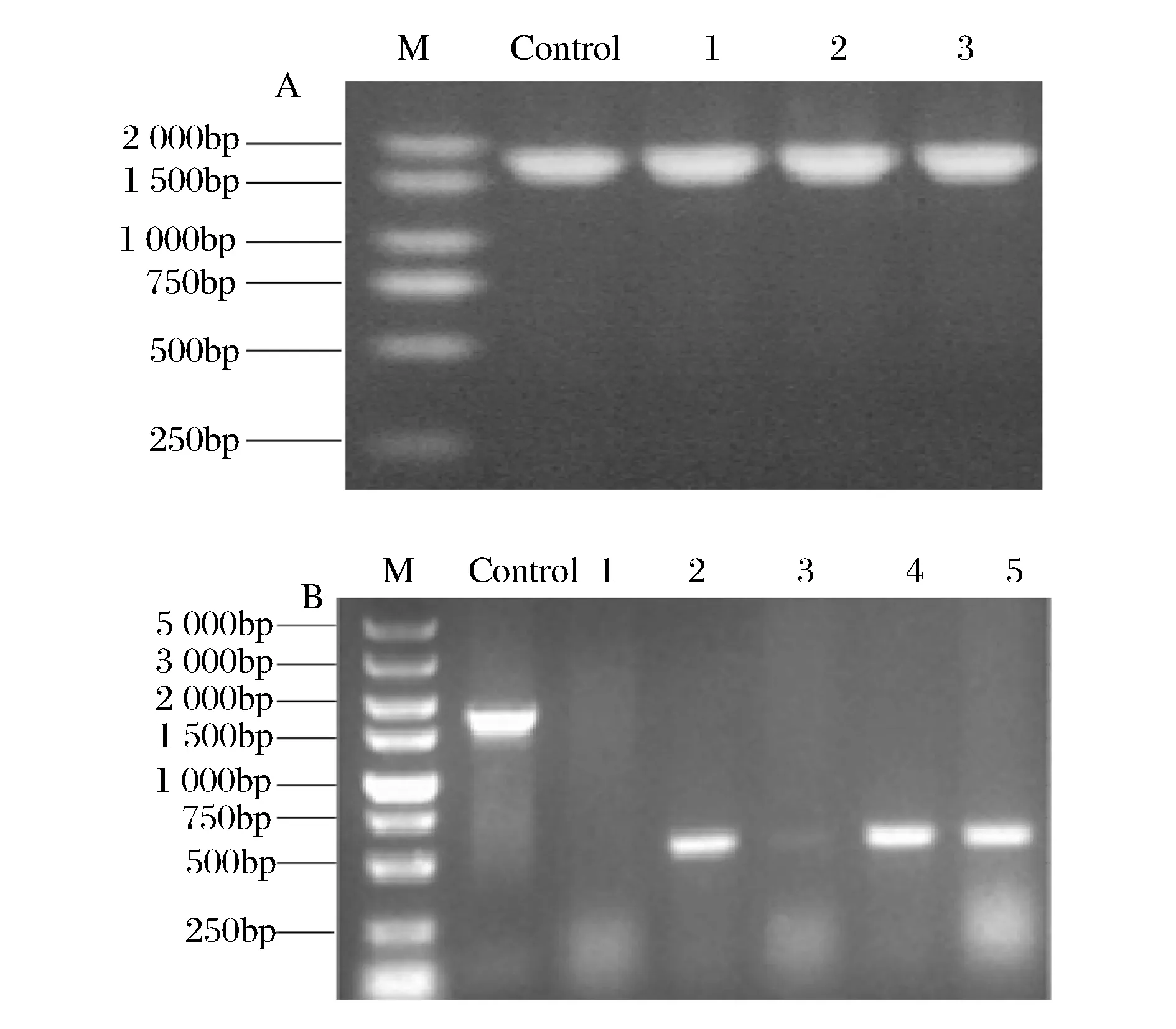
甘油抑制因子glpR基因的敲除是以E.coliK12-glpR::kan基因組DNA為模版,利用PCR擴增出和glpR基因含有相同的上下同源臂的glpR::kan打靶片段并進行純化;然后制備含有pKD46的E.coliW3110電轉感受態,再將純化后的打靶片段通過電擊轉化導入到E.coliW3110中,經菌落PCR驗證,由圖2A所示,片段1-5大小與陽性對照一致,證明Kan抗性成功替代了E.coliW3110菌株染色體上的甘油抑制因子的基因位置;之后通過導入pCP20質粒消除Kan抗性,經菌落PCR后,結果如圖2B所示,陰性對照是以E.coliK12-glpR::kan基因組為模板擴增的打靶片段長度1723 bp,理論上卡那抗性基因消除的菌株經過敲除引物擴增,僅有同源臂距離大小,約450 bp左右,結果顯示條帶2、3大小與理論相符合,因而可以確定該菌株中的卡那抗性消除,通過測序,最終確定該菌株為E.coliW3110ΔglpR。
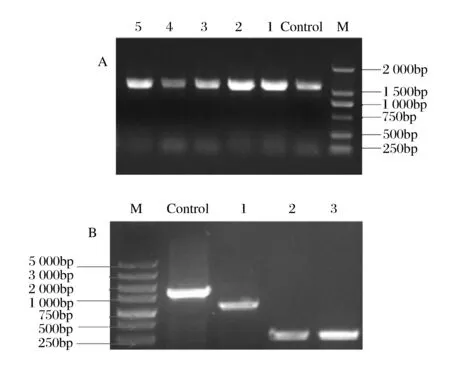
A: M -2000bp marker; control -陽性對照 條帶1~5 -glpR::kan打靶片段的菌落PCR結果 B:M -5000bp marker; control -陰性對照; 條帶1~3-敲除glpR基因的菌落PCR結果圖2 E.coli W3110-glpR::kan和E.coli W3110ΔglpR菌落PCR驗證Fig.2 Colony PCR verification of E.coli W3110-glpR:: Kan and E.coli W3110-ΔglpR
2.1.2 工程菌株E.coliW3110ΔglpR (pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4)的篩選和驗證
將pACYCDuet- tac-dhaB1-4質粒和pCDFDuet-tac-gpd1-TUkgsadh質粒導入E.coliW3110ΔglpR的感受態細胞中,采用引物dhaB1-4-F/dhaB1-4-R和K-F/K-R進行菌落PCR驗證,結果如圖3所示,菌落PCR擴增出約4714 bp的dhaB1-4(圖3A)和1 454 bp的TUkgsadh(圖3B)基因,陽性對照是為以K.pneumoniaeDSM 2026基因組和pET-28(b)-TUkgsadh為模板擴增的結果,通過比對大小一致,這說明獲得了敲除了glpR基因的工程菌RH002,即E.coliW3110 ΔglpR(pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4)。
A: M -5 000bp marker; control -陽性對照;條帶1~3-工程菌株RH002 dhaB1-4基因菌落PCR結果 B: M-5 000bp marker; control -陽性對照;條帶1~3-工程菌株RH002 TUkgsadh基因菌落PCR結果圖3 工程菌E.coli W3110ΔglpR(pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4)菌落PCR驗證Fig.3 Colony PCR verification of E.coli W3110ΔglpR(pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4)
2.2yqhD基因敲除菌株的構建與驗證
2.2.1 篩選陽性克隆E.coliW3110ΔyqhD
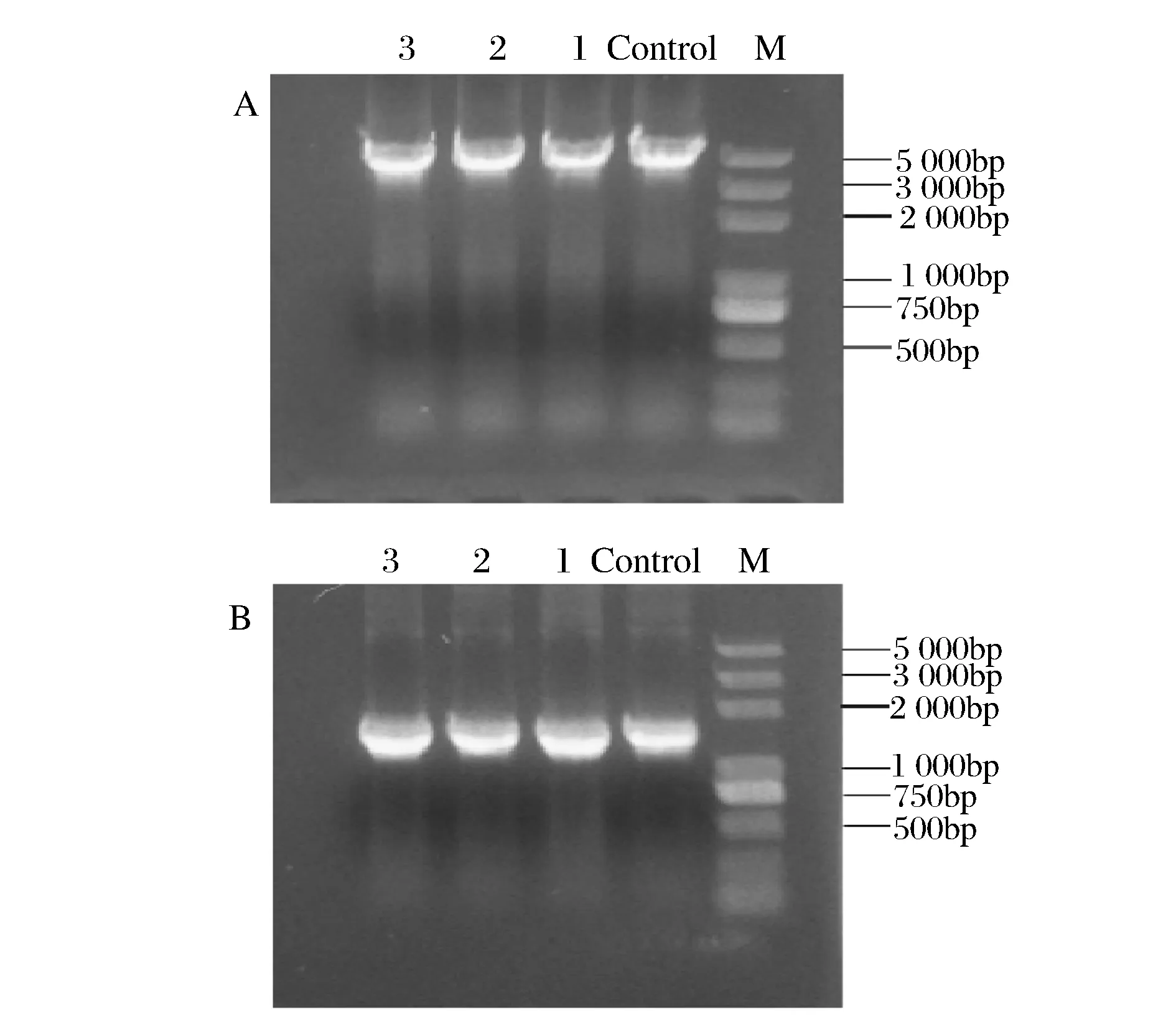
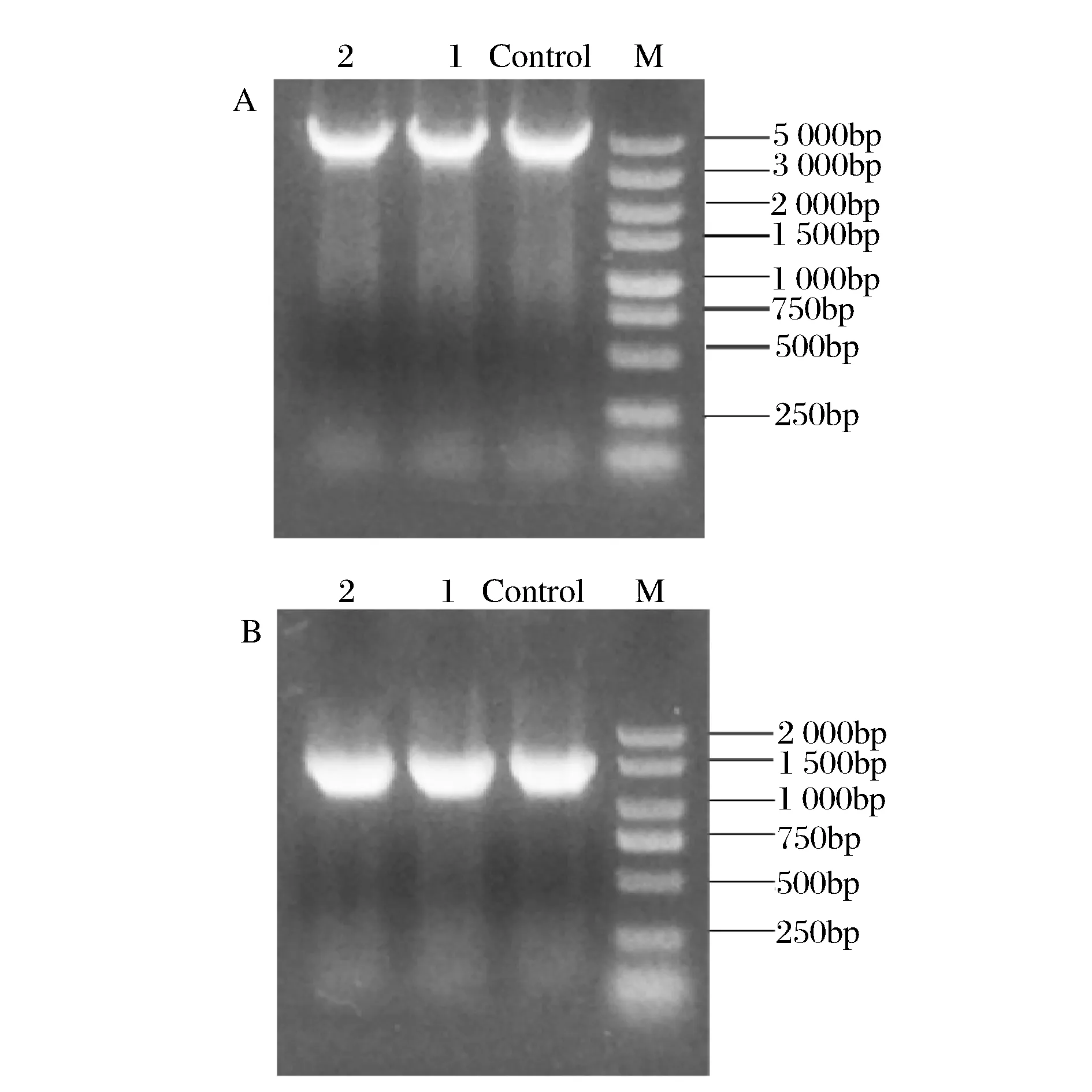
乙醛脫氫酶基因yqhD基因的敲除是以E.coliK12-yqhD::kan基因組DNA為模版,利用PCR擴增出和yqhD基因含有相同的上下同源臂的yqhD::kan打靶片段并進行純化;然后制備含有pKD46的E.coliW3110電轉感受態,再將純化后的打靶片段通過電擊轉化導入到E.coliW3110中,經菌落PCR驗證,如圖4A所示,片段1~3大小與陽性對照一致,證明Kan抗性成功替代了E.coliW3110菌株染色體上醛脫氫酶的基因位置;之后通過導入pCP20質粒消除Kan抗性,經菌落PCR后,結果如圖4B所示,理論上卡那抗性基因消除的菌株經過敲除引物擴增,僅有同源臂距離大小,約450 bp左右,結果顯示條帶2,4,5大小與理論相符合,因而可以確定該菌株中的卡那抗性消除,通過測序,最終確定該菌株為E.coliW3110ΔyqhD。
A: M-2 000bp marker; control -陽性對照; 條帶1~3 -yqhD::kan打靶片段的菌落PCR結果 B:M -5 000bp marker; control -陰性對照; 條帶1~5-敲除yqhD基因的菌落PCR結果圖4 E.coli W3110-yqhD::kan和E.coli W3110Δ yqhD菌落PCR驗證Fig.4 Colony PCR verification of E.coli W3110-yqhD::Kan and E.coli W3110-ΔyqhD
2.2.2 工程菌株E.coliW3110ΔyqhD(pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4)的篩選和驗證
將pACYCDuet- tac-dhaB1-4質粒和pCDFDuet-tac-gpd1-TUkgsadh質粒導入E.coliW3110ΔyqhD的感受態細胞中,采用引物dhaB1-4-F/dhaB1-4-R和K-F/K-R進行菌落PCR驗證,結果如圖5所示,菌落PCR擴增出約4 714 bp的dhaB1-4(圖5A)和1 454 bp的TUkgsadh(圖5B)基因,陽性對照是為以K.pneumoniaeDSM 2026基因組和pET-28(b)-TUkgsadh為模板擴增的結果,通過比對大小一致,這說明獲得了敲除了yqhD基因的工程菌RH003,即E.coliW3110ΔyqhD (pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4)。
A: M -5 000bp marker; control -陽性對照;條帶1,2-工程菌株RH003 dhaB1-4基因菌落PCR結果B: M-2 000 bp marker; control -陽性對照;條帶1,2-工程菌株RH003 TUkgsadh基因菌落PCR結果圖5 工程菌E.coli W3110Δ yqhD (pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4)菌落PCR驗證Fig.5 Colony PCR verification of E.coli W3110ΔyqhD (pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4)
2.3工程菌的搖瓶發酵生產3-HP
將原始工程菌RH001(dhaB1-4,gpd1-TUkgsadh)以及敲除glpR和yqhD的工程菌株RH002(ΔglpR,dhaB1-4,gpd1-TUkgsadh)和RH003(ΔyqhD,dhaB1-4,gpd1-TUkgsadh)以相等的OD值分別接種到含100 mL發酵培養基的250 mL搖瓶中,在37 ℃,150 r/min條件下生長至OD600值為0.6時,加入0.05 mmol/L IPTG,28 ℃誘導,定時取樣測定OD計算干重和3-HP及其他副產物的產量。如圖6所示,由于基因缺失,RH002和RH003的菌體量均低于原始菌株。相比3-HP產量,發酵35 h后RH002產量達到2.86 g/L,比RH001(0.43 g/L)提高了6.7倍,3-HP得率為0.19 g/g甘油。RH003產量達到2.53 g/L,比RH001提高了5.8倍,3-HP得率為0.20 g/g甘油。同時,RH001的副產物主要有乙酸(0.24 g/L)、乳酸(0.29 g/L)、甲酸(1.22 g/L)和1,3-PDO(1.24 g/L),敲除glpR基因的RH002中乳酸已低于檢測限,其他副產物乙酸(0.08 g/L)、甲酸(1.18 g/L)和1,3-PDO(0.86 g/L)也有明顯降低,而敲除yqhD基因的RH003中1,3-PDO不再生成,其他副產物乙酸(0.05 g/L)、乳酸(0.01 g/L)也顯著降低(結果未列出)。上述結果說明敲除副產物和旁支途經可以有效地提升目的產物3-HP的產量并降低副產物的量。
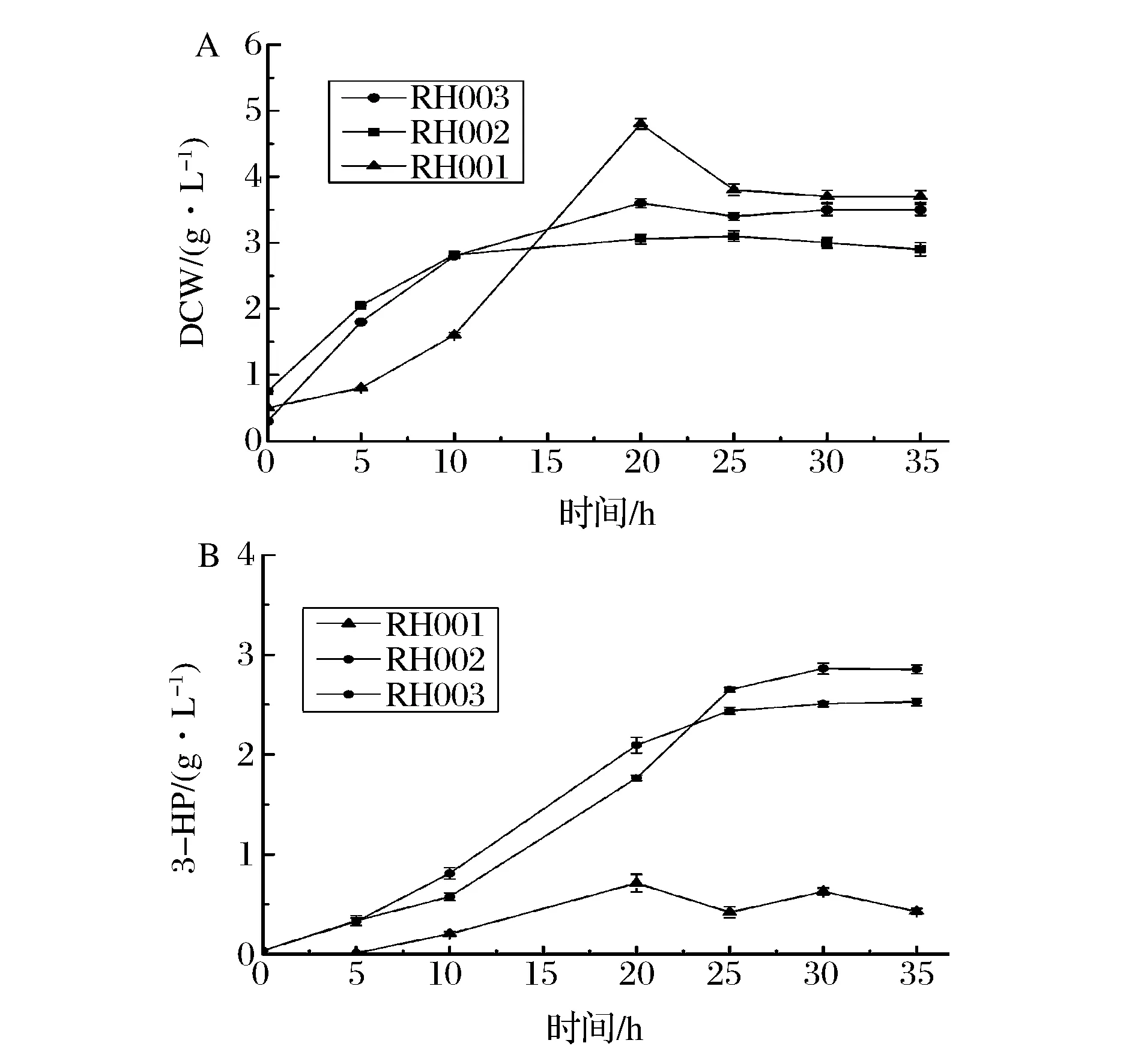
圖6 搖瓶發酵工程菌株RH001, RH002 and RH003的細胞干重(A)和3-HP產量(B)Fig 6 The dry cell weight (A) and 3-HP production (B) of recombinants RH001, RH002 and RH003
2.4工程菌株5L罐發酵生產3-HP
在搖瓶發酵培養的實驗中,菌株RH002獲得了較高的3-HP產量,為了進一步檢測RH002產3-HP的能力,在含有3 L發酵培養基的5 L發酵罐中發酵培養控制pH 7.0(如圖7),初始甘油質量濃度為30 g/L,補料時加入質量濃度為500 g/L的甘油以維持發酵培養基中甘油的濃度,經過45 h的發酵培養,RH002的3-HP產量達到了15.4 g/L,甘油消耗量為34.98 g/L,3-HP的產率達到0.44 g/g甘油,比RH001在搖瓶中的得率顯著提高。由此可知,glpR的敲除能夠提高甘油易化蛋白的活性,促進胞內的甘油能夠更多地用于菌體生長和3-HP的合成。
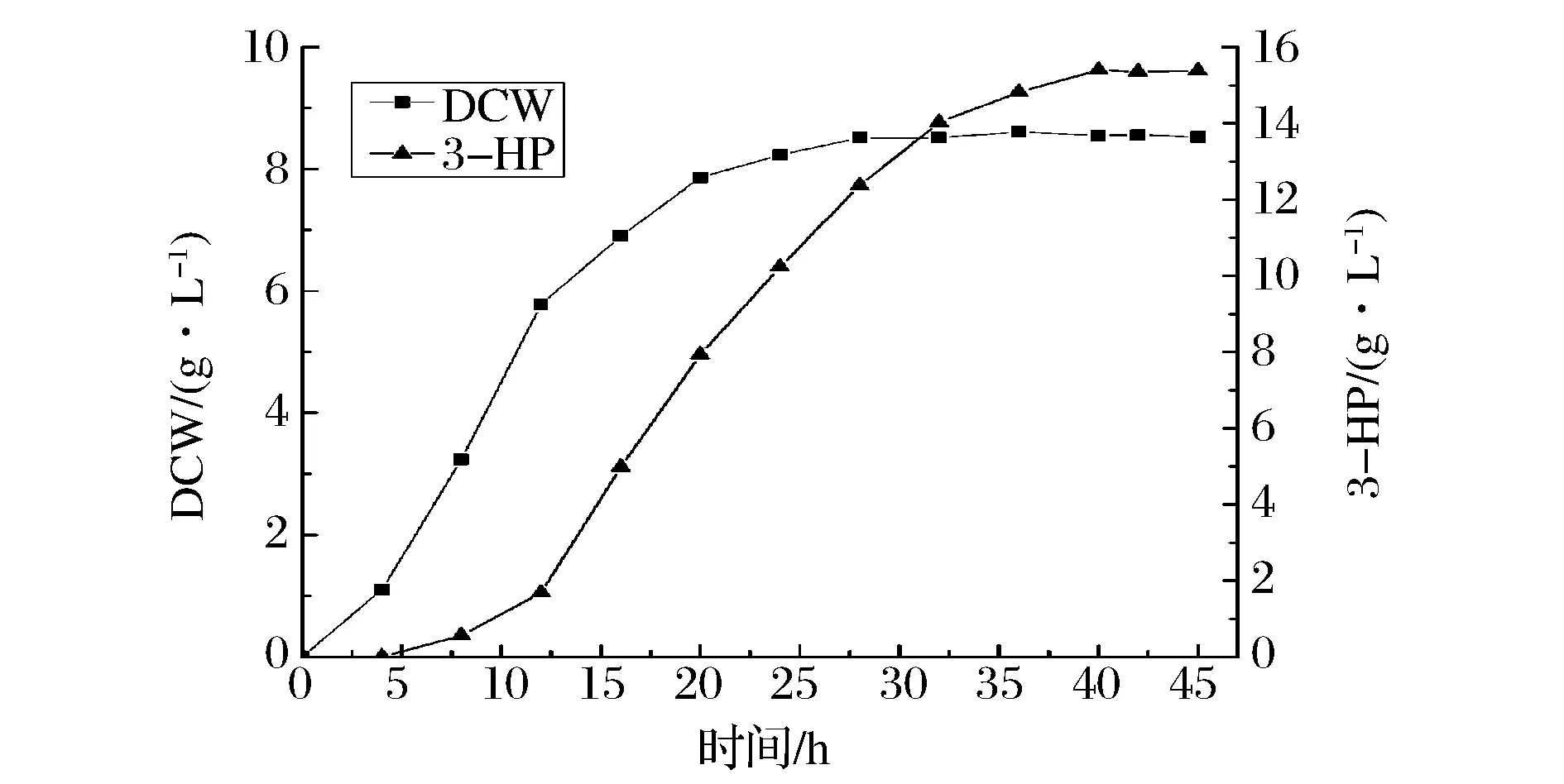
圖7 工程菌RH002在5L罐發酵中的發酵曲線Fig7 Fermentation curve of recombinants RH002 in 5 L bioreactor
3 結論
實驗室前期構建了利用甘油合成3-HP的重組大腸桿菌,本實驗在此基礎上采用同源重組的方法,敲除了甘油代謝過程中的甘油抑制因子glpR以及合成副產物1,3-丙二醇的主要基因yqhD,經過抗性篩選,獲得陽性轉化子,經過PCR和測序驗證,證明2個基因分別被敲除,獲得了重組菌株RH002和RH003。實驗結果表明兩個基因的敲除明顯改變了甘油的利用率和副產物的代謝途徑,提高了3-HP的產量。特別是在敲除甘油抑制因子glpR后,菌體更快達到穩定期,使得3-HP在5 L發酵罐中產量達到15.4 g/L,甘油利用率0.44 g /g甘油。后續的研究將集中于調節優化酶的表達,輔酶再生和優化工藝過程,更加有效的提升3-HP的產量。
[1] FORREST A K, SIERRA R, HOLTZAPPLE M T. Effect of biodiesel glycerol type and fermentor configuration on mixed-acid fermentations[J]. Bioresource Technology, 2010, 101:9 185-9 189.
[2] NITAYAVARDHANA S, KHANAL S K. Biodiesel-derived crude glycerol bioconversion to animal feed: a sustainable option for a biodiesel refinery[J]. Bioresource Technology, 2011, 102(10):5 808-5 814.
[3] DIZA-ALVAREZ A E, FRANCOS J, LASTRA-BARREIRA B, et al. Cheminform abstract: glycerol and derived solvents: new sustainable reaction media for organic synthesis [J]. Chemical Communications, 2011, 42(41):6 208-6 227.
[4] KUMAR V, ASHOK S, PARK S. Recent advances in biological production of 3-hydroxypropionicacid [J]. Biotechnology Advances, 2013, 31(6):945-961.
[5] JIANG X, MENG X, XIAN M.Biosynthetic pathways for 3-hydroxypropionic acid production [J]. Applied Microbiology and Biotechnology, 2009, 82(6):995-1003.
[6] 張鴻達, 劉成, 高衛華,等. 微生物發酵法生產3-羥基丙酸的研究進展[J]. 化工進展, 2007, 26(1):33-36.
[7] MENG D C, SHI Z Y, WU L P, et al. Production and characterization of poly(3-hydroxypropionate-co-4-hydroxybutyrate) with fully controllable structures by recombinantEscherichiacolicontaining an engineered pathway[J]. Metabolic Engineering, 2012, 14(4):317-324.
[8] HOLLADAY J E, BOZELL J J. Top Value added chemicals from biomass [J]. Nato Advanced Science Institutes, 2007(2):263-275.
[9] LIAO H H, GOKARN R R, GORT S J, et al. Production of 3-hydroxypropionic acid using beta-alanine/pyruvate aminotransferase: US, US7700319[P]. 2010-04-20. http://www.freepatentsonline.com/7700319.html
[10] RATHNASINGH C, RAJ S M, LEE Y, et al. Production of 3-hydroxypropionic acid via malonyl-CoA pathway using recombinantEscherichiacolistrains[J]. Journal of Biotechnology, 2012, 157(4): 633-640.
[11] SANKARANARAYANAN M, ASHOK S, PARK S. Production of 3-hydroxypropionic acid from glycerol by acid tolerantEscherichiacoli[J]. Journal of Industrial Microbiology & Biotechnology, 2014, 41(7):1039-1050.
[12] JUNG W S, KANG J H, CHU H S, et al. Elevated production of 3-hydroxypropionic acid by metabolic engineering of the glycerol metabolism inEscherichiacoli[J]. Metabolic Engineering, 2014, 23(5):116-122.
[13] CHU H S, KIM Y S, LEE C M, et al. Metabolic engineering of 3-hydroxypropionic acid biosynthesis inEscherichiacoli[J]. Biotechnology & Bioengineering, 2015, 112(2):356-364.
[14] KIM K, KIM S K, PARK Y C, et al. Enhanced production of 3-hydroxypropionic acid from glycerol by modulation of glycerol metabolism in recombinantEscherichiacoli[J]. Bioresource Technology, 2014, 156(1):170-175.
[15] SCHWEIZER H, BOOS W, LARSON T J. Repressor for the sn-glycerol-3-phosphate regulon ofEscherichiacoliK-12: cloning of the glpR gene and identification of its product [J]. Journal of Bacteriology, 1985, 161(2):563-566.
[16] YANG B, LARSON T J. Multiple promoters are responsible for transcription of theglpEGR, operon ofEscherichiacoli, K-12[J]. Biochimica Et Biophysica Acta, 1998, 1 396(1):114-126.
[17] SAMBROOK J, RUSSELL DW, 黃培唐. 分子克隆實驗指南[M]. 第三版. 北京:科學出版社,2002:96-102.
[18] DATSENKO K A, WANNER B L. One-step inactivation of chromosomal genes inEscherichiacoliK-12 using PCR products[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(12):6 640-6 645.
[19] SHARAN S K, THOMASON L C, KUZNESOV S G, et al. Recombineering:a homologous recombination-based method of genetic engineering [J]. Nature Protocols, 2009, 4(2):206-223.
MetabolicengineeringofEscherichiacolifor3-hydroxypropionicacidproduction
CHENG Xiu-li1, 2, QIN Hai-bin1, 2, XIONG Tao1, 2, NIU Kun1, 2*
1 (Key Laboratory of Bioorganic Synthesis of Zhejiang Province, Zhejiang University of Technology, Hangzhou 310014, China) 2 (Engineering Research Center of Bioconversion and Biopurification of the Ministry of Education, Zhejiang University of Technology, Hangzhou 310014, China)
3-Hydroxypropionic acid (3-HP) is an important platform chemical that can be used to synthesize a range of chemical compounds. To improve 3-HP production, theE.coliW3110ΔyqhD (pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4) was genetically modified by homologous recombination technology to knockout acetaldehyde dehydrogenase (yqhD). The recombinant strain produce 2.53 g/L 3-HP of flask culture, the production was increased 5.8 times compared with original one. On the other hand, theE.coliW3110ΔglpR (pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4) was genetically modified to knockout glycerol regulatory factor (namedglpR). The recombinant strain produces 2.86 g/L 3-HP of flask culture, which was 6.7 times higher than that of the original strain. Finally, the strain ofE.coliW3110?glpR (pCDFDuet-tac-gpd1-TUkgsadh/pACYCDuet-tac-dhaB1-4) could produce 15.4 g/L 3-HP in a 5-L fermentor. The results provide research basis for 3-HP production.
3-hydroxypropionic acid (3-HP); glycerol metabolism; gene knockout; recombinantEscherichiacoli
10.13995/j.cnki.11-1802/ts.014181
碩士研究生(牛坤副教授為通訊作者,E-mail:niukun@zjut.edu.cn)。
國家自然科學基金(21306173);浙江省自然科學基金青年基金(LQ15C010001)
2017-03-01,改回日期:2017-03-23

