堿性蛋白酶抑制劑lupI-MSSS原核表達載體的構建及其蛋白表達、純化
王昆,梁朋娟,李尚勇,王偉,孫晶晶,劉均忠,孫謐,郝建華*
1(農業部極地漁業開發重點實驗室,海洋國家實驗室海洋藥物與生物制品功能實驗室,中國水產科學研究院黃海水產研究所,山東 青島,266071)2(上海海洋大學食品學院,上海,201306)
堿性蛋白酶抑制劑lupI-MSSS原核表達載體的構建及其蛋白表達、純化
王昆1,2,梁朋娟1,李尚勇1,王偉1,孫晶晶1,劉均忠1,孫謐1,郝建華1*
1(農業部極地漁業開發重點實驗室,海洋國家實驗室海洋藥物與生物制品功能實驗室,中國水產科學研究院黃海水產研究所,山東 青島,266071)2(上海海洋大學食品學院,上海,201306)
低溫堿性金屬蛋白酶MP是從菌株YS-80-122中提取純化的,屬于沙雷氏蛋白酶家族,與該家族報道的其他酶的結構類似,在MP基因下游有一抑制劑基因lupI,該抑制劑可以完全抑制蛋白酶MP的活性。在野生型抑制劑基因的基礎上,通過定點突變將LupI的N端增加Met-Ser-Ser-Ser,命名為LupI-MSSS,通過構建pET28a-lupI-MSSS原核表達載體,轉化大腸桿菌BL21 (DE3)并誘導表達,SDS-PAGE凝膠電泳結果表明該蛋白的大小約11 kDa, 與預測的蛋白分子量一致。對影響蛋白誘導表達的誘導劑添加時間、誘導溫度、異丙基硫代半乳糖苷 (IPTG) 濃度、誘導時間4個因素進行優化,并經初步優化得到了其誘導表達的條件為:接種量2%,誘導劑添加時間3 h,誘導劑IPTG終濃度0.5 mmol/L,誘導溫度為37 ℃,誘導時間為8 h。表達的蛋白依次通過超濾,Superdex 200凝膠過濾層析,Q-Sepharose離子交換層析進行純化,結果顯示目的蛋白純化倍數為20,比活力為15 720 U/mg,活性回收率達60.7%,純化后的lupI通過高效液相色譜法進行純度分析,其純度可達99%以上。
蛋白酶抑制劑;原核表達;蛋白純化
蛋白酶是催化肽鍵水解的常用研究和工業用酶,是繼淀粉酶之后一種新的在全世界廣泛應用的酶制劑(主要應用在食品、制革、日化和醫藥行業等)[1-2]。沙雷氏蛋白酶是一種廣泛存在于革蘭氏陰性菌中的胞外分泌蛋白,特別是沙雷氏菌屬、歐文氏菌屬和假單胞桿菌屬中[3]。在研究不同種類沙雷氏蛋白酶的過程中發現:這類蛋白酶基因附近都有一段抑制其酶活性的抑制劑基因[4]該抑制劑的基因與蛋白酶基因在基因組序列中處于緊鄰的位置,屬于同一個分泌體。該抑制劑蛋白分子量一般在11.5 kDa左右,存在于周質空間,在蛋白酶分泌過程中保護有機體不被體外分解[5]。
海洋細菌YS-80是本研究團隊從黃海水樣中分離到的1株高產低溫堿性蛋白酶的菌株。對YS-80所產的主要的堿性蛋白酶進行了分離純化,將其命名為MP,并對其進行了詳細的性質研究,在此基礎上對編碼MP的基因進行了克隆[6]。該蛋白酶MP屬于沙雷氏蛋白酶家族,通過蛋白序列和晶體結構比較獲得該蛋白酶MP與沙雷氏蛋白酶家族的氨基酸同源性最高達83%。并通過懸滴法獲得了該蛋白酶的晶體結構[7]。另外,實驗室在前期擴增MP基因lupA的過程中也獲得了1個抑制劑基因序列lupI,該基因位于蛋白酶MP基因下游,lupI與現有沙雷氏蛋白酶抑制劑APRin的同源性僅為40.9%。抑制劑lupI可完全抑制蛋白酶MP的活性,但是其在胞內的確切生物功能還不清楚[6,8]。
大腸桿菌表達系統是目前最常用的外源蛋白表達系統[9],具有遺傳背景清楚、代謝調控技術成熟、目的基因表達水平高、培養成本低、生長周期短等特點,在重組蛋白質外源基因表達系統中占據主導地位[10]。為進一步探究N端序列延伸后對抑制劑活性的影響,在野生型抑制劑基因的基礎上,通過定點突變將LupI的N端增加Met-Ser-Ser-Ser,本文主要通過構建pET28a-lupI-MSSS原核表達載體在大腸桿菌中表達,通過單因素試驗對該抑制劑的發酵表達條件進行優化,確定較優的誘導表達條件。并對蛋白進行純化,以滿足后續試驗研究的要求。
1 材料與方法
1.1材料與儀器
菌株FlavobacteriumSP. YS-80-122由本研究團隊自黃海水域獲得并鑒定保存;細菌基因組DNA提取試劑盒,Omega;大腸桿菌BL21感受態細胞,康為世紀有限公司;pET28a表達載體菌株,康為世紀有限公司;快速質粒小提試劑盒,康為世紀有限公司;卡那霉素(kanamycin, Kana)、異丙基-β-D-硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside, IPTG),Sigma公司;蛋白胨(Tryptone)和酵母粉(Yeast Extract),英國Oxoid公司;Color Prestained Protein Marker,北京康潤誠業生物科技有限公司;其他試劑,分析純,國藥集團。
定性梯度PCR儀,德國Biometra公司;SHIMADZU UV-2550島津分光光度計,日本島津公司;SW-CJ型超凈工作臺,中外合資蘇州安泰空氣技術有限公司;20PR-52D高速冷凍離心機,日立公司;LKB2219恒溫水浴,瑞典BROMMA公司;JY96-ⅡN型超聲波細胞粉碎機,寧波新芝科技生物股份有限公司;超濾杯,美國默克公司;Bio-Rad Mini III蛋白電泳儀,美國伯樂公司;高效液相色譜儀,美國waters公司;快速液相色譜儀,美國通用電氣。
1.2方法
1.2.1 溶液配制
100 mg/mL Kana貯存液配制:1 g Kana溶于10 mL雙蒸水中,0.22 μm 的濾膜過濾除菌,分裝后于-20 ℃保存。
1 mol/L IPTG貯存液配制:2.38 g IPTG溶于10 mL雙蒸水中,0.22 μm的濾膜過濾除菌,分裝后于-20 ℃保存。
LB液體培養基:蛋白胨 1%,酵母抽提物0.5%,NaCl 1%。LB固體培養基,LB液體培養基+瓊脂2%。
1.2.2 抑制劑蛋白濃度的測定
采用Bradford法[11],以牛血清白蛋白為標準蛋白。
1.2.3 lup-MSSS抑制活性測定
粗酶液的制備:蛋白酶MP酶粉0.5 g溶解在10 mL水中,10 000 r/min離心30 min,上清稀釋200倍為待測酶液。
抑制劑溶液制備:表達后的抑制劑按菌液體積的1/10加入50 mmol/L的Tris-HCl(pH8.0),200 W超聲破碎,10 000 r/min離心15 min后留上清。稀釋5倍,為抑制劑溶液。
活性測定參考國家標準GB/T 23527—2009,具體如下:1 mL酶液與10 μL抑制劑混勻30 ℃靜置10 min;實驗對照為1 mL酶液加10 μL水混勻。加入1 mL含1%的酪素溶液,30 ℃水浴10 min,2 mL 0.4 mol/L三氯乙酸(TCA)終止反應,靜置過濾;空白對照加樣順序為:酶液-TCA-酪素。取濾后溶液1 mL加0.4 mol/L NaCO3溶液5 mL、福林試劑1 mL,混勻,置于40 ℃水浴中顯色20 min取出,冷卻至室溫,680 nm波長下比色。以稀釋后的粗酶液1mL作為標準,以每毫升酶液在30 ℃、pH 7.0條件下水解酪蛋白,每分鐘釋放1 μg酪氨酸所含的酶量定義為1個酶活單位。抑制劑抑制活性用實驗對照組酶活與加抑制劑組酶活差值表示。
1.2.4 PCR擴增基因片段
利用定點突變試劑盒設計合成兩端引物,以LupI野生型表達質粒pET28-lupI為模板,進行PCR反應,獲得編碼抑制劑LupI-MSSS的目的基因片段。PCR擴增條件為:94 ℃預變性5 min,94 ℃變性45 s,55℃退火45 s,72 ℃延伸1 min,循環32次,最后72 ℃再延伸10 min。用1.0% 瓊脂糖凝膠電泳觀察PCR產物。
1.2.5 pET28a-lupI-MSSS原核表達載體的構建及鑒定
將上述PCR擴增得到的基因片段和pET28a原核表達載體分別用NcoI和SalI兩種限制性內切酶雙酶切,然后進行電泳分離并切膠回收。利用無縫克隆試劑盒對酶切后的lupI-MSSS基因片段和pET28a質粒進行連接。涂布含卡那霉素的LB平板,篩選轉化子。挑取6個單克隆,在含卡那霉素的LB液體培養基中培養,收集菌體。提取質粒DNA,酶切驗證。
1.2.6 抑制劑LupI-MSSS在大腸桿菌中的表達
將pET28a-lupI-MSSS重組表達載體轉化至大腸桿菌BL21感受態細胞,在含卡那霉素的LB平板上培養。挑取單克隆,在含有40 μg/mL卡那霉素的LB液體培養基中,200 r/min,37 ℃培養12 h,1%接種量轉接至兩個三角瓶培養,當培養至OD600為0.4~0.6時,一瓶加入終濃度為0.4 mmol/L 的IPTG,37℃誘導,另一瓶不加IPTG作為對照,均繼續培養6 h,離心,收集細胞。加入50 mmol/L pH 8.0的Tris-HCl緩沖液懸浮細胞,超聲波破碎細胞,離心,棄沉淀,取上清液進行SDS-PAGE檢測。
1.2.7 抑制劑LupI-MSSS誘導表達條件優化
1.2.7.1 誘導劑添加時間對LupI-MSSS產量的影響
按2%接種量接種,在37 ℃,200 r/min的條件下分別培養1、2、3、4、5、6 h,加入誘導劑IPTG進行誘導,并在每個時間段取樣測大腸桿菌的菌濃OD600值,誘導完成后收集菌體,超聲破碎后取上清檢測,確定最佳誘導時間。
1.2.7.2 誘導劑濃度對LupI-MSSS產量的影響
按2%接種量接種,在最佳誘導時間加入誘導劑IPTG,調整使其終濃度分別為0.2、0.3、0.4、0.5、0.6、0.7、0.8 mmol/L,誘導完成后收集菌體,超聲破碎后取上清檢測,分析不同終濃度的誘導劑對LupI-MSSS產量的影響,確定最佳誘導劑濃度。
1.2.7.3 誘導溫度對LupI-MSSS產量的影響
按2%接種量接種,在最佳誘導時間加入誘導劑IPTG,調整使其終濃度為上述最佳誘導濃度,設置誘導溫度分別為16、20、27、32、37、42、45 ℃,誘導完成后收集菌體,超聲破碎后取上清檢測,確定最佳誘導溫度。
1.2.7.4 誘導時間對LupI-MSSS產量的影響
按2%接種量接種,在最佳誘導時間加入誘導劑IPTG,調整使其終濃度為最佳誘導濃度,在上述最佳溫度條件下分別誘導2、4、6、8、10、12 h,誘導完成后收集菌體并破碎細胞,檢測抑制劑活性,確定最佳誘導時間。
1.2.8 抑制劑LupI-MSSS純化[12,13]
1.2.8.1 超濾
先用30 kDa的超濾膜收集濾出液,再用3 kDa超濾膜收集濃縮液,濃縮后樣品通過SDS-PAGE檢測[14]。
1.2.8.2 Superdex 200凝膠過濾層析
采用Superdex 200 pg 26/600凝膠柱,用50 mmol/L Tris-HCl緩沖液(pH 8.0)預平衡。將上述經超濾所得蛋白液過0.45 μm的濾膜,進行上樣,上樣量10 mL。同樣的緩沖液進行洗脫,流速1 mL/min,檢測波長為280 nm。分部收集洗脫后的溶液,測定與蛋白峰相對應的洗脫液的抑制活性,確定抑制活性最高的那部分洗脫液。
1.2.8.3 Q-Sepharose離子交換層析
采用Q-Sepharose FF, 20 mL層析柱,用50 mmol/L Tris-HCl緩沖液(pH 8.0)預平衡10個柱體積。將上述經Superdex 200凝膠過濾層析所得蛋白液過0.45 μm的濾膜,上樣,上樣量5 mL。用同樣的緩沖液先將那些未吸附在層析柱上的蛋白洗脫出來;然后用1 mol/L NaCl溶液(50 mmol/L Tris-HCl緩沖液配制,pH 8.0)對吸附在層析柱的蛋白進行梯度洗脫,調節流速為1 mL/min,檢測波長為280 nm。分部收集洗脫后的溶液,測定與蛋白峰相對應的洗脫液的抑制活性,確定活性峰。
1.2.9 抑制劑LupI-MSSS純度測定
利用高效液相色譜法對純化后的樣品進行純度分析。利用TSK3000SW凝膠過濾柱,在波長280 nm處檢測。流動相為100 mmol/L的磷酸緩沖液,100 mmol/L Na2SO4,pH 6.5,流速為0.6 mL/min[15]。
2 結果與分析
2.1抑制劑LupI-MSSS原核表達載體的構建
pET28a-LupI-MSSSBL21擴大培養后提取質粒,并進行NcoI和SalI雙酶切驗證,結果見圖1。其中泳道1為陽性質粒pET28a-LupI-MSSS酶切電泳結果,可以看出,酶切后表達片斷大小約為363 bp,與預期大小相符。

1-LupI-MSSS質粒 M-DNA 1 kb ladder圖1 LupI-MSSS質粒酶切圖Fig.1 dentification of plasmid recombinant by restriction digesting
2.2抑制劑LupI-MSSS誘導表達結果
pET28a-LupI-MSSS重組表達載體轉化表達,菌液離心棄上清,沉淀重懸超聲破碎后,SDS-PAGE電泳檢測,如圖2所示,2泳道中明顯有1條11 kDa左右的條帶,與預測蛋白分子量相符,未加IPTG誘導的1幾乎沒有。而活性測定也表明2有活性,1沒有抑制活性,說明抑制劑LupI-MSSS重組表達成功。

M-蛋白Marker;1-非誘導上清;2-IPTG誘導上清圖2 LupI-MSSS在大腸桿菌中的誘導表達結果Fig.2 SDS-PAGE analysis of LupI-MSSS expressed by E.coli
2.3單因素法優化LupI-MSSS表達條件
2.3.1 誘導劑添加時間對LupI-MSSS產量的影響
誘導劑添加時間與菌體生長密度有關,誘導劑添加的過早,IPTG會抑制菌體增殖,細菌從生長階段進入表達階段,但由于菌體密度較低,因而蛋白表達量不高。誘導劑添加的越晚,菌體密度越高,但菌體相對較老,蛋白表達效率也會降低。如圖3所示,當OD600在0.8左右時,即發酵液培養2 h后添加誘導劑IPTG時,相對抑制活性處于較高水平,之后隨著時間的延長,抑制活性逐漸降低。因此,本試驗確定誘導劑IPTG應在發酵液培養后的2 h(OD600=0.8)時添加。
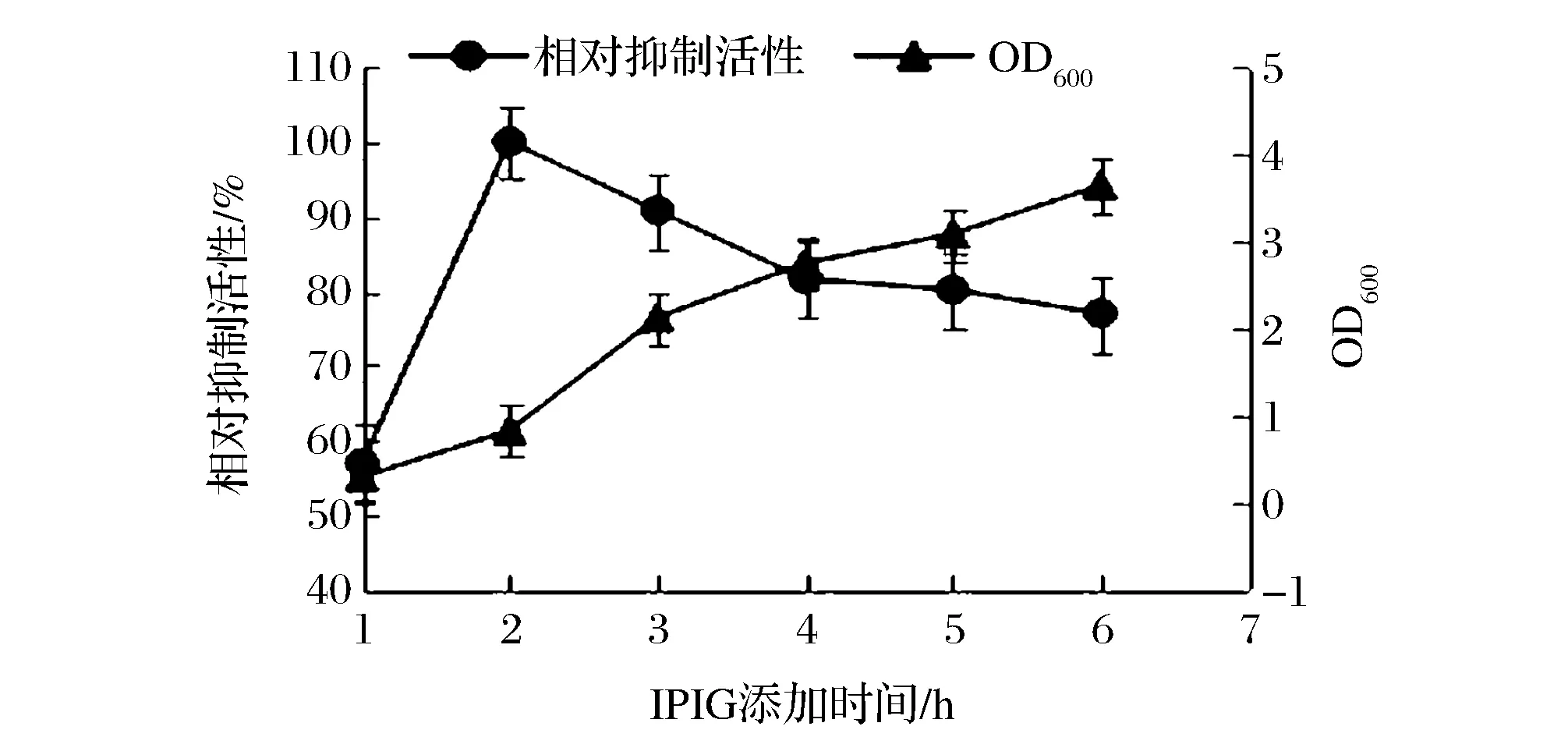
圖3 誘導劑添加時間對LupI-MSSS產量的影響Fig.3 The effects of IPTG addition time on the activity of LupI-MSSS
2.3.2 誘導劑濃度對LupI-MSSS產量的影響
誘導劑IPTG的濃度與蛋白表達的速度相關,在一定范圍內高濃度的IPTG會加快蛋白的表達,但是IPTG具有一定的細胞毒性,濃度過高時會降低細胞的活性,抑制細胞增殖。從圖4中可以看出,當誘導劑濃度在0.4~0.6 mmol/L范圍內,抑制活性維持在相對較高的水平,當誘導劑終濃度為0.5 mmol/L時的相對抑制活性最大,因而確定添加誘導劑的終濃度為0.5 mmol/L。
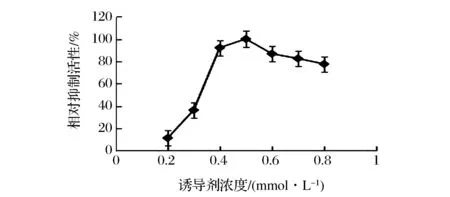
圖4 誘導劑濃度對LupI-MSSS產量的影響Fig.4 The effects of IPTG concentration on the activity of LupI-MSSS
2.3.3 誘導溫度對LupI-MSSS產量的影響
在誘導表達時,較低的溫度下菌體生長緩慢,蛋白表達的速率低,蛋白表達的時間延長。升高溫度,菌體生長速度加快,表達速率提高,但溫度過高時蛋白的表達受到抑制。如圖5所示,37 ℃誘導時,LupI-MSSS表達量明顯高于其他幾個溫度的表達量,故IPTG誘導抑制劑LupI-MSSS表達的最優溫度選擇37 ℃。

圖5 誘導溫度對LupI-MSSS產量的影響Fig.5 The effects of induction temperature on the activity of LupI-MSSS
2.3.4 誘導時間對LupI-MSSS產量的影響
考察不同誘導時間對產酶的影響結果如圖6所示,當誘導時間為2~8 h時,菌體密度逐漸升高,蛋白合成旺盛,抑制劑活性隨誘導時間的延長而提高,在8 h時達到最高值,當誘導時間超過8 h時,菌體由于生長時間過長而衰退,抑制活性開始逐漸降低,確定8 h作為該基因工程菌的最佳誘導時間。
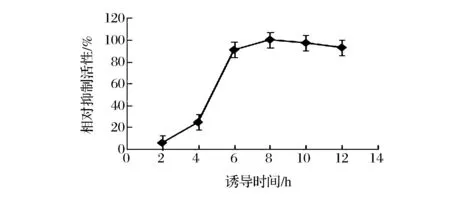
圖6 誘導時間對LupI-MSSS產量的影響Fig.6 The effects of induction time on the activity of LupI-MSSS
2.4抑制劑LupI-MSSS純化結果
2.4.1 超濾
經過30 kDa濾膜過濾后,分子量較大的大部分雜蛋白被除去,用3 kDa超濾膜進行濃縮,發現仍有少量雜蛋白存在。
2.4.2 Superdex 200凝膠過濾層析
超濾濃縮后的樣品過0.45 μm濾膜,用于Superdex 200凝膠過濾層析進行進一步的分離純化,洗脫結果如圖7所示,分部收集后的活性測定結果表明,只有第2個峰具有抑制活性。

圖7 Superdex 200凝膠過濾層析Fig.7 Superdex 200 gel filtration chromatography
2.4.3 Q-Sepharose離子交換層析
Superdex 200凝膠過濾層析后的活性峰樣品過0.45 μm濾膜,用于Q-Sepharose離子交換層析進行進一步的純化。如圖8所示,僅洗脫峰1有活性,目的蛋白的洗脫收集條件為0.6 mol/L NaCl。

圖8 Q-Sepharose離子交換層析Fig.8 Q-Sepharose ion exchange chromatography
2.4.4 抑制劑LupI-MSSS純化結果[12,16]
對LupI-MSSS粗蛋白進行3步純化:超濾,Superdex 200凝膠過濾層析,Q-Sepharose離子交換層析,結果如表1所示,目的蛋白純化倍數為20,比活力為15 720 U/mg,活性回收率為60.7%。

表1 大腸桿菌表達LupI-MSSS的純化結果
2.4.5 SDS-PAGE電泳

1-粗蛋白;2-30 kDa濾出液;3-3 kDa濃縮液;4-Superdex 200;5-Q-Sepharose圖9 LupI-MSSS純化的SDS-PAGE結果Fig.9 SDS-PAGE analysis of purified LupI-MSSS
2.4.6LupI-MSSS純度鑒定結果[15]
對純化后的LupI-MSSS進行蛋白質純度檢測。在1.2.9色譜條件下,取驗證試驗洗脫峰樣品溶液進樣20 μL,保存色譜峰圖。根據峰面積歸一法,計算抑制劑LupI-MSSS的純度。蛋白酶抑制劑LupI-MSSS經過高效液相色譜法檢測后的純度結果如圖10。抑制劑LupI-MSSS表現為單一的色譜峰,峰型較為對稱,分離純度較好。經過峰面積歸一法計算,其純度高達99.7%。
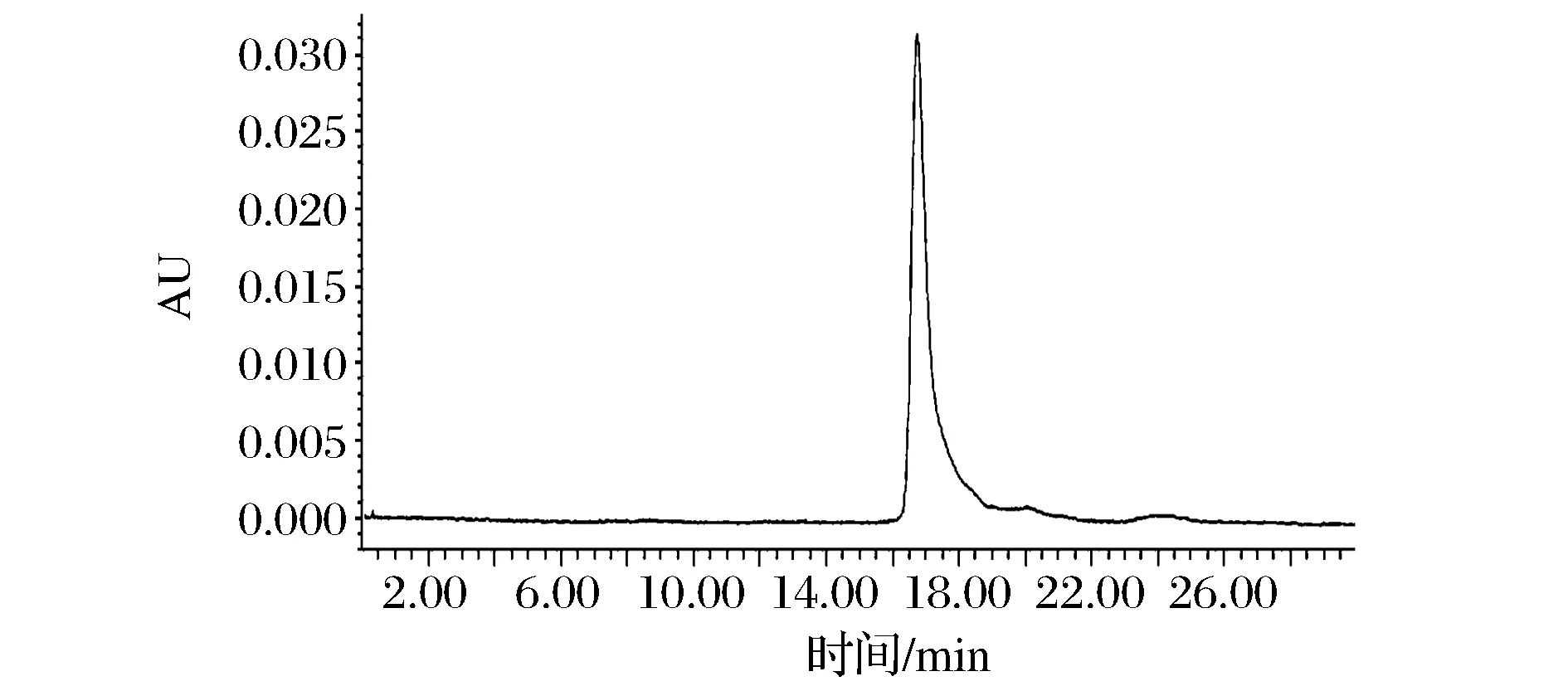
圖10 HPLC法純度檢測結果Fig.10 HPLC analysis of the purified lupI
3 結果與討論
本文將擴增得到的編碼LupI-MSSS的目的基因片段和pET28a原核表達載體進行連接轉化并轉化大腸桿菌BL21(DE3)誘導表達,SDS-PAGE凝膠電泳結果表明,該蛋白的大小約11 kDa,與預測的蛋白分子質量一致。為提高LupI-MSSS的表達量,對影響蛋白表達的幾個主要因素進行了優化,經初步優化得到了其誘導表達的條件為:誘導劑添加時間3 h,誘導劑IPTG終濃度0.5 mmol/L,誘導溫度為37 ℃,誘導時間為8 h。在該條件下,抑制劑LupI-MSSS表達量較高,可發酵表達供后續純化。對表達后的抑制劑進行純化,純化的步驟為:超濾,Superdex 200凝膠過濾層析,Q-Sepharose離子交換層析,3步純化后目的蛋白純化倍數為20,活性回收率達60.7%,純度達99%以上,達到較好的預期純化效果,且回收率較高。
對沙雷氏蛋白酶這一類酶與抑制劑相互作用研究較多的是一種來源于假單胞桿菌的堿性蛋白酶APR與其抑制劑APRin形成一個緊密結合的復合物[8]。通過研究這一復合物的晶體結構發現酶與抑制劑有兩個結構在空間上相互接觸,一個是連接抑制劑β折疊片IV和V之間的loop環連接,它與酶的Met轉角區相互接觸。另一個是N端trunk結構,該結構幾乎成直線狀伸入蛋白酶的β桶結構,并占據了酶的活性中心,阻止其他多肽底物進入酶的活性中心,從而抑制該蛋白酶的活性[17-18]。本研究制備了該抑制劑的高純度蛋白,為進一步進行蛋白結構生物學研究提供了扎實的技術儲備。在此基礎上,開展晶體優化培養、蛋白結構生物學和基因功能機制研究,將對我們揭示酶與抑制劑相互作用的結構基礎和深入了解沙雷氏蛋白酶的分泌調控機理發揮重要作用。
[1] MAAL K B M,EMTIAZI G,NAHVI I.Production of alkaline protease by bacillus cereus and bacillus polymixa in new industrial culture mediums and its immobilization[J].African Journal of Microbiology Research,2009,3(9):491-497.
[2] MOHAMMED K,RAMTEKE P W.Recent developments in production and biotechnological applications of cold-active microbial proteases[J].Critical Reviews in Microbiology,2012,38(4):330-338.
[3] BHAKTI B,APTE S K.A novel serralysin metalloprotease fromDeinococcusradiodurans[J].Biochimica et Biophysica Acta: Proteins and Proteomics, 2008,1784(9):1 256-1 264.
[4] SANTIAGO R,MICHEL K,LESZEK K,et al. Metzincin proteases and their inhibitors: foes or friends in nervous system physiology[J].The Journal of Neuroscience,2010,30(46):15 337-15 357.
[5] Létoffé S, Delepelaire P, Wandersman C. Characterization of a protein inhibitor of extracellular proteases produced byErwiniachrysanthemi[J].Molecular Microbiology,1989,3(1):79-86.
[6] WANG Fang, HAO Jianhua, YANG Chengye, et al. Cloning, expression, and identification of a novel extracellular cold-adapted alkaline protease gene of the marine bacterium strain YS-80-122[J].Applied Biochemistry and Biotechnology.2010,162(5):1 497-1 505.
[7] ZHANG Si-cai,SUN Mi,LI Tang,et al. Structure analysis of a new psychrophilic marine protease[J].PLoS One,2011,6(11):e26939.
[8] OTLEWSKI J,JELEN F,ZAKRZEWSKAL M,et al.The many faces of protease—protein inhibitor interaction[J].EMBO Journal,2005,24(7):1 303-1 310.
[9] NAGESH K. Production and purification of recombinant proteins fromEscherichiacoli[J].Chem Bio Eng Reviews,2016,3(3):116-133.
[10] DONG X,TANG B, LI J, et al. Expression and purification of intact and functional soybean (Glycine max) seed ferritin complex inEscherichiacoli[J].J Microbiol Biotechnol, 2008,18(2):299-307.
[11] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976,72:248-254.
[12] FU Xin-hua,WANG Wei,HAO Jian-hua,et al. Purification and characterization of catalase from marine bacteriumAcinetobactersp. YS0810.[J].Bio Med Research International,2014:409626.
[13] KEMEL J,OLFA G B,HANEN B A,et al.Alkaline-protease fromBacilluslicheniformisMP1: Purification, characterization and potential application as a detergent additive and for shrimp waste deproteinization[J].Process Biochemistry,2011,46(6):1 248-1 256.
[14] LEI Fen-fen,CUI Chun,ZHAO Hai-feng,et al.Purification and characterization of a new neutral metalloprotease from marineExiguobacteriumsp. SWJS2[J].Biotechnology & Applied Biochemistry,2016,63(2):238-248.
[15] LI Shang-yong,WANG Lin-na,YANG Juan,et al.Affinity purification of metalloprotease from marine bacterium using immobilized metal affinity chromatography[J].J Sep Sci,2016,39(11):2 050-2 056.
[16] ZENG Hua-wei,CAI Yu-jie,LIAO Xiang-ru,et al.Production, characterization, cloning and sequence analysis of a monofunctional catalase fromSerratiamarcescensSYBC08[J].Journal of Basic Microbiology,2011,51(2):205-214.
[17] ARUMUGAN S,ROBERT D G,LANE A N.NMR structure note: alkaline proteinase inhibitor APR in fromPseudomonasaeruginosa[J].Journal of Biomolecular NMR,2008,40(3):213-217.
[18] HEGE T,FELTZER R E,GRAY R D,et al.Crystal structure of a complex betweenPseudomonasaeruginosaalkaline protease and its cognate inhibitor. Inhibition by a zinc-NH2coordinative bond[J].Journal of Biological Chemistry,2001,276(37):35 087-35 092.
ConstructionofprokaryoticexpressionvectorforexpressionandpurificationofinhibitorlupI-MSSS
WANG Kun1,2,LIANG Peng-juan1,LI Shang-yong1,WANG Wei1, SUN Jing-jing1,LIU Jun-zhong1,SUN Mi1,HAO Jian-hua1*
1(Key Laboratory of Polar Fisheries Development, Laboratory for Marine Drugs and Bioproducts,Qingdao National Laboratory for Marine Science and Technology,Yellow Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences Qingdao 266071, China) 2(College of Food Sciences & Technology,Shanghai Ocean University, Shanghai 201306, China)
The alkaline metalloproteases MP is extracted from the strain YS-80-122 and belongs to the family of serralysin. Similarly to the other enzymes of this family reported before,there is an inhibitor genelupIdownstream of the MP gene andLupIcan completely inhibit the activity of MP.On the basis of the wild-type inhibitor gene, four amino acids were added to the N-terminus ofLupI, namedLupI-MSSS.This work aims to construct a prokaryotic expression vector forLupI-MSSS, the recombinant plasmid was transformed to BL21 (DE3), and the expression was induced by IPTG. The recombinationLupI-MSSSwas separated using SDS-PAGE and the size of expressedLupI-MSSSwas consistent with the prediction. Single factor experiment were used to optimize the fermentation condition and the optimal conditions were :the inoculation amount is 2 %, IPTG as the induced agent was added at 3 h after inoculating, and it's final concentration is 0.5 mmol/L, the recombined E.coli need inducing 8 hours at 37 ℃.Consecutive steps were used to achieve the purified protein as follows: ultrafiltration, Q Sepharose ion exchange, Superdex 200 gel filtration, and the purity of LupI-MSSS is up to 99%.
inhibitor of protease; prokaryotic expression; purification
10.13995/j.cnki.11-1802/ts.014069
碩士研究生(郝建華研究員為通訊作者,E-mail:haojh@ysfri.ac.cn)。
國家自然科學基金(41376175);國家實驗室-鰲山科技計劃(2016ASKJ14)
2017-02-16,改回日期:2017-04-09

