XpertMTB/RIF試驗快速診斷結核病的研究進展
付沛文(FU Pei-wen),李世寶(LI Shi-bao),2,李洪春(LI Hong-chun),2,顧 兵(GU Bing),2
(1 徐州醫科大學醫學技術學院, 江蘇 徐州 221004; 2 徐州醫科大學附屬醫院, 江蘇 徐州 221002)
·綜述·
XpertMTB/RIF試驗快速診斷結核病的研究進展
付沛文(FU Pei-wen)1,李世寶(LI Shi-bao)1,2,李洪春(LI Hong-chun)1,2,顧 兵(GU Bing)1,2
(1 徐州醫科大學醫學技術學院, 江蘇 徐州 221004; 2 徐州醫科大學附屬醫院, 江蘇 徐州 221002)
結核病; Xpert MTB/RIF試驗; 診斷效能
結核病是由結核分枝桿菌(Mycobacteriumtuberculosis, MTB)感染引起的慢性傳染病,仍然是全世界公共衛生面臨的重大威脅。據世界衛生組織統計[1-2],我國2014年的新發肺結核人數位居全球第三位,是22個全球結核病高負擔國家之一。目前肺結核的診斷主要依靠痰涂片抗酸染色,但由于痰涂片對標本的含菌量要求高,導致其診斷結核病的敏感度較低。診斷結核病的金標準是MTB培養[3],由于MTB生長緩慢的習性,導致培養所需時間較長(2~6周),僅用MTB培養診斷結核病可能延誤治療。耐多藥結核病的傳統診斷方法是藥物敏感試驗[4],該方法有對實驗室要求高及耗時長的缺點。因此,尋求快速診斷結核病和耐多藥結核病的方法成為控制結核病的重點。近些年涌現出許多基于分子生物學或免疫學的方法,利福平耐藥實時熒光定量核酸擴增檢測技術(Xpert MTB /RIF)就是其中最有應用前景的方法之一。本文就Xpert MTB /RIF的發展、應用現狀以及對特殊人群的診斷價值進行綜述。
1 Xpert MTB /RIF檢測方法的發展
Xpert MTB /RIF試驗以半巢式實時熒光定量PCR技術為基礎,rpoB基因為靶基因,系統自動運行并檢測標本中是否含有結核分枝桿菌,以及利福平是否耐藥,全程約2 h。1998年,Piatek等[5]首先提出以分子信標技術為基礎,以rpoB基因為靶基因對結核分枝桿菌進行檢測的試驗模型,隨后有多位研究者將分子信標技術應用于耐藥結核菌株的檢測[6-7]。全自動快速分子病原學診斷檢測系統Gene Xpert平臺由美國國防部資助研發,2009年美國Cepheid公司在Gene Xpert PCR平臺基礎上成功研發出一種應用于結核病診斷領域的新技術——Xpert MTB/RIF技術,包括Gene Xpert PCR平臺和Xpert MTB/RIF診斷試劑盒。2010年12月,世界衛生組織(WHO)首次向國際社會推薦將Xpert MTB/RIF用于結核病和利福平耐藥快速檢測,并組織專家組對該技術檢測的準確性進行綜述性分析,于2011年初推出關于Xpert MTB/RIF應用的政策性指南[8],對其進行重點推廣。
1.1 測定原理 Xpert MTB/RIF試驗以半巢式實時定量PCR技術為基礎,以rpoB基因為靶基因,設計出5個相互重疊的分子探針(分別以探針A~E命名)選擇性覆蓋rpoB基因的81 bp核心區,同時根據球芽孢桿菌的基因組設計1條對照探針,通過這條探針的熒光顯示結果對標本中的結核分枝桿菌及對利福平的耐藥情況進行檢測,具體理論基礎如下。
1.1.1 rpoB基因在同一菌種中高度保守 分枝桿菌的rpoB基因為分枝桿菌依賴DNA的RNA聚合酶β亞單位的編碼基因,rpoB基因同時具有保守序列和可變序列,具有顯著的種間相似度和種內相似度高的特點,利用rpoB基因的保守序列和可變序列,可以對分枝桿菌進行菌種鑒定。
1.1.2 MTB對利福平的耐藥機制由rpoB基因的點突變造成 利福平的作用機制是與結核分枝桿菌DNA依賴的RNA聚合酶中的β亞基結合,干擾轉錄的開始和RNA的延長而起到抗菌作用,rpoB基因的突變可導致利福平無法與β亞基結合而失效。此外,由于大部分利福平耐藥菌株同時對異煙肼耐藥,故利福平耐藥情況在一定程度上可作為耐多藥結核病的監測指標[9]。
1.2 試驗方法 將不同標本按相應預處理方法處理后,取2 mL所得混合液轉移至一次性多室塑料反應盒中。樣品自動洗滌和過濾,自動超聲破碎樣品,釋放核酸,DNA與PCR試劑混合,半巢式熒光定量PCR擴增和檢測,打印結果。不同類型臨床標本預處理方法[10],見表1。

表1 Xpert MTB/RIF試驗中不同臨床標本的預處理方法
1.3 結果判讀 結果判讀依照探針的循環閾值(Ct值),當內對照探針(即芽孢桿菌內對照)的Ct值≤38時為陽性,反之則為無效,提示標本提取不合格或含有PCR抑制物。MTB陽性的診斷標準為5個探針中至少2個探針Ct值≤38,并可進一步按照Ct值對標本中的MTB進行半定量分析,Ct值<16為高荷菌量,16~22為中等荷菌量,22~28為低荷菌量,>28為極低荷菌量。檢測利福平耐藥的基礎在于MTB特異性分子信標早期Ct值與晚期Ct值之差,即△Ct值。系統設置的結果判斷標準為:△Ct>3.5提示對利福平耐藥,△Ct≤3.5提示對利福平敏感。由于終止循環數為38個循環,因此,當早期探針Ct值>34.5或晚期探針>38時,利福平耐藥結果不確定。
2 MTB/RIF試驗對不同臨床標本的診斷效能
研究表明,Xpert MTB/RIF試驗對肺結核的診斷價值已經逐步得到證實[11-12],其中痰標本敏感度最高可達97.50%,特異度在95.00%~99.00%;但對肺外結核診斷研究尚不一致,敏感度欠佳,但是具有較高的特異度,即在確診肺外結核方面具有較高的價值。國內外Xpert MTB/RIF試驗與涂片顯微鏡檢查針對不同類型臨床標本檢測效能(以細菌培養結果為金標準)[13-22],見表2。
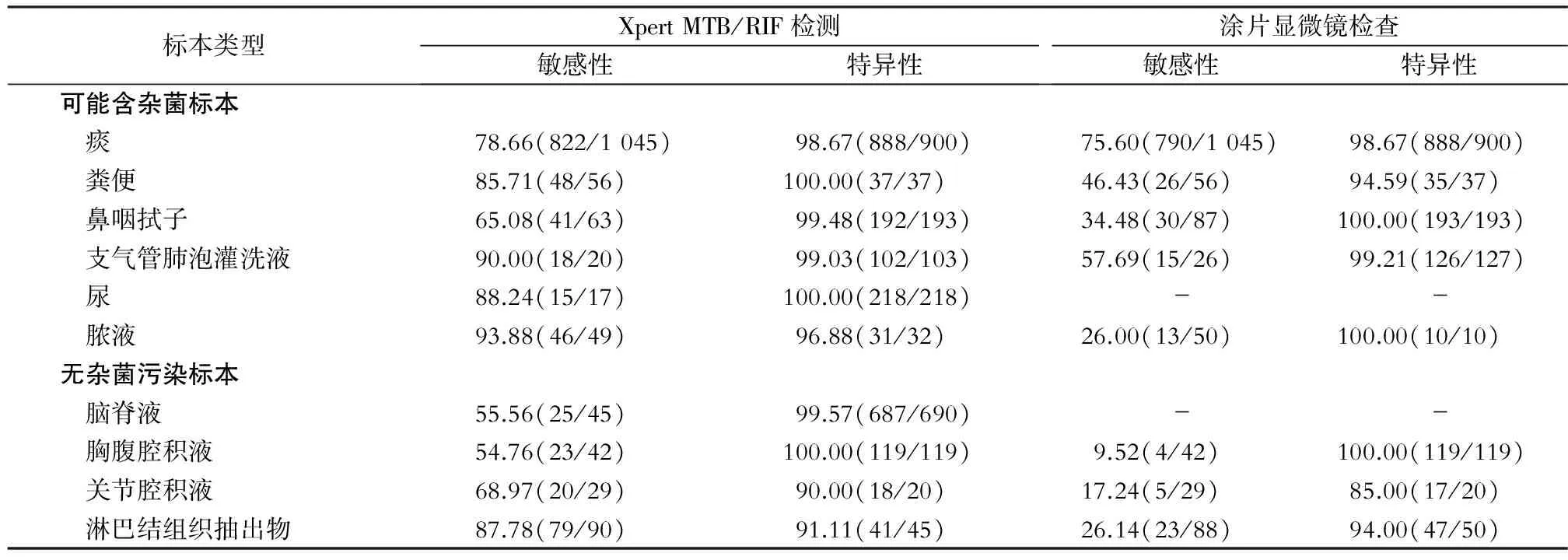
表2 不同類型臨床標本Xpert MTB/RIF試驗與涂片顯微鏡檢查的敏感性與特異性(%)
3 Xpert MTB/RIF試驗在特殊人群中結核病診斷價值
2015年,世界范圍內估計有1 040萬新發結核病病例,其中成人患者中男性590萬(56.73%),女性350萬(33.65%);兒童100萬(9.62%)。新發病例中有120萬(11.54%)人類免疫缺陷病毒(HIV)感染患者[2]。國內外研究[23-25]證實,Xpert MTB/RIF試驗在成年人及未感染HIV的患者中有較高的敏感性和特異性,而在兒童結核病以及結核合并HIV感染者中的應用價值尚在研究階段。
3.1 Xpert MTB/RIF試驗在兒童結核病診斷中的應用 兒童是結核菌的主要易感者,少數感染嚴重的兒童,會發生急性血行播散型結核病和結核性腦膜炎等嚴重疾病,危及兒童健康和生命。每年約有7.4萬例HIV陰性患兒死于結核病[26]。早期發現和早期治療兒童原發型肺結核對進一步降低結核病病死率有重要意義。結核病患兒細菌載量低于成人患者,病灶部位常伴有明顯炎性滲出,排菌量低,且嬰幼兒排痰困難,常將痰液咽下,涂片鏡檢在兒童標本中的陽性率不足15%[27]。Singh等[28]報道了2009—2012年Xpert MTB/RIF試驗在印度地區兒童結核病中的應用情況,以培養為金標準,胃液標本敏感性和特異性分別為67.5%和89.6%,痰標本為70.0%和94.3%。國內張愛梅等[29]研究中胃液標本和痰標本的敏感性分別為33.3%和57.1%,低于印度地區,但兩種標本特異性較高,均為100%。Tortoli等[30]通過對494份兒童非呼吸道標本(包括組織活檢、膿液、胃腸道抽吸物、尿和腦脊液)的檢測用于診斷肺外結核,發現其敏感性達到86.9%,結果略高于成人。Xpert MTB/RIF試驗對兒童結核病的診斷價值尚需更多的研究證實并推廣。
3.2 Xpert MTB/RIF試驗在篩查HIV感染結核病患者中的應用 HIV感染者與艾滋病(AIDS)患者由于處于免疫妥協狀態,多表現為肺外結核和涂陰肺結核,目前診斷潛伏性MTB感染的檢測手段敏感度欠佳,漏診率較高。MTB感染導致機體免疫應答反應以細胞免疫為主,但對于HIV感染者與AIDS患者來說,不同的免疫缺陷程度影響著潛伏性感染檢測手段的應答反應。研究[31]表明在高MTB感染的流行區域,PPD試驗陽性的發生率在HIV感染者與非HIV感染者人群之間有明顯差異,只有當CD4+淋巴細胞計數>500個/μL時,兩組發生率是相似的。研究顯示CD4+淋巴細胞計數對PPD試驗和T-SPOT這兩種檢測方法的檢測結果均起重要作用,其陽性率與CD4+淋巴細胞計數呈正比,且認為,相較于PPD試驗而言,T-SPOT受CD4+淋巴細胞計數的影響更小[32]。Carriquiry等[33]對131例臨床高度懷疑結核病的HIV感染者進行Xpert MTB/RIF試驗檢測,并與改良羅氏培養和液體培養方法比較,結果顯示,Xpert MTB/RIF試驗的敏感性高達97.8%,特異性為97.7%;陽性預測值為95.7%,陰性預測值為98.8%。一項由多國共同參與的結核病防治項目數據顯示[34],Xpert MTB/RIF試驗在HIV感染者中的敏感性(82.4%)與非HIV感染者(90.7%)比較,差異無統計學意義(P>0.05),而在同時進行的痰涂片顯微鏡檢測中,HIV感染者的敏感性為44.6%;非HIV感染者敏感性為68.6%。因此,WHO建議,Xpert MTB/RIF試驗可作為HIV感染者及AIDS患者結核病篩查的首選方法。
4 Xpert MTB/RIF試驗用于療效監測的新進展
2013年,Friedrich等[35]招募221例MTB涂片陽性患者接受結核抗菌藥物治療,并在治療開始的第0~8周每周獲取合格痰標本,利用Xpert MTB / RIF測定MTR特異性DNA測序,隨后在第12、17、22、26周做相同操作,并將結果與鏡下涂片和細菌培養進行比較,結果顯示Xpert MTB/RIF試驗相比于以上兩種方法,有較高的靈敏度(95%CI:95.8%~97.9%)和較低的特異度(95%CI:45.0%~52.2%)。作者認為Xpert MTB/RIF技術無法識別細菌存活狀態,在結核療效監測過程中假陽性率較高,特異度較低,因此,不宜用于MTB治療過程的療效監測。
目前有新的研究[36]認為,Friedrich等將Xpert結果僅以“DNA檢出”或“DNA未檢出”作為二元指標進行療效監測存在一定的缺陷。Xpert能揭示循環閾值(Ct)中的定量輸出,進而可縱向動態檢測痰液中桿菌的載荷量。結果顯示,采用非線性混合效應模型來表明縱向Ct數據與利福噴丁暴露量之間的關系(濃度-時間曲線下面積[AUC]),利福噴丁藥物暴露量每增加100 mcg*h/mL,Ct斜率約上升0.11Ct /周(95%CI:0.05-0.17),利福噴丁暴露量(未分配劑量)與Ct變化率相關(P= 0.02);此外,研究還發現利福噴丁用藥量增加與Xpert Ct變化率加快(表明結核分枝桿菌DNA清除加快)有關[36]。目前臨床上無統一有效的肺結核病療效評價標準,此類研究為Xpert MTB/RIF試驗用于結核病療效監測提供了新思路。
5 展望
目前,世界上許多國家已經開展了Xpert MTB/RIF試驗。該方法具有高度敏感性和特異性、快速簡單、交叉污染少、能同時檢測利福平耐藥菌株等優點,使之有望在全球范圍內得到廣泛應用。但是,Xpert MTB/RIF試驗檢測成本較高;標本中一些非結核分枝桿菌的耐藥基因與MTB耐藥基因存在一定同源性,使得檢測利福平耐藥時可出現假陽性結果;且中國大部分地區以異煙肼耐藥為主,而該方法不能直接檢測MTB異煙肼耐藥,只能在一定程度上作為耐多藥結核病的監測指標。但其有助于臨床上早期快速診斷結核病,更早撤除陰性患者的空氣傳播隔離,快速識別真正需要隔離的患者,醫院可以鎖定目標、集中資源,最有效地控制感染。
[1] World Health Organization. Global tuberculosis report 2015[M]. Geneva: WHO, 2015.
[2] World Health Organization. Global tuberculosis report 2016[M]. Geneva: WHO, 2016.
[3] 中華醫學會結核病學分會.肺結核診斷和治療指南[J].中華結核和呼吸雜志, 2001, 24(2): 70-74.
[4] 王黎霞.結核分枝桿菌藥物敏感性實驗標準化操作程序及質量保證手冊[M].北京:人民衛生出版社, 2013:1-40.
[5] Piatek AS, Tyagi S, Pol AC, et al. Molecular beacon sequence analysis for detecting drug resistance inMycobacteriumtuberculosis[J]. Nat Biotechnol, 1998, 16(4): 359-363.
[6] Piatek AS, Telenti A, Murray MR, et al. Genotypic analysis ofMycobacteriumtuberculosisin two distinct populations using molecular beacons: implications for rapid susceptibility testing[J]. Antimicrob Agents Chemother, 2000, 44(1): 103-110.
[7] El-Hajj HH, Marras SA, Tyagi S, et al. Detection of rifampin resistance inMycobacteriumtuberculosisin a single tube with molecular beacons[J]. J Clin Microbiol, 2001, 39(11): 4131-4137.
[8] World Health Organization. Automated real-time nucleic acid amplification technology for rapid and simultaneous detection of tuberculosis and rifampicin resistance: Xpert MTB/RIF system. Policy statement[EB/OL].(2011-04)[2014-02]. http://apps.who.int/iris/bitstream/10665/44586/1/978924 1501545_eng.pdf?ua=1&ua=1.
[9] Mokrousov I, Otten T, Vyshnevskiy B, et al. Allele-specificrpoB PCR assay for detection of rifampin-resistanceMycobacteriumtuberculosisin sputum smears[J]. Antimicrrob Agents Chemother, 2003, 47(7): 2231-2235.
[10] World Health Organization. Xpert MTB/RIF implementation manual: technical and operational ‘how-to’; practical considerations[M] .Geneva: WHO, 2014.
[11] Chang K, Lu W, Wang J, et al. Rapid and effective diagnosis of tuberculosis and rifampicin resistance with Xpert MTB/RIF assay: a meta-analysis[J]. J Infect, 2012, 64(6): 580-588.
[12] 李妍, 張天華, 鮮小萍, 等.Xpert MTB/RIF檢測技術診斷肺結核和肺外結核的價值[J].中國防癆雜志, 2015, 37(6):586-589.
[13] 李輝, 譚耀駒, 李洪敏, 等.利福平耐藥實時熒光定量核酸擴增檢測技術的診斷效果對比研究[J].中國防癆雜志, 2014, 36(6):472-476.
[14] Kokuto H, Sasaki Y, Yoshimatsu S, et al. Detection ofMycobacteriumtuberculosis(MTB) in fecal specimens from adults diagnosed with pulmonary tuberculosis using the Xpert MTB/rifampicin test[J]. Open Forum Infect Dis, 2015, 2(2): ofv074.
[15] Zar HJ, Workman L, Isaacs W, et al. Rapid molecular diagnosis of pulmonary tuberculosis in children using nasopharyngeal specimens[J]. Clin Infect Dis, 2012, 55(8): 1088-1095.
[16] Theron G, Peter J, Meldau R, et al. Accuracy and impact of Xpert MTB/RIF for the diagnosis of smear-negative or sputum-scarce tuberculosis using bronchoalveolar lavage fluid[J]. Thorax, 2013, 68(11): 1043-1051.
[17] Gu Y, Wang G, Dong W, et al. Xpert MTB/RIF and GenoType MTBDRplus assays for the rapid diagnosis of bone and joint tuberculosis[J]. Int J Infect Dis, 2015, 36: 27-30.
[18] Mazzola E, Arosio M, Nava A, et al. Performance of real-time PCR Xpert MTB/RIF in diagnosing extrapulmonary tuberculosis[J]. Infez Med, 2016, 24(4): 304-309.
[19] Pink F, Brown TJ, Kranzer K. Evaluation of Xpert MTB/RIF for detection ofMycobacteriumtuberculosisin cerebrospinal fluid[J]. J Clin Microbiol, 2016, 54(3): 809-811.
[20] Rufai SB, Singh A, Kumar P, et al. Performance of Xpert MTB/RIF assay in diagnosis of pleural tuberculosis by use of pleural fluid samples[J]. J Clin Microbiol, 2015, 53(11): 3636-3638.
[21] 唐愷, 董偉杰, 蘭汀隆, 等.應用Xpert MTB/RIF技術快速診斷膝關節結核[J].中國防癆雜志, 2016, 38(4):300-304.
[22] Tadesse M, Abebe G, Abdissa K, et al. GeneXpert MTB/RIF assay for the diagnosis of tuberculous lymphadenitis on concentrated fine needle aspirates in high tuberculosis burden settings[J]. PLoS One, 2015, 10(9): e0137471.
[23] Akkerman OW, van der Werf TS, de Boer M, et al. Comparison of 14 molecular assays for detection ofMycobacteriumtuberculosiscomplex in bronchoalveolar lavage fluid[J]. Clin Microbiol, 2013, 51(11): 3505-3511.
[24] Kayigire XA, Friedrich SO, Venter A, et al. Direct comparison of Xpert MTB/RIF assay with liquid and solid mycobacterial culture for quantification of early bactericidal activity[J]. Clin Microbiol, 2013, 51(6): 1894-1898.
[25] Hu P, Bai L, Liu F, et al. Evaluation of the Xpert MTB/RIF assay for diagnosis of tuberculosis and rifampin resistance in county-level laboratories in Hunan province, China[J]. Chin Med J (Engl), 2014, 127(21): 3744-3750.
[26] Chisti MJ, Graham SM, Duke T, et al. A prospective study of the prevalence of tuberculosis and bacteraemia in Bangladeshi children with severe malnutrition and pneumonia including an evaluation of Xpert MTB/RIF assay[J]. PLoS One, 2014, 9(4): e93776.
[27] Nhu NT, Ha DT, Anh ND, et al. Evaluation of Xpert MTB/RIF and MODS assay for the diagnosis of pediatric tuberculosis[J]. BMC Infect Dis, 2013, 13: 31.
[28] Singh S, Singh A, Prajapati S, et al. Xpert MTB/RIF assay can be used on archived gastric aspirate and induced sputum samples for sensitive diagnosis of paediatric tuberculosis[J]. BMC Microbiol, 2015, 15:191.
[29] 張愛梅, 李鋒, 劉旭暉, 等.利福平耐藥實時熒光定量核酸擴增技術在兒童結核病快速檢測中的應用[J].中華兒科雜志, 2016, 54(5):370-374.
[30] Tortoli E, Russo C, Piersimoni C, et al. Clinical validation of Xpert MTB/RIF for the diagnosis of extrapulmonary tuberculosis[J]. Eur Respir J, 2012, 40(2): 442-447.
[31] García-García ML, Valdespino-Gómez JL, García-Sancho C, et al. Underestimation ofMycobacteriumtuberculosisinfection in HIV-infection subjects using reactivity to tuberculin and anergy panel[J]. Int J Epidemiol, 2000, 29(2): 369- 375.
[32] Yang CH, Chan PC, Liao ST, et al. Strategy to better select HIV-infected individuals for latent TB treatment in BCG-vaccinated population[J]. PLoS One, 2013, 8(8): e73069.
[33] Carriquiry G, Otero L, González-Lagos E, et al. A diagnostic accuracy study of Xpert?MTB/RIF in HIV-positive patients with high clinical suspicion of pulmonary tuberculosis in Lima, Peru[J]. PLoS One, 2012, 7(9): e44626.
[34] Boehme CC, Nicol MP, Nabeta P, et al. Feasibility, diagnostic accuracy, and effectiveness of decentralised use of the Xpert MTB/RIF test for diagnosis of tuberculosis and multidrug resistance: a multicentre implementation study[J]. Lancet, 2011, 377(9776): 1495-1505.
[35] Friedrich SO, Rachow A, Saathoff E, et al. Assessment of the sensitivity and specificity of Xpert MTB/RIF assay as an early sputum biomarker of response to tuberculosis treatment[J]. Lancet Respir Med, 2013, 1(6): 462-470.
[36] Jayakumar A, Savic RM, Everett CK, et al. Xpert MTB/RIF assay shows faster clearance ofMycobacteriumtuberculosisDNA with higher levels of rifapentine exposure[J]. J Clin Microbiol, 2016, 54(12): 3028-3033.
(本文編輯:陳玉華)
AdvancesinrapiddiagnosisoftuberculosisbyXpertMTB/RIFtest
(1 College of Medical Technology, Xuzhou Medical University, Xuzhou 221004, China; 2 Affiliated Hospital of Xuzhou Medical University, Xuzhou 221002, China)
2017-04-20
江蘇省“教科強衛”醫學重點人才項目(ZDRCA2016053)
付沛文(1995-),女(漢族),江蘇省淮安市人,醫學生,主要從事細菌病原體感染研究。
顧兵 E-mail:gb20031129@163.com
10.3969/j.issn.1671-9638.2017.08.022
R521
A
1671-9638(2017)08-0779-05

