血友病B基因治療研究進展
嚴紅,任兆瑞,曾溢滔
血友病B基因治療研究進展
嚴紅,任兆瑞,曾溢滔
血友病 B 是一種 X 染色體連鎖的隱性遺傳性出血性疾病,患者多為男性,女性患者極為罕見,男性人群的發病率約為 1/25000。因患者凝血因子 IX(factor IX,FIX)基因突變導致 FIX 水平缺乏引起,癥狀的嚴重程度與體內FIX 水平相關;重癥患者血漿 FIX 含量小于正常人的 1%,因而頻繁發生自發性出血,如關節內出血、軟組織血腫、腹腔出血和腦出血等,最終導致嚴重的關節病、慢性疼痛,嚴重影響患者生活質量甚至壽命。目前,血友病 B 的主要療法是靜脈注射 FIX 生物制品,但患者需要頻繁地接受注射,且 FIX 制品價格昂貴,造成患者及其家庭嚴重的經濟負擔[1]。
自 20 世紀 80年代 FVIII(凝血因子 VIII)和 FIX基因先后被成功克隆以來,基因治療一直為血友病研究領域的熱點[2-3]。近 30年來血友病 B 基因治療領域的研究成果尤為突出,臨床研究也取得了長足的進展。下面就血友病 B基因治療的研究進展及展望作一評述。
1 凝血因子 IX 的結構和功能
FIX 是一類具有絲氨酸蛋白酶活性的凝血因子,主要由肝臟產生并以無活性的酶原形式分泌入血漿,它在血漿中濃度較低(2.5~5 mg/L),半衰期僅為 24 h[4]。全長 FIX 蛋白共含有 461 個氨基酸,其中包括一段 28 個氨基酸的信號肽和一段 18 個氨基酸的前肽。與凝血因子 VII 和 X一樣,FIX 是維生素 K 依賴性蛋白,含有一個 γ-羧基谷氨酸(GLA)區域,該區域包含 12 個 γ-羧基化位點,這些位點的正確羧基化是維持 FIX 活性所必需的[5]。血液凝集過程中,FIX 可被凝血因子 XIa 或組織因子/凝血因子VIIa 激活,形成活性形式 FIXa;隨后在 Ca2+和磷脂存在的條件下,FIXa 與 FVIII 的活性形式 FVIIIa 共同激活下游的凝血因子 X,最終導致血液凝集。

圖1 FIX 基因及蛋白結構示意圖
FIX 基因位于 X 染色體上,全長約 33.5 kb,由 8 個外顯子和 7 個內含子組成,mRNA 全長 2802 bp。FIX 基因的 8 個外顯子共編碼蛋白的 6 個主要結構域,外顯子1 和 2 分別編碼信號肽和前肽;外顯子 3 編碼 GLA 結構域;外顯子 4 和 5 編碼表皮生長因子樣結構域(EGF-1 和EGF-2);外顯子 6 編碼活化結構域,該區域在 FIX 被激活時被切割,從而變成 FIX 的活性形式;外顯子 7 和 8編碼催化結構域,該區域在激活 FIX 過程中起著十分重要的作用,FIX 基因及蛋白結構如圖 1 所示。血友病 B 主要因患者 FIX 基因突變導致的 FIX 蛋白活性不足而引發,其中點突變是最常見的基因突變類型(約占總突變的64%)[4]。根據血友病 B 患者體內 FIX 水平的不同,可以將患者分為 3 類:當 FIX 水平低于正常水平 1% 時為重型,患者會頻繁發生自發性出血,通常需要經常輸注外源性FIX 控制出血;當 FIX 水平在 1%~5% 之間時為中間型,患者有自發性出血傾向,小手術或外傷后可發生嚴重出血;當 FIX 水平在 5%~40% 之間時,為輕型,患者通常只在大手術或外傷時可致嚴重出血,罕有自發性出血發生[1]。基因突變不僅可引起 FIX 凝血活性的降低,也可增加 FIX的凝血活性。我們早期的研究發現,當 FIX 蛋白 338 位由精氨酸變為丙氨酸(R338A)時,FIX 的體內外凝血活性可提高 2.5~3 倍[6]。在一個意大利家族中也發現一類 FIX功能獲得性突變,FIX 蛋白的 338 位由精氨酸變為亮氨酸(R338L,也被稱為 FIX Padua),該突變導致 FIX 凝血活性增加 5~10 倍。這些功能獲得性突變的研究對血友病 B的基因治療和藥物開發都起到重要的作用[7]。
FIX 的結構及其作用特征使血友病 B 具有以下特點而成為研究基因治療的理想疾病模型:①由單基因突變引起,致病機制明確;② FIX 的 cDNA 長度較短,便于載體攜帶;③ FIX 水平少量提高即能顯著改善疾病癥狀,據現有臨床研究報告,血漿 FIX 提高至正常血漿水平的 1% 以上即可顯著降低重癥患者自發性出血事件發生率;④ FIX治療的有效范圍較寬(達到正常血漿水平的 1%~100% 均可),不需對 FIX 表達水平進行嚴格控制;⑤ FIX 的主要表達器官是肝臟,但多種組織細胞都能正確地表達和修飾FIX,并分泌進入血液;⑥已建立良好的模型動物,包括大動物(血友病 B 犬)和小動物(血友病 B 小鼠)模型。
2 血友病 B 基因治療現狀
早在 2000年,美國費城兒童醫院的研究人員就用腺相關病毒(adeno-associated virus,AAV)作為載體,向重型血友病 B 患者的骨骼肌細胞導入了正常人 FIX 基因。研究選擇骨骼肌細胞主要出于安全性考慮,注射處的骨骼肌可在發生嚴重不良反應時被切除以及時終止研究,保證受試者的安全;且骨骼肌細胞雖并非人 FIX 的主要表達細胞,但體外研究表明骨骼肌細胞可以正確表達并修飾 FIX 蛋白[8]。相關臨床前研究中骨骼肌表達的 FIX 實現了對血友病 B 小鼠和犬的表型糾正并能維持相對較長的時間(血友病 B 小鼠中治療效果維持超過 12 個月,血友病 B 犬中治療效果維持超過 2.5年),但在此次臨床試驗中參加研究的 3 例血友病 B 患者均未顯示同樣的治療效果[9]。后續研究表明人骨骼肌注射位點處可檢測到 FIX 的表達,并且表達可持續超過 10年,但產生的 FIX 總量不足以起到治療效果,接受治療后患者血漿 FIX 濃度仍然 < 1%[10-11];而每個注射位點的注射劑量和注射次數均有限制,無法通過反復注射進一步增加骨骼肌 FIX 的表達[12]。此次試驗的嘗試雖未獲得治療效果,但研究中也未出現嚴重安全問題,這為后續臨床研究的開展奠定了基礎。
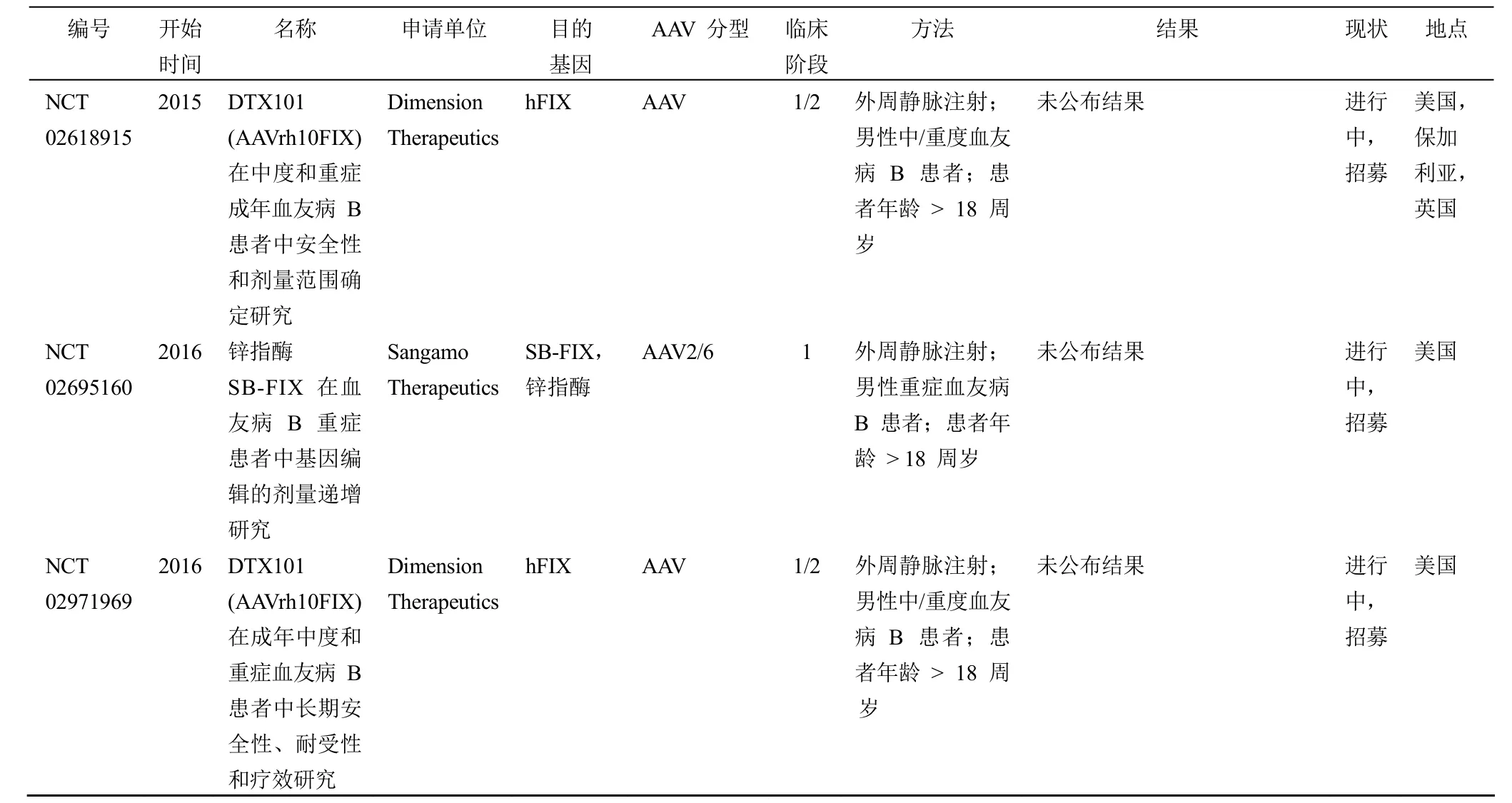
此后,有 10 項血友病 B 基因治療的研究方案陸續進入臨床試驗階段(表 1)。吸取之前基因治療研究的經驗,后續的研究均將靶器官設定為 FIX 的主要表達器官——肝臟,并利用 AAV 病毒作為載體實現肝細胞特異性地表達人 FIX,和上次試驗不同之處在于使用的載體或表達的目的基因有相應的優化。其中,由圣裘德兒童研究醫院發起的臨床研究(clinicaltrials.gov,編號:NCT00979238)首先傳來捷報。該項研究利用 FIX 密碼子優化的、自互補(self-complementary)AAV(scAAV2/8-LP1-hFIXco)作為載體,對 10 名重癥患者進行了臨床研究。相比之前研究采用的載體,scAAV2/8-LP1-hFIXco 的不同之處在于用雙鏈、互補的 DNA 代替 AAV 原本的單鏈 DNA,因此 AAV 感染細胞后無需依賴宿主細胞將單鏈基因組轉變為有轉錄活性的雙鏈基因組,從而大幅增加了感染效率;除此之外還對目的基因 FIX 進行了密碼子的優化以增加表達量。先期披露的結果顯示,scAAV2/8-LP1-hFIXco 可增加患者體內FIX 水平,并在 4 個月內達到穩定水平(正常水平的 1% ~6% 之間),且可穩定維持 3年以上,目前這些患者仍在隨訪中。患者的 FIX 水平與治療劑量相關,其中高劑量組(2 × 1012μg/kg)6 名患者的 FIX 水平均有升高,FIX 平均值達到(5.1 ± 1.7)%,患者的出血事件發生率及相應用藥減少了 90% 以上。試驗中并無嚴重安全事件發生,但高劑量組 4 位患者在接受治療后 7~10 周出現了無癥狀的轉氨酶升高(轉氨酶升高被認為與肝臟損傷或炎癥相關),接受類固醇(氫化潑尼松)治療后,患者轉氨酶水平在 5 d內恢復正常。這是一項里程碑式的研究,成功證明 AAV 作為載體的基因治療能在人體中維持較長時間的相對穩定的FIX 表達,并實現患者表型由重型到輕型的轉換[13-14]。
其他幾個仍在進行的臨床研究,有兩項對表達的目的基因 FIX 進行了優化,采用 FIX 高活性變體(FIX-Padua,其 FIX 的 338 位堿基從精氨酸變為亮氨酸,相比于野生型 FIX 活性增加 5~10 倍)作為目的基因,試圖通過增加 FIX 活性提高基因治療效果(clinicaltrials.gov,編號NCT01687608 和 NCT02484092,分別于 2012年和 2015年由 Baxalta US 和 Spark Therapeutics 公司發起)。由于體內表達非天然蛋白有可能產生強烈的免疫原性,因此人們最為關注的是這兩項試驗是否會出現嚴重的安全問題。目前這兩項研究仍在進行中,尚未有 FIX-Padua 特異的安全問題出現。Spark Therapeutics 公司在 2017年的止血與血栓研究學會(HTRS)科學討論會上對研究進展做了報告。研究結果顯示,10 名重型患者接受載體治療后(劑量為 5 ×1011μg/kg),出血事件減少 96%、治療用藥減少 99%,其中 9 名患者無需再注射 FIX 制品控制出血。治療 12 周后患者體內 FIX 活性水平可穩定維持于 14%~81%,平均值為 33%,比先前的研究結果有大幅的提高。值得注意的是研究中并未發現嚴重的安全風險,未見大家普遍關注的FIX 抑制物生成且無血栓事件發生,但有 2 名患者出現了無癥狀的轉氨酶瞬時升高及 FIX 活性降低的情況,推測原因可能是由人體對載體的免疫反應引起。在接受口服皮質類激素治療后,患者轉氨酶水平回歸正常值,FIX 活性維持穩定水平,其中 1 位患者 FIX 活性最終穩定在 15% 左右,而另一位患者維持在 70%~80% 之間,維持時間超過9 周。這些研究結果表明,在發生病毒衣殼免疫的患者中皮質類激素的耐受性良好,并可控制衣殼免疫反應。本項治療方案已于 2016年 7月獲得美國 FDA 的突破性療法認定[15]。
盡管臨床研究捷報頻傳,然而血友病 B 基因治療的臨床研究過程并非一帆風順。早期 AAV 載體靶向肝臟的臨床研究中(clinicaltrials.gov,編號:NCT00076557),1 位高劑量組(2 × 1012μg/kg)患者接受治療后 2 周內 FIX 水平即上升至 11.8%,出血癥狀得到了有效的改善,甚至在手部撞擊柜子時都未出血(以往這種情況需要注射 FIX 控制出血)[10]。但是隨著患者體內轉氨酶水平的迅速升高,同時FIX 水平也急速下降。轉氨酶水平在第 5 周達到最高值,以后緩慢下降,到第 12 周時恢復正常水平,與此同時患者體內 FIX 水平直降至基線水平[10,16]。這種 FIX 水平驟然下降、治療效果不能維持的現象在模型動物上并未出現過。這一現象引起了大家的廣泛關注并拉開了基因治療中抗AAV 病毒衣殼免疫研究序幕。后續的相關研究表明,T 細胞介導的對 AAV 衣殼蛋白的免疫反應是導致 AAV 及AAV 感染的肝細胞被機體清除的機制,最終導致患者 FIX活性水平顯著下降。其具體機制的一種可能的解釋是患者在接受基因治療之前可能已經感染過相應野生型 AAV 病毒,從而體內已有抗 AAV 的記憶 T 細胞,當再次接觸 AAV時會產生大量病毒特異的 CD8+T 細胞,降低感染效率;此外,患者肝細胞被 AAV 感染后,可將病毒的衣殼蛋白遞呈于細胞表面,T 細胞識別后最終導致 AAV 感染的肝細胞被特異性清除,導致治療效果不能維持[17]。據報道,全球約有 50% 的人群攜帶有 AAV 的天然抗體,這就極大地制約了 AAV 基因治療的應用[18]。此外,目前所有患者在接受 AAV 基因治療后都會產生對病毒衣殼特異的免疫反應,并產生高滴度的抗 AAV 抗體,限制了同類型 AAV 基因治療的重復進行[19]。
續表 1
上述通過 AAV 作為載體向靶細胞中導入正常人 FIX基因進行基因治療的方法,其導入的目的基因并未或者很少整合進入靶細胞的基因組。因此有的研究方案就試圖通過鋅指酶介導的基因組編輯的方式直接向患者自身肝細胞導入FIX 基因(clinicaltrials.gov,編號 NCT02695160,由Sangamo Therapeutics 公司發起,正在招募患者)。該項研究計劃是將目的基因定點整合于白蛋白基因位點(肝臟高表達的內源基因,且普遍被認為是安全位點),從而實現外源基因的安全、高效表達。雖然還不是直接替換異常的 FIX基因,但也是首次試圖在人體中進行定點 FIX 整合。相關的臨床前研究中,研究人員在小鼠 ROSA26 位點導入人FIX 的一個無義突變基因(Y155stop F9 minigene),構建了一個人 FIX 突變小鼠模型,并用該模型檢測了鋅指酶在該小鼠體內的基因糾正情況。小鼠模型的相關結果顯示鋅指酶在宿主 DNA 上實現了雙鏈剪切,通過同源重組修復了異常基因,并在小鼠模型實現人 FIX 的表達,其平均活性水平為 23%[20]。但這種通過基因編輯導入目的基因的方法可能存在脫靶效應,從而造成非特異性剪切,具有一定的安全風險。脫靶效應不僅與使用的內切酶類別相關,也與內切酶的表達時間和表達水平相關。脫靶效應是基因編輯療法面臨的最主要安全問題。
3 影響血友病 B 基因治療效果的因素
3.1 載體的影響
1998年研究人員曾采用質粒作為載體對血友病 B 進行過研究,但由于轉染效率低下且難于實現目的基因的持續表達,無法真正應用于臨床。目前基因治療多用轉導效率更高的病毒作為載體,主要分為兩類:整合型病毒,如慢病毒、逆轉錄病毒,該類病毒感染細胞后可將目的基因整合入宿主細胞的基因組;非整合型病毒,如 AAV,這類病毒感染細胞后并不將目的基因整合入宿主細胞基因組,插入突變的風險較低,但需要感染壽命長的靜止期細胞來實現目的基因的長期表達,如肝細胞、神經細胞或肌肉細胞。表 2 列出了基因治療常用病毒載體的情況。

表2 基因治療常用病毒載體及特點
出于安全性考慮,目前血友病 B 基因治療主要采用AAV 作為載體,經外周靜脈注射靶向肝臟表達人 FIX。但如前所述,人群中存在一定比例的人攜帶 AAV 天然抗體,一項對健康歐洲人群的研究結果顯示,有 59% 的人含有AAV2 天然中和抗體,19% 的人含有 AAV8 天然中和抗體,5% 的人含有 AAV5 天然中和抗體[21]。AAV 天然中和抗體及對 AAV 衣殼蛋白特異的細胞免疫,是 AAV 作為載體治療血友病 B所面臨的主要問題,限制了其在肝炎患者及攜帶天然抗體的患者中的應用。另外接受過 AAV 治療的患者可能會對相應亞型的載體產生抗體,無法重復進行同種載體的基因治療。
相對于 AAV,慢病毒可攜帶更長的目的基因,更適用于血友病 A 的基因治療(FVIII 的 cDNA 長度更長);此外,近年來對慢病毒載體的改進使得它的安全性有了很大提升;已知對慢病毒有天然抗體的人也較少,這些因素使得慢病毒在臨床研究中也具有一定的優勢[21]。
早期基因治療使用的病毒載體中包含大量的空載病毒(> 80%),這可能是引起免疫反應的主要因素;但是也有研究認為空載病毒能起到“陷阱”作用,攔截患者體內原本存在的抗 AAV 中和抗體,或者作為衣殼特異細胞毒 T 細胞的靶點,提高目的基因的感染效率,但是這種理論還有待證實[21-24]。現可通過增加純化步驟來降低產品中空載病毒的比例,讓最終產品中空載病毒的含量不超過 10%。目前,FIX-Padua 的兩項臨床研究都采用這種空載病毒含量低的產品進行研究,最終空載病毒是否效果更好還需進一步的評判[21]。
3.2 宿主細胞的影響
宿主細胞的選擇對于基因治療的成功起著關鍵作用。血友病 B 的臨床研究最初選擇的宿主細胞是骨骼肌細胞,因當時病毒載體還需要通過肝動脈注射感染肝臟細胞,有一定的安全風險;且可通過切除相應骨骼肌組織隨時終止研究以保證患者的安全。問題是骨骼肌細胞雖然可以表達 FIX,但表達量卻不足以實現表型糾正[9]。目前,血友病 B 基因治療研究的宿主細胞均為 FIX 的原始表達細胞——肝細胞,它可高效表達并完整地對 FIX 進行翻譯后修飾。
但是對一些不能以肝臟作為靶器官的患者(如肝病患者等),發展他種靶細胞進行基因治療仍有一定的意義。除了直接輸注病毒感染體內細胞的基因治療外,還可以通過體外感染靶細胞,再經體外擴增、移植靶細胞的方式進行基因治療,這種方式稱為離體基因治療,也常被稱為細胞治療。早在 1996年,我國科學家就曾嘗試用患者自身成纖維細胞作為靶細胞,以逆轉錄病毒作為載體進行過相關研究,結果表明成纖維細胞治療的安全性較好,未有嚴重的安全問題,FIX 的活性水平最高達 4%,但表達為瞬時的,不能維持較長的時間[25]。細胞治療通常選擇具有增殖能力的細胞作為靶細胞,如造血干細胞、成纖維細胞、間充質干細胞等。其中,間充質細胞因易于分離、培養和擴增,且免疫原性低、能定植于多種臟器、組織,實現外源基因的長久表達而成為細胞治療的常用細胞。我們曾在血友病 A 小鼠模型上進行過間充質干細胞的治療研究,結果表明間充質干細胞可表達具有生物活性的人 FVIII,并能夠改善血友病模型動物表型,但仍存在不能長期穩定表達的問題[26]。因在體外進行病毒感染,可避免機體與病毒載體的直接接觸從而有更高的安全性,但如何實現在靶細胞中 FIX 的高水平表達和長期表達還是需要解決的問題[27]。
3.3 目的基因的影響
FIX 存在一系列功能增強型突變型,如前述的FIX-Padua,單個堿基的突變可使 FIX 活性增加 5~10 倍。臨床研究中很難通過加大病毒載體劑量的方式來提高體內FIX 活性水平,而使用這種高活性 FIX 突變型可降低病毒載體劑量,增加安全性,或在同等劑量條件下增加體內 FIX水平,實現表型的“治愈”。不過表達非天然存在蛋白有引起免疫毒性的風險,這是人們最為關注的問題。但現有的臨床研究中并未發現相關安全風險,也未見 FIX 抑制物生成。這與在小鼠模型、犬模型中的臨床前研究結果一致。臨床前動物試驗還表明,基因治療有誘導免疫耐受的潛在作用,具體機制還不明確,推測可能是通過調節 T 細胞功能實現,而臨床結果似乎與臨床前研究結果相符合[21,28-29]。
4 小結與展望
血友病 B 基因治療研究迄今已經歷了 20 余年,是遺傳病基因治療研究的一個典范。當前血友病 B的基因治療主要通過 AAV 病毒向靶細胞導入正常 FIX 基因表達活性 FIX 蛋白的方式進行。可喜的是,近期的臨床研究顯示,基因治療已實現了對血友病 B 患者的表型糾正,有效地控制了出血癥狀。但是,AAV 載體帶來的相關風險仍然存在,限制了對攜帶有天然 AAV 中和抗體的患者及肝炎患者的應用,且無法對患者進行 AAV 重復治療來增強治療效果,這是血友病 B 的 AAV 病毒載體基因治療目前所面臨的一個主要問題。
最為理想的基因治療方式應該是在 DNA 水平實現對異常基因的“修復”。隨著基因組編輯技術的發展,如鋅指酶,轉錄激活因子樣效應核酸酶(TALEN),特別是規律成簇間隔短回文重復序列/規律成簇間隔短回文重復序列-相關蛋白 9(CRISPR/Cas9)系統的發展,基因組編輯效率得到了很大提升,基于基因組編輯的血友病 B 基因治療,將會是血友病 B 基因治療領域的重點研究方向。基因組編輯的安全性風險主要是非特異剪切和核酸酶的免疫原性;提高基因組編輯的效率,在靶細胞中產生足夠量的 FIX 蛋白是面臨的主要技術問題。
基因治療是最有可能治愈血友病的療法,盡管目前還面臨著安全、倫理、普及性和費用等諸多方面帶來的困難和挑戰,但隨著科學技術的進步,更高效、安全策略的出現,通過基因治療并最終治愈血友病 B 的愿望不久將能實現。
[1]The hematology branch of thrombosis and hemostasis group of Chinese medical association, China hemophilia collaboration group.Diagnosis and treatment of hemophilia China expert consensus (2013 edition).Chin J Hematol, 2013, 34(5):461-463.(in Chinese)
中華醫學會血液學分會血栓與止血學組, 中國血友病協作組.血友病診斷與治療中國專家共識(2013年版).中華血液學雜志, 2013,34(5):461-463.
[2]Gitschier J, Wood WI, Goralka TM, et al.Characterization of the human factor VIII gene.Nature, 1984, 312(5992):326-330.
[3]Choo KH, Gould KG, Rees DJ, et al.Molecular cloning of the gene for human anti-haemophilic factor IX.Nature, 1982, 299(5879):178-180.
[4]Horava SD, Peppas NA.Recent advances in hemophilia B therapy.Drug Deliv Transl Res, 2017, 7(3):359-371.
[5]Presnell SR, Stafford DW.The vitamin K-dependent carboxylase.Thromb Haemost, 2002, 87(6):937-946.
[6]Yan JB, Wang S, Huang WY, et al.Transgenic mice can express mutant human coagulation factor IX with higher level of clotting activity.Biochem Genet, 2006, 44(7-8):347-360.
[7]Simioni P, Tormene D, Tognin G, et al.X-linked thrombophilia with a mutant factor IX (factor IX Padua).N Engl J Med, 2009, 361(17):1671-1675.
[8]Arruda VR, Hagstrom JN, Deitch J, et al.Posttranslational modifications of recombinant myotube-synthesized human factor IX.Blood, 2001, 97(1):130-138.
[9]Kay MA, Manno CS, Ragni MV, et al.Evidence for gene transfer and expression of factor IX in haemophilia B patients treated with an AAV vector.Nat Genet, 2000, 24(3):257-261.
[10]Manno CS, Pierce GF, Arruda VR, et al.Successful transduction of liver in hemophilia by AAV-Factor IX and limitations imposed by the host immune response.Nat Med, 2006, 12(3):342-347.
[11]Buchlis G, Podsakoff GM, Radu A, et al.Factor IX expression in skeletal muscle of a severe hemophilia B patient 10 years after AAV-mediated gene transfer.Blood, 2012, 119(13):3038-3041.
[12]Herzog RW, Fields PA, Arruda VR, et al.Influence of vector dose on factor IX-specific T and B cell responses in muscle-directed gene therapy.Hum Gene Ther, 2002, 13(11):1281-1291.
[13]Nathwani AC, Tuddenham EG, Rangarajan S, et al.Adenovirus-associated virus vector-mediated gene transfer in hemophilia B.N Engl J Med, 2011, 365(25):2357-2365.
[14]Nathwani AC, Reiss UM, Tuddenham EG, et al.Long-term safety and efficacy of factor IX gene therapy in hemophilia B.N Engl J Med,2014, 371(21):1994-2004.
[15]Spark Therapeutics, Inc.Spark therapeutics presents updated preliminary data from hemophilia B phase 1/2 trial suggesting consistent and sustained levels of factor IX Activity at the hemostasis and thrombosis research society (HTRS) 2017 scientific symposium.(2017-04-29).http://ir.sparktx.com/phoenix.zhtml?c=253900&p=irolnewsArticle&ID=2260344.
[16]High KA.Gene therapy for hemophilia: the clot thickens.Hum Gene Ther, 2014, 25(11):915-922.
[17]Mingozzi F, High KA.Therapeutic in vivo gene transfer for genetic disease using AAV: progress and challenges.Nat Rev Genet, 2011,12(5):341-355.
[18]Calcedo R, Vandenberghe LH, Gao G, et al.Worldwide epidemiology of neutralizing antibodies to adeno-associated viruses.J Infect Dis,2009, 199(3):381-390.
[19]George LA, Fogarty PF.Gene therapy for hemophilia: past, present and future.Semin Hematol, 2016, 53(1):46-54.
[20]Li H, Haurigot V, Doyon Y, et al.In vivo genome editing restores haemostasis in a mouse model of haemophilia.Nature, 2011,475(7355):217-221.
[21]Monahan PE.Gene therapy in an era of emerging treatment options for hemophilia B.J Thromb Haemost, 2015, 13 Suppl 1:S151-S160.
[22]Mingozzi F, High KA.Immune responses to AAV vectors:overcoming barriers to successful gene therapy.Blood, 2013, 122(1):23-36.
[23]Mingozzi F, Anguela XM, Pavani G, et al.Overcoming preexisting humoral immunity to AAV using capsid decoys.Sci Transl Med, 2013,5(194):194ra192.
[24]Gao K, Li M, Zhong L, et al.Empty virions in AAV8 vector preparations reduce transduction efficiency and may cause total viral particle dose-limiting side-effects.Mol Ther Methods Clin Dev, 2014,1(9):20139.
[25]Qiu X, Lu D, Zhou J, et al.Implantation of autologous skin fibroblast genetically modified to secrete clotting factor IX partially corrects the hemorrhagic tendencies in two hemophilia B patients.Chin Med J (Engl), 1996, 109(11):832-839.
[26]Wang Q, Gong X, Gong Z, et al.The mesenchymal stem cells derived from transgenic mice carrying human coagulation factor VIII can correct phenotype in hemophilia A mice.J Genet Genomics, 2013,40(12):617-628.
[27]Fomin ME, Togarrati PP, Muench MO.Progress and challenges in the development of a cell-based therapy for hemophilia A.J Thromb Haemost, 2014, 12(12):1954-1965.
[28]Crudele JM, Finn JD, Siner JI, et al.AAV liver expression of FIX-Padua prevents and eradicates FIX inhibitor without increasing thrombogenicity in hemophilia B dogs and mice.Blood, 2015,125(10):1553-1561.
[29]Annoni A, Cantore A, Della VP, et al.Liver gene therapy by lentiviral vectors reverses anti-factor IX pre-existing immunity in haemophilic mice.EMBO Mol Med, 2013, 5(11):1684-1697.
第一屆中國生物診斷高峰論壇圓滿結束
為適應政府職能轉變的社會需求,積極發揮行業組織的前臺服務功能,更好地促進我國體外診斷(IVD)技術進步與產業規范化健康發展。在中國食品藥品檢定研究院的直接參與和鼎力支持下,由中國醫藥生物技術協會生物診斷技術分會主辦、鄭州安圖生物工程有限公司承辦的“第一屆中國生物診斷高峰論壇”于 2017年 7月 20 – 22日在中原大地古都鄭州召開。
本次大會榮幸地邀請到在生物診斷領域具有卓越成就的莊輝院士、程京院士、國家相關管理部門和中國食品藥品檢定研究院的領導以及相關知名專家就當今生物診斷技術的最新研究進展與應用、我國生物診斷技術與產品的管理標準與新政解讀發表主旨演講。來自全國各地生物診斷領域“產、學、研、用、管”各方面的專家和代表共計 500 多人參加了交流和討論。
大會開幕式由中國醫藥生物技術協會生物診斷技術分會主任委員李銀太主持,他首先代表大會組委會對所有在百忙中出席這次高峰論壇的嘉賓和同行們表示熱烈的歡迎和誠摯的謝意!對為本次大會成功召開付出辛勞的單位、個人,以及為大會提供支持的相關企業一并表示衷心的感謝!
隨后,中國食品藥品檢定研究院王佑春副院長代表大會組委會致歡迎詞;河南省食品藥品監督管理局尹建副局長和中國醫藥生物技術協會李少麗副理事長分別發表了熱情洋溢的講話。
為了能給出席會議的代表提供更多學習和掌握信息的機會,本次論壇采用主會場特邀報告與分會場專題研討相結合的方式開展交流。
在 7月 21日上午主論壇上,中國工程院莊輝院士、程京院士,軍事醫學科學院王升啟研究員,重慶醫科大學黃愛龍教授,中國食品藥品檢定研究院王佑春研究員,中國計量科學研究院醫學與生物計量研究所王晶研究員,分別發表了“乙肝診斷與療效監測新進展”、“感染性疾病的精準診斷”、“表面增強拉曼檢測技術及其應用”、“精準診斷與精準治療——乙肝血清學標志物再認識”、“二代測序診斷試劑的技術要求及質量評價”與“國家生物計量和質量控制標準”的主旨演講。
7月 21日下午,大會分別開設了“血液篩查與輸血安全”、“生物診斷新技術新方法與檢測原材料標準化”、“分子診斷”、“臨床檢驗技術發展與轉化”4 個專題分論壇進行研討。先后有 30 多位知名專家分別針對相關熱點作了精彩的報告。
7月 22日上午,大會特邀國家食品藥品監督管理總局醫療器械注冊管理司一處胡雪燕副調研員、藥品化妝品注冊管理司生物制品處白鶴副調研員、國家藥典委員會生物制品標準處郭中平處長、中國食品藥品檢定研究院體外診斷試劑檢定所白東亭所長、醫療器械標準管理研究所母瑞紅副所長分別就“診斷試劑法規解讀”、“我國血源篩查試劑管理法規解讀與發展趨勢”、“《中國藥典》體外診斷試劑質量標準建立相關原則”、“國家體外診斷試劑標準物質研制進展”、“新形勢下醫療器械標準管理新進展”等發表了主旨演講。
此外,生物芯片上海國家工程中心主任郜恒駿教授、第四軍醫大學附屬西京醫院檢驗科主任郝曉柯教授還應邀分別發表了“從樣品到產品的轉化研究與精準醫療”、“外泌體在腫瘤診斷與治療中的應用”的精彩報告。
在中國醫藥生物技術協會的領導下,在與會專家和代表的共同努力下,第一屆中國生物診斷高峰論壇受到與會人員的高度評價和認可,取得了圓滿成功。大會組委會感謝所有給予關心和支持的廣大同行,期待著下次會議再相聚。
10.3969/j.issn.1673-713X.2017.04.007
中國工程院咨詢研究項目(2016XY36);國家自然科學基金(81500108)
200040 上海交通大學附屬兒童醫院/上海市兒童醫院/上海交通大學醫學遺傳研究所/衛生部醫學胚胎與分子生物學重點實驗室/上海市胚胎與生殖工程重點實驗室
曾溢滔,Email:ytzeng@stn.sh.cn
2017-05-15

