微流控芯片中顆粒/細胞磁操控的研究進展
黃爽+何永清+焦鳳
摘 要 微流控芯片中顆粒/細胞的磁操控是當前的熱點研究領域。本文詳細介紹了微流控芯片中顆粒/細胞磁操控原理及幾種主要操控方式,包括分離、集中、捕獲與排列組裝。其中,基于顆粒/細胞大小、形狀以及有無磁性對分離方法展開詳述。此外,本文還比較了通道幾何結構、磁場強度及分布、磁性液體種類(順磁鹽溶液和磁流體)對操控性能的影響。最后,針對微流控芯片中顆粒/細胞磁操控的前景進行了展望。
關鍵詞 微流控芯片; 磁場; 顆粒/細胞; 磁性液體; 操控; 評述
1 引 言
由于人類對癌癥發病機理及癌細胞轉移機制至今仍不十分了解,癌癥患者仍然有近90%的死亡率[1]。了解癌癥的轉移機制,并尋求相應的方法制止其轉移或將其移除,可以給患者帶來有效的治療。目前,眾多的技術與方法已用于分離和分析血液中稀有的循環腫瘤細胞(CTCs),通過對CTCs的無創篩選及生物標記物的探測,可以檢測腫瘤的動態[2]。磁性作為物質的固有屬性,其差異在磁場下會產生力的效應,可對微尺度的顆粒/細胞進行操控,如磁性分選能將特定的靶細胞從異構的混合物中分離出來[3]。
近年來,微流控技術在化學和生物醫學方面的潛在應用備受關注,例如細胞分離[4]、癌癥診斷[5]、治療藥物的輸送和篩選[6~8]、樣品制備[9]、水質量控制和環境監測[10,11]等方面。相比傳統技術,微流控的小型化使其具有樣品消耗少、花費低、反應時間短、對環境污染少等優點[12,13]。
微流控芯片中顆粒/細胞的操控方式主要包括分離、捕獲、集中等,傳統的方法有淘選[14]、流體動力學操控[15]等,但準備過程繁雜、成本較高,且容易損失標記的細胞。使用外部力場的操控技術近年已發展起來,如光學方法[16],雖能捕獲單個顆粒/細胞,但對光學環境要求較高,且會產生焦耳熱;介電泳技術[17]在實現對細胞高產量操控的同時,其離子濃度和表面電位可能損壞細胞;聲學技術也因其較低的分辨率,有一定局限性[18]。相比而言,磁操控具有磁場靈活可控、基本不產熱(永磁鐵)、無需昂貴的外部系統作為輔助等優勢[19]。
在非均勻磁場中,可采用磁性液體(磁流體、順磁鹽溶液)誘導非磁性物質的有效磁偶極矩,產生負磁泳效應。磁流體是含有直徑約10 nm單磁疇磁性顆粒的穩定膠體懸浮液[20],顆粒材料通常為Fe3O4,通過包覆一層表面活性劑而穩定地離散在水或油中。在連續流動條件下,顆粒/細胞磁操控的效率較高,文獻[21~24]提出了多種理論方法和分析模型,并指出影響操控效率的主要參數有流體流速、通道幾何尺寸、磁鐵參數等,以此為依據,可對微系統進行優化設計,提高效率。
本文綜述了微流控芯片中顆粒/細胞磁操控的基本原理和主要應用。首先闡述了微流控芯片中操控顆粒/細胞的理論機理及影響因素;然后介紹了目前顆粒/細胞的主要操控方式,包括分離、聚集、捕獲、排列組裝等, 比較了它們的特性和操控方式;最后對微流控芯片中磁操控的發展前景進行了展望。
2 顆粒/細胞的磁操控機理
微尺度上顆粒/細胞的運動受多種力的作用,此處主要描述影響顆粒/細胞運動軌跡的關鍵力的計算,確定占主導的力,同時對影響顆粒/細胞磁操控的相關參數與條件進行了討論。
2.1 磁力
在磁流體或順磁鹽溶液中,顆粒/細胞在磁場作用下受到的磁力(Fm)取決于顆粒/細胞的體積(V)、顆粒/細胞的磁化率(χp)與媒介的磁化率(χm)之差Δχ、外加磁場強度(B)及梯度大小[25]。
其中,Δχ=χp-χm,當反磁性顆粒/細胞(χp<0)在順磁性溶液(χm>0)中時,Δχ<0,顆粒/細胞因磁場排斥力作用被推向磁場小的位置;當順磁性顆粒/細胞(χp>0)在反磁性溶液(χm<0)中時,Δχ>0,顆粒/細胞由于磁場的吸引而向磁場源方向運動。
2.2 黏滯阻力
在微流情況下,雷諾數通常遠小于1,屬于層流流動,此時球形質點在液體中受到的阻力通常可以表示為[26]:
2.3 重力和浮力
球形顆粒/細胞受到的重力和浮力的合力可用式(3)表示[27]:
2.4 其它力的作用
在順磁鹽溶液或磁流體中,由于顆粒/細胞的體積濃度c<<1,此時,顆粒/細胞-顆粒/細胞和顆粒/細胞-流體之間的相互作用力可以忽略[28]。在顆粒/細胞直徑DP足夠小的情況下,布朗運動會對顆粒/細胞的運動產生影響。Gerber等[29]采用式(4)評估顆粒的臨界直徑:
其中,|F|為顆粒/細胞受到的合力大小,K是玻爾茲曼常數,T是絕對溫度。
在微通道中,雷諾數通常很小,屬于層流流動,黏性影響超過慣性影響,且顆粒/細胞一般都大于臨界直徑,因此只需考慮占主導的磁力和黏滯阻力作用。
3 顆粒/細胞的分離方法
3.1 基于尺寸的分離方法
在化學和生物領域應用中,顆粒/細胞的分離至關重要。兩種不同大小顆粒/細胞的磁分離,通常無需磁性顆粒標記,可依據其尺寸操作,且較快速方便。大小不同的顆粒/細胞,只要具有相同的磁性,就可通過尺寸差異實現分離。式(1)表明,在磁場作用下,顆粒/細胞受到的磁力與其體積成正比,非均勻磁場產生的磁力會使其運動路徑發生偏移,從而對不同尺寸的顆粒/細胞實現分離(圖1)。
Zeng等[30]使用一對永磁鐵連續分離3和10 μm的反磁性顆粒,如圖1A所示。第一塊永磁鐵靠近微通道,先將顆粒混合物集中成一個粒子流,第二塊磁鐵錯開第一塊磁鐵,且遠離通道放置,實現將顆粒偏移到不同路徑進行連續分選,同時該過程也驗證了流速和磁鐵距離對分離效果的影響。運用類似的方法,Xuan等[31]采用U形通道,通過改變不同流速研究了磁場對聚苯乙烯顆粒分離的影響,如圖1B所示。當流速為0.7 mm/s時,能將顆粒完全分離開來,在此基礎上流速偏大或偏小都不能達到預期效果。
除了單入口微流通道,可另增加一個入口作為鞘流,通過加強粒子的聚集度實現有效分離。Zhu等[32]在微通道中通過單個永磁鐵分離3組不同大小的聚苯乙烯顆粒(1.0和9.9 μm,1.9和9.9 μm, 3.1和9.9 μm),如圖1C所示,只有對1.0和9.9 μm顆粒的分離效率為100%。結果表明,對于不同尺寸的多分散顆粒,尺寸相差較大的顆粒會有更好的分離效果。此后,Zhu等[33]運用同樣的分離裝置,通過增加磁鐵數量分離大腸桿菌和酵母菌細胞,如圖1D所示,實驗中所用的磁流體對細胞無害,且能長時間保持細胞活性;他們還結合三維分析模型獲得與實驗結果完全吻合的細胞運動軌跡。
為了使顆粒/細胞能夠可視化,Shen等[34]通過改變具有生物相容性的順磁鹽溶液濃度,將U937(人體淋巴瘤單核細胞)從RBCs(紅細胞)中分離出來;驗證了分離效率與濃度的關系,當順磁鹽濃度為40 mmol/L Gd-DTPA時,U937細胞的分離效率可達到90%以上。在層流情況下,以上微流分離雖然簡便,但純粹基于尺寸的分離可能不足以用于某些特定的用途,如由于尺寸的相似性,難以將死細胞從活細胞中分離出來,這些細胞的進一步分離還需尋求其它操控方法[35]。基于尺寸的不同分離方法的比較見表1。
3.2 順磁性顆粒/細胞的分離方法
3.2.1 標記有磁珠的顆粒/細胞的分離方法 磁珠是嵌入式的磁實體(Fe3O4),可利用永磁鐵和電磁鐵使得顆粒/細胞有效的聚集并進行分離,且不受媒介流動或生物過程影響。此外,對用于標記的磁性納米顆粒進行改性,可實現對細胞的特定操控,其方法為涂覆與生物相容的物質,如葡聚糖、聚乙烯醇(PVA)和磷脂[36,37]。然而,使用這種功能化的磁珠標記靶向細胞需要很長的培養時間,分離后又難以將磁珠從靶向顆粒/細胞上移除。
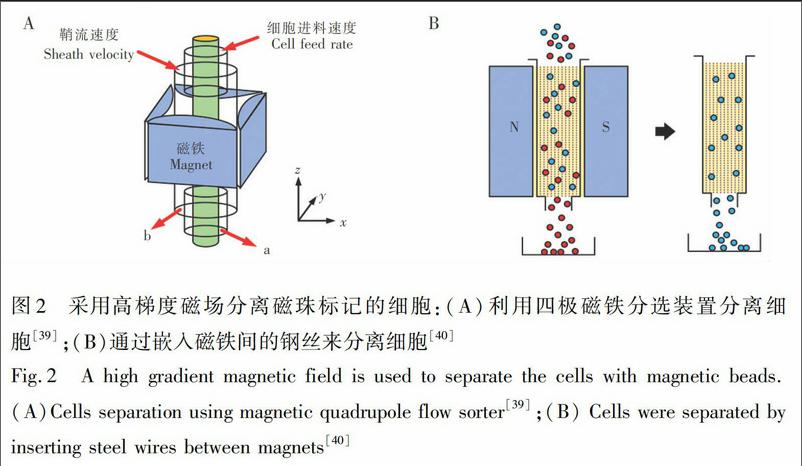
磁珠標記分離方法一般是將表面改性的磁性納米顆粒通過特異性作用黏附在細胞表面,利用外部磁場吸引,使得細胞運動路徑發生改變實現分離,分離效率取決于流速和磁場強度[38]。為了提高分離效率,通過結合磁力和黏性力的影響建立數學模型,Zborowski等[39]設計了四極磁鐵分選裝置產生高梯度磁場,如圖2A所示,該結構對外部磁場能量能達到充分利用。在四極磁場作用下磁性標記的細胞受到的磁力具有“離心”特點,可實現細胞的連續分離。另一種較快速簡單的方法是利用永磁鐵磁化內部鋼絲實現細胞分離, Miltenyi 等[40]用該方法實現了有磁珠細胞和無磁珠細胞的高產量分離(圖2B)。
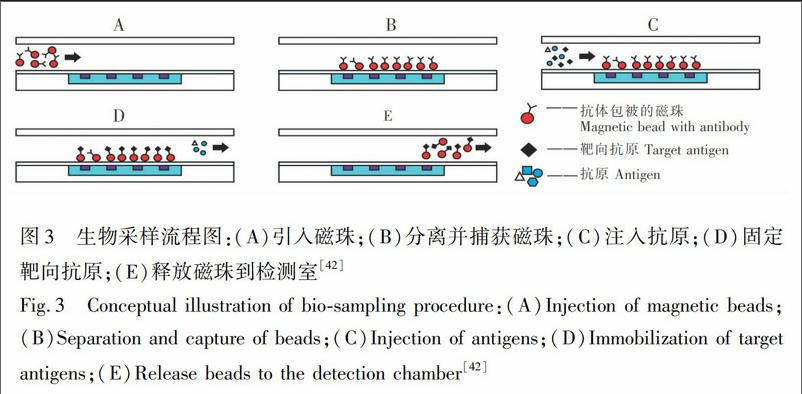
針對磁場結構,新的分離技術也已發展起來,如將磁性材料集成于微芯片上,通過外部磁場磁化或其它方式產生磁場,成本低,且可構建可調或復合磁場。Derec等[41]設計了局部可調磁場,其新穎之處為在銅板上同時蝕刻微流通道和微電路,當磁性顆粒標記的腫瘤細胞和非磁性的熒光細胞注入微通道時,在磁場區域兩種細胞運動軌跡發生偏移,從而實現分離。圖3展示了生物采樣流程[42],通過在微通道內壁嵌入平面電磁鐵提高分離效率。具體實施過程如下:(1)抗體包被的磁珠被引入磁場區,并在通道表面將其捕獲;(2)將抗原注入通道中,靶向抗原吸附在磁珠上被分離出來;(3)釋放磁珠到檢測室。這種分離方法可用于生物取樣和檢測系統中,在實現無過濾生物分離中具有較大潛力。
在此基礎上,芯片中加設微混合器可加強磁性顆粒與細胞的有效結合以及細胞的均勻混合。例如,文獻[43]通過增設微混合器增強血液中磁性顆粒包覆白細胞的效果, [42]使白細胞在后續的微通道中由磁場分離出來,并進行CTCs分析。
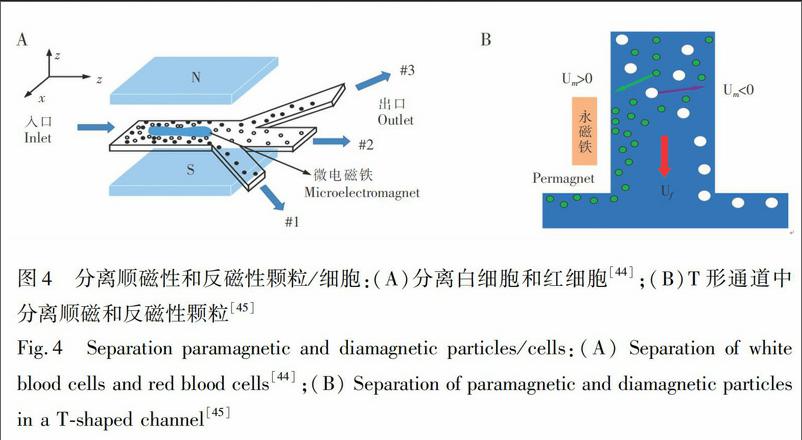
3.2.2 順磁性和反磁性顆粒/細胞(無標記)的分離 由于血紅蛋白的氧化作用,使得血液中紅細胞表現出順磁性。利用此特點,Han等[44]聯合微電磁鐵和永磁鐵分離白細胞和紅細胞,他們設計的微裝置由1個入口和3個出口組成,如圖4A所示,當施加外部磁場時,順磁性的紅細胞被推動,遠離微電磁鐵,從出口1和3流出,而白細胞從出口2分離出來。如圖4B所示,Liang等[45]利用T形通道,在EMG408磁流體中將順磁性和反磁性顆粒同時從兩個出口分離出來。
3.3 基于形狀的分離方法
形狀可以作為細胞狀態是否良好的標志,為疾病診斷提供有用信息,如紅細胞的形狀改變預示著病變的發生。在化學、生物醫學和環境應用中,顆粒/細胞的形狀是一個重要的指示因素[46]。與尺寸分離類似,形狀分離通常局限于以其本身性質為基礎的簡單分離。
關于形狀分離方法已有諸多文獻報道,如柱陣列[47]和動力學過濾[48]等。與此不同,形狀相異的顆粒/細胞也可在磁泳作用下實現分離。Zhou等[49]使用T形通道分離相同大小的球形和花生狀反磁性顆粒,當流速為120 μL/h時能夠實現完全分離,此時球形顆粒到達通道側壁,而花生狀顆粒運動至通道寬度約1/4處,在兩者之間形成清晰的間隙。Kose等[50]通過銅電極產生可調磁場,在生物相容的磁流體中將健康的紅細胞從鐮狀細胞中分離出來,且在1 min內分離效率可達到99%。結果表明,利用這種生物兼容的磁流體實現快速分離,有助于減少孵育時間,提高細胞測定的診斷靈敏度。
4 顆粒/細胞的聚集
施加磁場,可將連續流動中的顆粒/細胞聚集成一個細流,該操作在微流應用中較為關鍵,有利于通道下游進一步操控和精確分析。目前。反磁性顆粒/細胞在磁流體或順磁鹽溶液中的聚集的研究較少,其重要的應用是細胞計數技術[51]和熒光激活細胞分選(FACS)[13],可用于細胞檢測、計數和分離等。
近年來,顆粒/細胞的聚集研究主要通過改變磁鐵位置,觀察通道中粒子流的情況。由于磁場分布不同,顆粒/細胞聚集情況會有差異。圖5總結了2D情況下顆粒/細胞聚集的幾種方法。Zeng[52]和Wilbanks[53]等通過改變磁鐵位置研究對稱性對顆粒/細胞聚集情況的影響。如圖5A和5B所示,磁鐵對稱放置時,微通道中會形成對稱的相對旋轉的循環集中流,反之顆粒呈不對稱形式流動,且顆粒/細胞聚集情況隨著流速降低或尺寸增加而改善。利用相同的模型,Zhu等[54]將磁鐵對稱放在通道兩側,研究了4.8,5.8和7.3 μm的聚苯乙烯顆粒在不同流速下的集中情況(圖5C)。由實驗結果得知,粒子流的寬度與顆粒大小成正比、與流速成反比。Rodríguez等[55]在連續流動的順磁鹽溶液中使用磁極相對的兩個永磁鐵,將顆粒在毛細管中心線集中成一個細粒子流(圖5D)。
實際上,微通道中的顆粒在水平和垂直方向都存在偏移,從而形成粒子流,通過3D分析模型[56,57]表明,降低流速、提高體磁流體濃度和增加顆粒大小均有助于顆粒/細胞在通道中的偏移,且模型分析與其后的實驗結果完全吻合。
5 顆粒/細胞的捕獲
為了實現單個細胞的基礎參數分析,需要將細胞捕獲在固定位置培養和檢測。對于微尺度動力學捕獲,主要利用微陣列結構通過動力學流動實現,其實驗裝置基本滿足兩個條件:(1)從混合溶液中分離細胞,(2)在每個單獨腔室中均勻分布細胞,以便進行下一步分析和檢測[58~61]。雖然能實現微尺度條件下精確捕獲細胞,但效率較低,且不易保持細胞活性。相比而言,磁力捕獲靈活可控,且對細胞基本無損傷。
5.1 電磁鐵捕獲顆粒/細胞
電磁鐵可通過電流對磁場大小進行精確調控,但與永磁鐵相比,電磁鐵產生的磁場和磁場梯度較小; 此外,在設計微流通道時,還需考慮其產生的焦耳熱[62]。 由于這些因素的影響,近年來對電磁鐵的研究相對較少。為了確保磁流體的生物兼容性,Kose等[63]使用通過共沉淀法合成由鐵鈷納米顆粒組成的水基鐵磁流體,微流系統由銅激發電極和微通道構成,當電極開啟時,通道內的顆粒被推到通道頂部并發生旋轉平移運動。通過調控電極的頻率,可將顆粒捕獲在兩電極之間。值得注意的是,Lee等[64,65]設計了微電磁矩陣和微磁環捕獲器,磁性顆粒在其上方的運動和停止可通過調節微電磁鐵的電流精確控制,其中微電磁矩陣是由中間設有隔離界面的兩層金線制成。
在微電磁鐵的基礎上,Yassine等[66]結合軟鐵磁結構實現了磁珠標記的細胞捕獲和分離。其主要分兩步進行:首先在主通道中通過軟鐵磁盤捕獲標記的細胞;再通過金線構造的錐形導電路徑將細胞運輸到側室中分離,細胞在側室中還可用于進一步培養。Huang等[67]設計了帶有疇壁(DW)釘扎幾何結構的正弦波磁結構,捕獲小鼠胚胎成纖維細胞,細胞通過內化磁性納米顆粒進行標記,使其具有磁性。
5.2 永磁鐵捕獲顆粒/細胞
Hoshino等[68]利用微芯片實現了對血液中CTCs的檢測,將磁極交錯的3塊磁鐵彼此靠近放置在微通道(微芯片固定在載玻片上)下方,產生足夠大的磁場梯度,其中CTCs由磁性納米顆粒與上皮細胞黏附分子(EpCAM)抗體的結合體進行標記。當血液和CTCs以109∶1進入通道時, CTCs被捕獲在通道底部的載玻片上,最終捕獲效率用血液中的CTCs和捕獲在載玻片上的CTCs比值評定。在此基礎上,Kang 等[69]對微通道做了進一步的優化設計,從而提高了捕獲效率,其微通道由兩部分組成:帶轉角入口的主通道和一個雙收集通道,兩個通道通過側部排列的腔室連接。當標記有磁珠的CTCs流經磁場區域時,在磁場作用下被捕獲在腔室內。這種通道結構不僅能保護其中的細胞不受剪切力影響,且可對細胞進行下一步分析和檢測。除了上述純磁場運用,Shields等[70]結合聲場捕獲單個CTC和前列腺癌細胞,主要分三步:(1)利用聲學駐波將細胞在微通道中心排列成線形結構;(2)通過磁場梯度分離磁標記和未標記的細胞;(3)微磁井陣列將標記的癌細胞捕獲,并進行下一步的分析。該微磁井陣列結構在精準捕獲單個細胞的同時,還能實現細胞之間配對[71]。
圖6展示了順磁性和反磁性顆粒的大量捕獲,Tarn[72]和Zhou[73]等在正、負磁泳的誘導作用下,分別將順磁性和反磁性顆粒捕獲在毛細管和T形通道的不同位置。這兩種裝置結構簡單,在短時間內能夠實現順磁性和反磁性物質的大量捕獲,但不利于單個顆粒/細胞的分析。
6 顆粒/細胞的排列組裝
有序的細胞結構對于生物工程研究尤為重要。在細胞培養、細胞傳感器(用于檢測細胞突變、代謝等)和藥物毒性研究領域,可控的細胞排序與組裝能讓操作變得更穩定,從而可大幅度提高效率[74]。
在非均勻磁場中,Krebs等[75]使用具有細胞兼容性的自由懸浮磁性納米顆粒,在磁泳作用下引導細胞形成定向的線性結構,如圖7A~7C所示。研究表明,線性細胞鏈的尺寸與其在磁場中的暴露時間和納米顆粒濃度有關。且該結構在磁場移除后依然是穩定的,可黏附到標準的組織培養表面,進行下一步培養或組織再生實驗。趨磁性細菌能夠在體內合成磁性納米顆粒,利用圓環形微電磁鐵可操控顆粒的位置,形成人為排序[76]。微電磁鐵通電后產生磁場,可將細菌內的磁性納米顆粒排布成鏈狀結構(圖7D)。
Li等[77]利用順磁性和反磁性顆粒將其組裝成更為復雜的環狀結構,該結構是在理論計算的基礎上結合實驗實現的。所用的媒介為磁流體,由于顆粒和磁流體之間磁化率的差異,通過調節這些物質之間的相互吸引和排斥作用,控制顆粒之間的距離可形成環狀結構。其中抗磁性顆粒大于磁性顆粒,由于尺寸差異,磁性顆粒將抗磁性顆粒圍在中心形成環狀。該結構的平衡由理論計算的最小勢能和顆粒的數目調節,且環狀結構中的顆粒數目與磁流體濃度成正比。
7 結論與展望
本文通過對顆粒/細胞的分離、集中、捕獲和排列組裝等磁操控方法及其應用的總結,詳細分析了顆粒大小、流體流速與磁物性等參數的影響,可為今后研究中通道設計的優化、操控效率的提高提供指導。目前,磁操控技術研究雖然已經取得了一定進展,但都還停留在模型驗證階段,要應用到工程實際中還面臨著諸多挑戰。
顆粒/細胞的磁操控研究,特別是微流控芯片的結構設計和外加磁場的精確調控尚存在一定的不確定性。很多研究基本集中于顆粒尺寸、流體因素對實驗結果的影響,利用磁場的精準操控實現單個顆粒/細胞的捕獲以及排列組裝將成為今后研究的重要方向。另外,很多學者都以顆粒(通常為聚苯乙烯微球)代替細胞來進行磁操控研究,這給實驗過程帶來了簡易性,卻忽略了細胞本身的自主性,而且實際研究中還需考慮細胞的體外培養、熒光染色以及順磁鹽溶液或磁流體的生物兼容性等問題,因此以細胞為對象的磁操控應用于臨床研究也將是今后的重點內容。
此外,基于微流控芯片的磁操控技術還需突破很多限制,如低的產量和效率、長時間或使用不當造成的通道堵塞等。已有的微流技術也只局限于對二元混合物的操控,芯片通道設計單一,還不能精確調節磁場大小與分布。總之,顆粒/細胞的磁操控技術已成為微流控芯片研究的重要領域,仍需要進一步發展。
References
1 Chaffer C L, Weinberg R A. Science, 2011, 331(6024): 1559-1564
2 Karabacak N M, Spuhler P S, Fachin F, Eugene J L. Nat. Protocol, 2014, 9(3): 694-710
3 Adams J D, Kim U, Soh H T. PNAS, 2008, 105(47): 18165-18170
4 Nagrath S, Sequist L V, Maheswaran S, Bell D W, Irimia D. Nature, 2007, 450(7173): 1235-1239
5 Hajba L, Guttman A. TrAC-Trend. Anal. Chem., 2014, 59: 9-16
6 Gijs M A M. Microfluid. Nanofluid., 2004, 1(1): 22-40
7 Chen H H, Gao D. Appl. Phys. Lett., 2008, 92(17): 173502
8 Dertinger S K W, Chiu D T, Jeon N L, Whitesides G M. Anal. Chem., 2001, 73(6): 1240-1246
9 Yuen P K, Kricka L J, Fortina P, Panaro N J, Sakazume T, Wilding P. Genome Res., 2001, 11(3): 405-412
10 Karimi A, Yazdi S, Ardekani A M. Biomicrofluidics, 2013, 7(2): 021501
11 Nilsson J, Evander M, Hammarstrm B, Laurell T. Anal. Chim. Acta, 2009, 649(2): 141-157
12 Gossett D R, Weaver W M, Mach A J, Hur S C, Tse H T K, Lee W, Amini H, Carlo D D. Anal. Bioanal. Chem., 2010, 397(8): 3249-3267
13 Lenshof A, Laurell T. Chem. Soc. Rev., 2010, 39(3): 1203-1217
14 Mage M G, Mchugh L L, Rothstein T L. J. Immunol. Methods, 1977, 15(1): 47-56
15 Hamblin M N, Xuan J, Maynes D, Tolley H D, Belnap D M, Woolley A T, Lee M L, Hawkins A R. Lab Chip, 2010, 10(2): 173-178
16 Kayani A A, Khoshmanesh K, Ward S A, Mitchell A, Kalantar-zadeh K. Biomicrofluidics, 2012, 6(3): 031501
17 Gupta V, Jafferji I, Garza M, Melnikova V O, Hasegawa D K, Pethig R, Davis D W. Biomicrofluidics, 2012, 6(2): 024133
18 Erb R M, Martin J J, Soheilian R, Pan C, Barber J R. Adv. Funct. Mater., 2016, 26(22): 3859-3880
19 Cao Q, Han X, Li L. Lab Chip, 2014, 14(15): 2762-2777
20 Rosensweig R E. Ferrohydrodynamics. New York: Cambridge University Press, 1985: 7-8
21 Zhu T, Lichlyter D J, Haidekker M A, Mao L. Microfluid. Nanofluid., 2011, 10(6): 1233-1245
22 Furlani E P. J. Appl. Phys., 2006, 99(2): 024912
23 Cao Q, Liu M, Wang Z, Han X,Li L. Microfluid. Nanofluid., 2017, 21(2): 24
24 Modak N, Datta A, Ganguly R. Microfluid. Nanofluid., 2009, 6(5): 647-660
25 Hejazian M, Li W, Nguyen N T. Lab Chip, 2015, 15(4): 959
26 Deen W M. Analysis of Transport Phenomena. New York: Oxford University Press, 1998: 299-308
27 Zhao W, Cheng R, Miller J R, Mao L. Adv. Funct. Mater., 2016, 26(22): 3916-3932
28 Gerber R. IEEE T. Magn., 1984, 20(5): 1159-1164
29 Gerber R, Takayasu M, Friedlaender F. IEEE T. Magn., 1983, 19(5): 2115-2117
30 Zeng J, Deng Y, Vedantam P, Tzeng T R, Xuan X. J. Magn. Magn. Mater., 2013, 346(1): 118-123
31 Liang L, Xuan X. Biomicrofluidics, 2012, 6(4): 044106
32 Zhu T, Marrero F, Mao L. Microfluid. Nanofluid., 2010, 9(4): 1003-1009
33 Zhu T, Cheng R, Lee S A, Rajaraman E, Eiteman M A, Querec T D, Unger E R, Mao L. Microfluid. Nanofluid., 2012, 13(4): 645-654
34 Shen F, Hwang H, Hahn Y K, Park J K. Anal. Chem., 2012, 84(7): 3075-3081
35 Tsutsui H, Ho C M. Mech. Res. Comm., 2009, 36(1): 92-103
36 Gijs M A M, Lacharme F, Lehmann U. Chem. Rev., 2010, 110(3): 1518-1563
37 Pankhurst Q A, Connolly J, Jones S K, Dobson J. J. Phys. D, 2003, 36(13): R167-R181
38 Shih P H, Shiu J Y, Lin P C, Lin C C, Veres T, Chen P. J. Appl. Phys., 2008, 103(7): 07A316
39 Zborowski M, Sun L, Moore L R, Williams P S, Chalmers J J. J. Magn. Magn. Mater., 1999, 194(1-3): 224-230
40 Miltenyi S, Müller W, Weichel W, Radbruch A. Cytometry, 1990, 11(2): 231-238
41 Derec C, Wilhelm C, Servais J, Bacri J C. Microfluid. Nanofluid., 2010, 8(1): 123-130
42 Choi J W, Chong H A, Bhansali S, Henderson H T. Sens. Actuators B, 2000, 68(1-3): 34-39
43 Lee T Y, Hyun K A, Kim S I, Jung H I. Sens. Actuators B, 2017, 238: 1144-1150
44 Han K H, Frazier A B. J. Appl. Phys., 2004, 96(10): 5797-5802
45 Liang L, Zhang C, Xuan X. Appl. Phys. Lett., 2013, 102(23): 234101
46 Lu X, Xuan X. Anal. Chem., 2015, 87(22): 11523-11530
47 Zeming K K, Ranjan S, Zhang Y. Nat. Comm., 2013, 4(3): 1625
48 Sugaya S, Yamada M, Seki M. Biomicrofluidics, 2011, 5(2): 024103
49 Zhou Y, Xuan X. Appl. Phys. Lett., 2016, 109(10): 102405
50 Kose A R, Fischer B, Mao L, Koser H. PNAS, 2009, 106(51): 21478
51 Gratta C D, Penna S D, Battista P, Donato L D, Vitullo P, Romani G L, Luzio S D. Phys. Med. Biol., 1995, 40(4): 671-681
52 Zeng J, Chen C, Vedantam P, Tzeng T R, Xuan X. Microfluid. Nanofluid., 2013, 15(1): 49-55
53 Wilbanks J J, Kiessling G, Zeng J, Zhang C, Tzeng T R, Xuan X. J. Appl. Phys., 2014, 115(4): 044907
54 Zhu T, Cheng R, Mao L. Microfluid. Nanofluid., 2011, 11(6): 695-701
55 Rodríguez-villarreal A I, Tarn M D, Madden L A, Lutz J B, Greenman J, Samitier J, Pamme N. Lab Chip, 2011, 11(7): 1240-1248
56 Liang L, Xuan X. Microfluid. Nanofluid., 2012, 13(4): 637-643
57 Liang L, Zhu J, Xuan X. Biomicrofluidics, 2011, 5(3): 034110
58 Gach P C, Attayek P J, Whittlesey R L, Yeh J J, Allbritton N L. Biosens. Bioelectron., 2014, 54(12): 476-483
59 Kim M C, Wang Z, Lam R H W, Thorsen T. J. Appl. Phys., 2008, 103(4): 044701
60 Cui S, Liu Y, Wang W, Sun Y, Fan Y. Biomicrofluidics, 2011, 5(3): 032003
61 Chen J, Chen D, Yuan T, Xie Y, Chen X. Biomicrofluidics, 2013, 7(3): 034106
62 Liu C, Stakenborg T, Peeters S, Lagae L. J. Appl. Phys., 2009, 105(10): 102014
63 Kose A R, Fischer B, Koser H. IEEE International Conference on Nano/micro Engineered and Molecular Systems, 2008: 903-906
64 Lee C S, Lee H, Westervelt R M. Appl. Phys. Lett., 2001, 79(20): 3308-3310
65 Lee H, Purdon A M, Westervelt R M. Appl. Phys. Lett., 2004, 85(6): 1063-1065
66 Yassine O, Gooneratne C P, Smara D A, Li F, Mohammed H, Merzaban J, Kosel J. Biomicrofluidics, 2014, 8(3): 034114
67 Huang C Y, Chen P J, Tsai K L, Chen J Y, Hsieh T F, Wei Z H. IEEE T. Magn., 2015, 51(11): 1001304
68 Hoshino K, Huang Y Y, Lane N, Huebschman M, Uhr J W, Frenkel E P, Zhang X. Lab Chip, 2011, 11(20): 3449-3457
69 Kang J H, Krause S, Tobin H, Mammoto A, Kanapathipillai M, Ingber D E. Lab Chip, 2012, 12(12): 2175-2181
70 Shields C W, Wang J L, Ohiri K A, Essoyan E D, Yellen B B, Armstrong A J, López G P. Lab Chip, 2016, 16(19): 3833-3844
71 Shields C W, Livingston C E, Yellen B B, López G P, Murdoch D M. Biomicrofluidics, 2014, 8(4): 041101
72 Tarn M, Peyman S A, Pamme N. RSC Adv., 2013, 3(20): 7209-7214
73 Zhou Y, Kumar D T, Lu X, Kale A, DuBose J, Song Y, Wang J, Li D, Xuan X. Biomicrofluidics, 2015, 9(4): 044102
74 Falconnet D, Csucs G, Grandin H M, Textor M. Biomaterials, 2006, 27(16): 3044-3063
75 Krebs M D, Erb R M, Yellen BB, Samanta B, Bajaj A, Rotello V M, Alsberg E. Nano Lett., 2009, 9(5): 1812-1817
76 Lee H, Purdon A M, Vincent C, Westervelt R M. Nano Lett., 2004, 4(5): 995-998
77 Li K H, Yellen B B. Appl. Phys. Lett., 2010, 97(8): 083105

