新型四肽親水材料用于糖肽的高效富集
陳成+王宏喜+康虹健+姚要+卿光焱+李秀玲+梁鑫淼


摘 要 本研究采用原子轉(zhuǎn)移自由聚合(Atom-transfer radical-polymerization, ATRP)法合成了一種新型四肽親水作用色譜材料 (Poly-DAPD),用于糖肽的選擇性富集。通過氮氣吸脫附、熱重分析和X射線光電子能譜等技術進行表征,結果表明,四肽已成功接枝到硅球上。固相萃取富集實驗表明,合成的親水材料對牛胎球蛋白(Fetuin)糖肽富集選擇性高; 與商品化ZIC-HILIC材料相比,Poly-DAPD材料富集摻有5摩爾倍數(shù)牛血清蛋白(BSA)的Fetuin樣品時,在獲得的糖肽數(shù)目及抗干擾性能方面都更具優(yōu)勢。此Poly-DAPD材料可進一步用于不同糖蛋白的糖基化分析研究。
關鍵詞 親水作用色譜; 四肽; 糖肽富集; 質(zhì)譜
1 引 言
蛋白質(zhì)糖基化是糖鏈通過共價鍵結合到蛋白上[1]。 糖蛋白參與許多重要的生命進程,如免疫應答、信息傳遞、細胞遷移等[2]。糖蛋白上糖鏈的改變會導致其所修飾的蛋白質(zhì)結構和功能發(fā)生變化,甚至會導致疾病[3]。蛋白質(zhì)的糖基化分析對其生物學功能及闡明相關疾病的致病機理具有重要意義。
蛋白質(zhì)的糖基化分析通常通過質(zhì)譜(Mass spectrometry, MS)分析實現(xiàn)[4]。雖然生物質(zhì)譜的進步推動了蛋白質(zhì)組學的發(fā)展,但由于復雜樣品中糖肽濃度低,以及質(zhì)譜分析中非糖肽對糖肽的離子抑制作用, 蛋白質(zhì)的糖基化分析仍具有挑戰(zhàn)性。因此,發(fā)展合適的糖肽富集方法具有重要意義。
近年來,科研工作者發(fā)展了一些糖肽富集方法,主要包括肼化學反應法[5]、硼酸化學反應法[6]、凝集素親和法[7]和親水作用色譜(Hydrophilic interaction liquid chromatography, HILIC)[8]等。每種方法在糖肽富集方面都有其自身的優(yōu)缺點,如凝集素色譜法對糖肽的專一性高,但是只對含有某一類末端糖的糖肽有效。在這些方法中,HILIC因其對糖基化覆蓋率高,方法重現(xiàn)性好,易于與MS聯(lián)用等優(yōu)點[9]而備受關注。用于糖肽富集的HILIC材料主要包括酰胺基[10]糖基[11]、氨基酸、二肽等[12]。含有不同官能團的HILIC材料對糖肽富集的效果也不同,因此,發(fā)展新型親水材料將有助于進一步提高糖肽富集的效率。
凝集素親和色譜法是利用肽-糖之間的相互作用通過多重氫鍵和特定的空間實現(xiàn)凝集素對糖蛋白/糖肽的特異性富集[7]。本研究將四肽引入到聚合物中,擬通過四肽與糖肽間的多重氫鍵作用和電荷可調(diào)控性,實現(xiàn)糖肽的選擇性富集。
2 實驗部分
2.1 儀器與試劑
LC-20AT液相色譜儀(日本島津有限公司); CS136XT多肽合成儀 (美國希施生物儀器有限公司); QuadraSorb SI4物理吸附儀(美國康塔儀器公司); STA 449 F3同步熱分析儀(德國耐馳公司); ESCALAB 250 Xi光電子能譜儀(美國賽默飛世爾科技有限公司); MicroTOF-Q液相色譜-質(zhì)譜聯(lián)用儀(德國布魯克集團); nanoESI Q-TOF MS液相色譜-質(zhì)譜聯(lián)用儀(美國Waters 公司); Milli-Q超純水儀(美國默克密理博公司)。
實驗中所用的溶劑、化學樣品均購于Merck公司。所有溶液均采用Milli-Q 超純水配制。GELoader 吸頭小柱(德國 Eppendorf公司); 300硅球、C18HC材料(浙江華譜新創(chuàng)科技有限公司); ZIC-HILIC材料(美國BioChem公司); DAPD由上海杰肽公司合成。
2.2 實驗方法
2.2.1 Poly-DAPD材料的合成 四肽材料的合成采用原子轉(zhuǎn)移自由聚合ATRP法進行接枝共聚[13],反應流程見圖1。首先取2 mmol高純度DAPD放入圓底燒瓶,加入15 mL無水N,N-二甲基甲酰胺(DMF),在0℃冰浴攪拌,加入三乙胺穩(wěn)定10 min,再使用恒壓漏斗滴加同三乙胺體積的丙烯酰氯,反應30 min,移至常溫攪拌再反應24 h,減壓蒸餾去除溶劑,甲醇再溶解后去除溶劑,重復3次,低溫保存?zhèn)溆谩? g 300 硅球混入HCl,常溫攪拌48 h,水洗過濾,直到濾液呈中性,真空干燥。稱取干燥后的羥基化硅球1 g,加入無水甲苯,冰浴攪拌并通入N2,滴加10%3-氨丙基三甲氧基硅烷常溫反應12 h,反應完成后用無水乙醇沖洗,真空干燥。取氨基化的硅球1 g,加入15 mL無水DMF,在0 ℃冰浴攪拌,穩(wěn)定后加入0.3 mL吡啶, 通入N2, 滴加溴代異丁酰溴,避光常溫反應12 h。所得產(chǎn)物用DCM多次清洗,真空干燥后密封保存。將0.8 g 酰氯化 DAPD(溶于3 mL純水)和1 g酰溴化的硅球(混于4 mL純水)移至茄型瓶中,超聲混勻后在常溫下密封,液氮凍融循環(huán),并用油泵抽干空氣。快速加入CuBr后,通入N2,再加入160 μL N,N,N',N',N''-五甲基二亞乙基三胺(PMDETA),等反應液變成墨綠色后避光油浴加熱,60℃下反應6 h。過濾并轉(zhuǎn)移至錐形瓶, 加入50% 甲醇-水溶液50 mL,加熱冷凝回流24 h, 過濾干燥。合成后的材料通過TGA、XPS、氮氣吸脫附等技術進行表征或分析。
2.2.2 胎球蛋白和BSA蛋白酶解 分別將1 mg胎球蛋白(Fetuin)和牛血清蛋白(BSA)標準品加入100 μL 6 mol/L 尿素,充分溶解后加入5 μL 200 mmol/L 二硫蘇糖醇,在56℃下振蕩45 min,然后加入20 μL 200 mmol/L 碘代乙酸銨, 避光常溫放置30 min。用50 mmol/L NH4HCO3溶液稀釋10倍,加入胰蛋白酶25 μg, 在37℃反應過夜,最后加入5 μL甲酸終止反應。所得的酶解液濃度約為1 mg/mL。上述溶液均溶于50 mmol/L NH4HCO3水溶液。
2.2.3 蛋白標準品酶解液脫鹽 稱取1 mg C18HC 材料加20 μL乙腈混勻,均勻加壓裝填入塞有單層 3M C18膜片的GELoader小柱。所得的固相萃取 (SPE) 小柱首先用20 μL 50% ACN/0.1% FA 溶液沖洗活化,再加入20 μL 0.1% FA 溶液平衡,然后將要去鹽的酶解液上樣。上樣后用40 μL 0.1% FA 溶液淋洗、20 μL 50% ACN/0.1% FA 溶液洗脫。洗脫液進行質(zhì)譜分析。
2.2.4 Poly-DAPD材料和 ZIC-HILIC材料富集糖肽 稱取1 mg Poly-DAPD材料,按2.2.3節(jié)的方法裝填成SPE小柱。將5 μL Fetuin酶解液溶于20 μL 80% ACN/0.1% FA后上樣,再用20 μL 75% ACN/0.1% FA淋洗兩次,最終用20 μL 40% ACN/0.1% FA洗脫。洗脫液進行質(zhì)譜分析。ZIC-HILIC材料富集糖肽的實驗參照文獻[14]進行。
2.2.5 質(zhì)譜分析 Nano ESI Q-TOF MS進樣流速為1 μL/min; 正離子模式下, nanospray 電壓為2.5 kV; 掃描范圍為m/z 600~2000。通過整理文獻報道的糖型和胰蛋白酶酶解后的肽鏈等信息并做成理論糖肽表格[8],手動核對m/z值及電荷數(shù)(±0.3 Da),電荷數(shù)必須一致,部分糖肽由二級質(zhì)譜確認。
3 結果和討論
3.1 Poly-DAPD材料的合成及表征
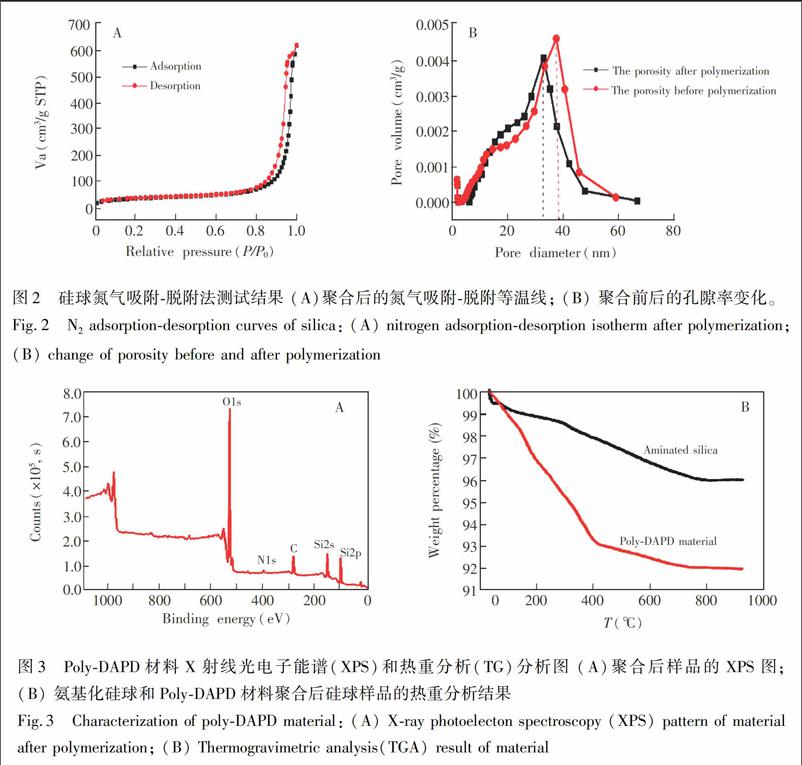
采用ATRP方法合成了Poly-DAPD,具體合成路線見圖1。合成后的材料通過TGA、XPS、氮氣吸脫附等溫儀等進行表征。氮氣吸脫附等溫線表明,硅球樣品呈標準的III型等溫線,而不是Ⅱ型等溫線,曲線沒有拐點,說明硅球上接枝有聚合物(圖2A); 從圖2B可見,接枝后聚合后孔隙率變小,硅球的孔徑從38 nm變成32 nm(BJH模型),說明接枝到硅球孔中的四肽厚度為3 nm; 熱重分析結果表明,DAPD 接枝到硅球表面的質(zhì)量為材料質(zhì)量的5.7%(圖3B)。 XPS譜圖顯示所合成聚合物上含有N、C、O等元素,進一步說明材料合成成功,(圖3A)。綜上所述,四肽已經(jīng)成功地聚合到硅球上。
3.2 Poly-DAPD材料富集糖肽及其與ZIC-HILIC材料結果對比
Fetuin是實驗室最常見的一種糖蛋白,因其糖基化位點明確,肽段序列清晰,糖肽數(shù)目相對豐富[15,16],常被用于評價合成材料的富集效果。首先將合成的Poly-DAPD材料裝在Eppendorf 凝膠吸頭中,做成SPE微柱。本實驗用Fetuin酶解液在微型SPE模式下評價了Poly-DAPD材料對糖肽富集的選擇性。圖4A為Fetuin酶解液去鹽液的質(zhì)譜分析譜圖,未經(jīng)過富集的Fetuin酶解液質(zhì)譜圖中大部分信號都是高豐度的非糖肽,糖肽只有兩條,分別是1470.2671(4+)和1634.1296(4+)。圖4B是Poly-DAPD材料富集Fetuin中糖肽后的質(zhì)譜檢測譜圖。對比富集前,富集后樣品中非糖肽數(shù)量從18條減少至6條,且剩下的非糖肽信號豐度均較低; 糖肽數(shù)量從2條增加至 39 條。新材料處理后的樣品中能檢測出較多的糖肽,證明新材料對糖肽富集有一定的選擇性。
為了進一步考察Poly-DAPD材料對糖肽富集選擇性, 采用更加復雜的樣品評價,并與廣泛用于糖肽富集的商品化材料ZIC-HILIC材料進行了對比。采用Poly-DAPD材料富集摻比有5摩爾倍數(shù)的BSA酶解液和Fetuin酶解液的混合物,在優(yōu)化后的富集條件下可檢測到35條Fetuin糖肽(圖5A)。同倍數(shù)摻比BSA, ZIC-HILIC材料則富集到14條Fetuin糖肽,如圖5B所示。兩種材料都富集到糖肽但有所不同,如糖肽1316.1968(3+)在Poly-DAPD材料處理后并未檢測到,說明新材料的選擇性與ZIC-HILIC有所不同。進一步對比富集到的共有糖肽的相對豐度,ZIC-HILIC材料富集的糖肽豐度是Poly-DAPD材料結果(以下豐度對比均以ZIC-HILIC材料富集到最高豐度糖肽1634.1296(4+)為例,在Poly-DAPD材料結果中該糖肽豐度排行第二)的4倍。但ZIC-HILIC材料富集結果中最高非糖肽(1057.4550(2+))豐度是糖肽豐度的6倍,而Poly-DAPD材料富集的最高非糖肽豐度(1006.5145(3+))是糖肽豐度的1倍。結果表明,Poly-DAPD材料比ZIC-HILIC材料富集到的糖肽數(shù)目多21條,其富集結果受非糖肽的影響也更小。Poly-DAPD材料作為一種新的親水材料,對Fetuin 糖肽選擇性優(yōu)于ZIC-HILIC材料, 并具有一定的抗干擾能力, 證明此材料在實際樣品糖基化研究當中的潛力。
4 結 論
合成了一種基于四肽的新型 HILIC材料,并對其結構和形貌進行了表征。Poly-DAPD對糖肽的富集選擇性顯著高于商品化ZIC-HILIC材料, 表明此新型HILIC材料用于糖肽富集中具有較好的應用前景。
References
1 YU Jing, LI Xiao-Min, LI Hong-Mei, ZHANG Qing-He, LI Xiu-Qin, SHAO Shu-Li. Chinese J. Anal.Chem., 2015, 43 (4): 564-569
于 晶, 李曉敏, 李紅梅, 張慶合, 李秀琴, 邵淑麗. 分析化學, 2015, 43(4): 564-569
2 Sperandio M, Gleissner C A, Ley K. Immunol. Rev., 2009, 230: 97-113
3 Yang G L, Tan Z Q, Lu W, Guo J, Yu H J, Yu J M, Sun C W, Qi X W, Li Z, Guan F. J. Proteome Res., 2015, 14(2): 639-653
4 Kolarich D, Jensen P H, Gltmann F, Packer N H. Nat. Protoc., 2012, 7(7): 1285-1298
5 Zhang Y, Go E P, Desaire H. Anal. Chem., 2008, 80(9): 3144-3158
6 Jiang H, Yuan H M, Qu Y Y, Liang Y, Jiang B, Wu Q, Deng N, Liang Z, Zhang L H, Zhang Y K. Talanta, 2016, 146: 225-230
7 Wang H P, Jiao F L, Gao F Y, Huang J J, Zhao Y, Shen Y H, Zhang Y J, Qian X H. J. Mater. Chem., 2017, accepted
8 Zhao Y Y, Yu L, Guo Z M, Li X L, Liang X M. Anal. Bioanal. Chem., 2011, 399(10): 3359-3365
9 Yu L, Li X L, Dong J, Zhang X L, Guo Z M, Liang X M. Anal. Methods, 2010, 2(11): 1667-1670
10 Zhang Y, Kuang M, Zhang L, Yang P, Lu H. Anal. Chem., 2013, 85(11): 5535-5541
11 Ren L, Liu Y, Dong M, Liu Z. J. Chromatogr. A, 2009, 1216(47): 8421-8425
12 Cao J, Shen C, Wang H, Shen H, Chen Y, Nie A, Yan G, Lu H, Liu Y, Yang P. J. Proteome Res., 2009, 8(2): 662-672
13 Sun T L, Qing G Y. Adv. Mater., 2011, 23(12): H57-H77
14 Mysling S, Palmisano G, Hojrup P, Thaysen-Andersen M. Anal. Chem., 2010, 82(3): 5598-5609
15 Kurihara T, Min J Z, Hiratta A, Toyo'oka T, Inagaki S. Biomed. Chromatogr., 2009, 23(5): 516-523
16 Windwarder M, Altamann F. J. Proteomics, 2014, 108: 258-268

