龍須菜配子體發育和不同品系四分孢子體四分孢子形成過程顯微結構觀察
米萍,隋正紅*,闕州,周偉,商二磊
(1.中國海洋大學 海洋生物遺傳與育種教育部重點實驗室,山東 青島 266003)
?
龍須菜配子體發育和不同品系四分孢子體四分孢子形成過程顯微結構觀察
米萍1,隋正紅1*,闕州1,周偉1,商二磊1
(1.中國海洋大學 海洋生物遺傳與育種教育部重點實驗室,山東 青島 266003)
龍須菜配子體和四分孢子體在生殖結構的形成和發育的過程中,出現一系列的細胞形態和結構層面的變化。本實驗以龍須菜雌雄配子體和不同品系龍須菜四分孢子體為實驗材料,采用連續徒手切片的方法,觀察龍須菜配子體發育和不同品系四分孢子體四分孢子形成過程。觀察到,雌雄配子體發育經過幼苗期、毛細胞期、性成熟期,幼苗期和毛細胞期雌雄配子體間無明顯差異,進入性成熟期后,產生生殖結構時才能將其區分開。四分孢子起源于四分孢子體表皮層細胞,初始為鮮紅色直徑約5~10 μm的細胞,逐漸生長形成成熟的直徑約20~25 μm的四分孢子囊,并分裂為4個四分孢子聚集在四分孢子囊中,在藻體外,四分孢子釋放變形成球形,龍須菜四分孢子的形成和發育過程伴隨著髓部細胞中紅藻淀粉顆粒的減少。其中“981”龍須菜形成較多的畸形四分孢子,可能是其表現低育的一個原因。龍須菜自基部到尖端的表皮層細胞層數、髓部細胞數目和體積均發生連續的變化。細胞連接廣泛存在于龍須菜表皮層、皮層和髓部細胞之間,但各層細胞連接大小、數目、長度等都存在差異。釋放的四分孢子可能會附著在四分孢子體上,固著器覆蓋包繞四分孢子體甚至侵入到破損有傷口的四分孢子體內,形成四分孢子體和配子體在同一株上的世代混雜現象,這也可能是導致龍須菜表現遺傳復雜性的原因。
龍須菜;配子體;四分孢子體;生殖結構;顯微觀察
1 引言
龍須菜(Gracilariopsislemaneiformis)隸屬于紅藻門(Rhodophyta)、紅藻綱(Rhodophyceae)、真紅藻亞綱(Florideae)、杉藻目(Gigartinales)、江蘺科(Gracilariaceae),是一種重要的大型海洋經濟紅藻。龍須菜是生產瓊膠的重要原料[1—2],同時也是鮑魚養殖的飼料[3—4],另外龍須菜還有食用[5]和凈化水體[6—7]等作用。
1998年選育出的有耐高溫、速生、抗逆、瓊膠含量高等優良特性的“981”龍須菜新品種[8],奠定了龍須菜栽培的基礎,隨后在2007年選育出“2007”良種[9],2014年培育出“魯龍1號”[10],使得龍須菜栽培養殖得到更大規模的推廣。據2013年中國漁業統計年鑒報道,以龍須菜為代表的江蘺栽培成為我國第二大海藻栽培產業。
龍須菜是典型的三世代交替(或稱多管藻)型生活史,包括二倍體的四分孢子體、附生于雌配子體藻枝上的果孢子體世代和單倍體的配子體世代[11]。從20世紀40年代起,對江蘺科精子囊類型有詳細的報道[12],對精子囊和果胞的分布組成和形態結構,也有了深入研究[13—14],較為全面地了解了配子體生殖結構的特征和細胞組成,而配子體性成熟前期的發育過程未見報道,也缺乏對配子體生長發育階段的連續觀察,另外雌雄配子體在形態上相似,配子體性成熟前難于從形態上加以區分,對配子體發育階段的典型過程缺乏判斷,也限制了雜交育種工作的進程。“981”龍須菜是四分孢子體,其在生長過程中表現出不同的發育特性,即四分孢子的數量低于野生型,表現低育晚育的特性[15]。對于龍須菜四分孢子體的研究,局限于四分孢子在藻體表面的存在狀態及四分孢子附著生長為配子體幼苗過程的研究[16],而對四分孢子形成和釋放過程缺乏研究報道。“981”龍須菜發育特性的不同使之成為揭示龍須菜四分孢子體發育控制與變化的難得材料,另外在產業上具有低育晚育特性的品系(種)有更重要的應用價值,與其高產的生產性狀可能存在遺傳和生長發育層面的聯系。
本實驗進行了龍須菜配子體發育和不同品系四分孢子體四分孢子形成過程顯微結構觀察,一方面可以完善配子體生長發育的過程,尋找性成熟前期雌雄配子體間的差異,促進雜交育種進程;另一方面找到“981”龍須菜的細胞結構和顯微觀察層面的生長特性,闡釋四分孢子體發育控制機理。
2 材料和方法
2.1 實驗材料
本實驗的材料包括龍須菜雌雄配子體,及“981”龍須菜、“魯龍1號”兩個栽培良種和龍須菜四分孢子體野生品系。
配子體來源:實驗室條件下收集2013年12月份在湛山灣采集的野生四分孢子體放散出的四分孢子培養長成的配子體。
四分孢子體材料來源:“981”龍須菜和“魯龍1號” 兩個栽培良種來自福建莆田龍須菜栽培海區和青島膠州灣龍須菜栽培海區,采集時間為2015年6月至2015年9月;野生龍須菜四分孢子體采自青島湛山灣,采集時間為2015年4月至2015年10月。
2.2 實驗材料的處理和培養
實驗材料采集后,先用海水沖洗3遍后,再用滅菌海水沖洗并用毛刷刷掉表面其他不易沖洗掉的雜藻和雜質等。其中,2013年12月份采集的野生四分孢子體,實驗室條件下收集放散的四分孢子,待四分孢子長成配子體幼苗后單株培養30株。培養條件:溫度23℃, 光照40 μmol/(m2·s), 光周期12L/12D。
2015年采集的“981”龍須菜、“魯龍1號”和野生四分孢子體,用于四分孢子體四分孢子形成觀察,培養條件:(20±1)℃,光照30 μmol/(m2·s), 12L/12D條件下培養,每3天換一次加入Pro培養基的新鮮滅菌海水。
2.3 實驗材料的觀察
2.3.1 野生龍須菜配子體觀察
根據Zhou等[17]開發的龍須菜性別相關SCAR標記,按照相應的實驗步驟對30株龍須菜配子體幼苗進行雌雄鑒定,根據鑒定結果選取雌雄配子體各3株,連續徒手切片在顯微鏡(Nikon ECLIPSE 80i,日本)下觀察雌雄配子體生殖結構的形成和發育過程。
2.3.2 野生龍須菜四分孢子體觀察
實驗材料在顯微鏡(Nikon ECLIPSE 80i,日本)下觀察,判斷藻體狀態和初步判斷生長發育階段。
采集到的龍須菜在顯微鏡下鏡檢觀察,不同采集時間的龍須菜生長狀態和發育階段不同,挑選出同一時間采集的“981”龍須菜和“魯龍1號”未成熟材料各3株,在實驗室條件下培養。同時挑選同一時間段采集的未成熟野生龍須菜,從外觀形態上挑選藻體表面無囊果、藻枝較粗壯的未成熟的野生龍須菜,每3天進行一次觀察,連續觀察藻體表面細胞狀態和變化,并進行徒手切片,觀察藻體橫切面上表皮、皮層和髓部細胞的結構和變化及四分孢子的形成和發育過程。
在實驗室條件下培養,培養一段時間后出現四分孢子囊原始細胞并形成四分孢子囊的藻株即為野生龍須菜四分孢子體。對鑒定確認為野生四分孢子體的藻株連續觀察。
2.4 龍須菜不同部位和不同層次細胞特征及細胞連接
雌雄配子體和野生四分孢子體從靠近固著器的基部、中部、藻尖進行連續切片,觀察不同部位細胞特征。
采用高碘酸-Schiff試劑染色(PAS)和考馬斯亮藍-R250(CBB)染色[18—19]。其中PAS染色將多糖類染為紅色,CBB染色將蛋白質成分染為藍色。將材料用中性甲醛固定后,用PAS染色和CBB染色,觀察細胞中多糖和蛋白質的組成和相關細胞結構。
3 結果
3.1 龍須菜配子體生長發育過程觀察
龍須菜雌雄配子體生長首先經歷幼苗期,藻體只有一層表皮細胞,隨后在表層細胞中會出現與表皮細胞大小相近顏色偏綠的細胞(圖1 a),細胞不斷生長變大,產生大液泡(圖1 b)并發生分裂形成一個上位產毛細胞和1個下位細胞(圖1 c),產毛細胞上端生長突出淺色毛狀結構,毛狀結構能不斷生長甚至大于毛細胞(圖1 d~f),毛細胞出現階段藻體生長快速。在幼苗期和毛細胞期雌雄配子體形態和發育過程無明顯差異。
藻體進入生殖成熟期后,雄配子體表皮細胞通過一次斜縱分裂產生兩個精子囊母細胞(圖1 g);精子囊母細胞再通過一次橫分裂產生一個上位的精子囊細胞(spermatangium)和一個下位的較小精子囊母細胞(圖1 h);精子囊細胞釋放不動精子后,顏色變淺(圖1 i)。精子細胞直徑約3~5 μm,較周圍表皮細胞(直徑約10~15 μm)小(圖1 j)。

圖1 龍須菜雌雄配子體毛細胞發育過程和生殖結構的形成Fig.1 Development process of hair cell and reproductive apparatus in the male and female gametophyte of G. lemaneiformis. a. 初始毛細胞(箭頭所示),b. 毛細胞增大,出現大液泡(箭頭所示),c. 毛細胞分裂產生產毛細胞(箭頭所示)和下位細胞(無柄箭頭所示),d~f. 突出的毛結構生長(箭頭所示);g~j. 雄配子體精子囊發育,g. 初始精母細胞進行一次斜縱分裂產生2個精母細胞(箭頭所示),h. 精母細胞進行一次橫分裂產生1個靠上的精細胞和1個靠下的小精母細胞(箭頭所示),i. 精細胞(箭頭所示)成熟顏色變淺,j. 精母細胞(sp)較表皮細胞(ep)小; k~l. 雌配子體生殖結構發育,k.支持細胞(su)和上方的原始果胞細胞(cp),l. 原始果胞細胞橫分裂形成1個上方的果胞(cp)和1個下方的下位細胞(hy), 兩邊分布著2~3個營養細胞枝(sb).l、w表示長度、寬度,單位μma. The primary hair cell(see arrow), b. The hair cell increased in volume and formed a big vacuole(see arrow), c. The hair cell divided into an upper hair produced cell(see arrow) and a lower cell(see arrowhead), d-f. The growth of protruded hair structure(see arrow);g-j. Development of male apparatus, g. The primary spermatangium mother cell splits oblique-longitudinally to produce two spermatangium mother cells(see arrow), h. The spermatangium mother cell divided transversely to produce an upper spermatangium and a lower small spermatangium mother cell(see arrow), i The spermatangium turned white after the sperms were released,j. The spermatangium was smaller than the epidermal cell. k-l. Development of female apparatus,k. The supporting cell(su) and an upper carpogonial branch initial(cp), l. The carpogonial branch initial splited into an upper carpogonium(cp) and a lower hypogynous cell(hy), 2-3 cells sterile branches distribute on the both side. l:length, w:width,unit:μm
雌配子體表皮層中,支持細胞通過分裂產生一個上方的原始果胞細胞(cp)和下方的支持細胞(su)(圖1 k),原始果胞細胞兩邊存在兩個營養細胞,隨后,原始果胞細胞通過分裂產生2~3個細胞組成的營養細胞枝(sb)(圖1l),成熟的雌性生殖結構由果胞(cp)、下位細胞(hy)、支持細胞(su)(圖1l)及果胞兩邊2~3個細胞的營養細胞枝組成,并最終通過受精絲與精子結合。

圖2 不同品系龍須菜四分孢子形成過程中表皮層和髓部細胞的變化Fig.2 The change of the epidermal cells and medullary cells in different strains of tetrasporophyte of G. lemaneiformisa1~a6,c1~c6,e1~e6.分別為野生龍須菜,“魯龍1號”,“981”龍須菜四分孢子形成過程;b1~b6,d1~d6,f1~f6.分別為野生龍須菜四分孢子體,“魯龍1號”,“981”龍須菜四分孢子形成過程中對應髓部細胞的變化a1-a6,c1-c6,e1-e6. Development of tetrasporgonia in tetrasporophyte of wild type, cultivar “Lulong NO.1”, and cultivar 981 respectively; b1-b6,d1-d6,f1-f6. The change of medullary cells during the development of tetraspogonia in tetrasporophyte of wild type, cultivar “Lulong NO.1”, and cultivar 981 respectively
3.2 龍須菜四分孢子體生長發育過程觀察
觀察到包括四分孢子囊的形成過程和發育過程,及四分孢子的放散過程。
3.2.1 龍須菜四分孢子囊形成過程中表皮層、皮層和髓部細胞的形態變化
在相同培養條件下,龍須菜初期表皮層細胞顏色大小均一(圖2 a1,c1,e1),野生龍須菜四分孢子體和“魯龍1號”在實驗室培養1個月左右藻體表皮中出現鮮紅色的四分孢子囊母細胞;但“981”龍須菜較難形成四分孢子囊,相同培養條件下,培養2個月左右藻體表面才出現鮮紅色四分孢子囊母細胞。
形成四分孢子囊母細胞后,四分孢子囊的生長發育可以分為:四分孢子囊母細胞出現和細胞生長期,該時期在表皮細胞中出現顏色鮮紅、直徑在5~10 μm大小與表皮層細胞大小相似的細胞,即為四分孢子囊母細胞(圖2 a2,c2,e2箭頭所示),四分孢子囊母細胞大量出現,對應的髓部細胞中含有大量的紅藻淀粉顆粒(圖2 b2,d2,f2),隨后細胞生長體積變大,細胞直徑達到15~25 μm(圖2 a3,c3,e3),對應的髓部細胞中紅藻淀粉顆粒減少(圖2 b3,d3,f3),時間持續1周左右;接著進入四分孢子囊分裂期,該時期四分孢子囊直徑增大到15~25 μm,在藻體表面能觀察到四分孢子囊中間的分裂溝(圖2 a4,c4 箭頭所示),對應的髓部細胞中紅藻淀粉顆粒進一步減少并且髓部細胞邊緣出現不規則的褶皺狀突起(圖2 b4,d4,f4),此時四分孢子囊母細胞已經進行了2次分裂,形成4個四分孢子母細胞;四分孢子放散期,這一時期四分孢子囊從藻體上脫落,在藻體外四分孢子囊內的四分孢子母細胞變形釋放出球形四分孢子,同時在藻體表面留下孔洞(圖2 a5,a6,c5,c6,e5,e6)。對應的髓部細胞中紅藻淀粉顆粒進一步減少到幾乎不可見的程度并且髓部細胞邊緣出現不規則的褶皺狀突起更加明顯(圖2 b5,d5,f5),放散完全后,髓部細胞不規則突起程度減緩(圖2 b6,d6,f6)。
3.2.2 橫切面上龍須菜四分孢子形成及釋放過程
四分孢子囊母細胞出現和生長期,該時期四分孢子囊母細胞不斷生長,體積變大,橫切面上觀察,四分孢子囊母細胞從直徑(5~10) μm×(10~15) μm左右逐漸長大到(20~25) μm×(40~45) μm左右的橢球形細胞(圖3 a1~a3,b1~b3,c1~c3 箭頭所示)。同時周邊表皮細胞隨著四分孢子囊母細胞的生長逐漸變形,細胞變細長,由兩層表層細胞相連接,形成圍繞四分孢子囊母細胞的一個囊窩狀結構(圖3 a3,b5 無柄箭頭所示)。在藻段表面觀,能觀察到四分孢子囊母細胞體積進一步擴大,直徑從5~10 μm增大到15~25 μm,顏色呈現均勻分布的鮮紅色,而周圍表皮細胞色素顏色較淺,圍繞細胞外周,中間顏色淺(圖2 a,c,e)。
四分孢子囊母細胞分裂期,四分孢子囊母細胞生長到大約(20~25)μm×(40~50)μm的橢球形細胞,細胞生長到這個階段后四分孢子囊母細胞開始分裂,第一次分裂為橫分裂,分裂面垂直橫切面半徑方向,細胞一分為二;第二次分裂的分裂面沿著橫切面的半徑方向,但是第一次分裂形成的上下2個細胞與第二次分裂時的分裂面大部分并不在同一平面,2個分裂面呈一定角度(0°~90°),因此在橫切面上看到較多的是四分孢子囊中的3個細胞,呈現“T”形分布(圖4 a,b),少數情況下能看到第二次分裂上下2個細胞分裂面重合,橫切面上能觀察到4個細胞呈現“十”字形排列(圖4c)。形成的4個四分孢子原始細胞在藻體上并沒有形成細胞壁及4個完全分離的四分孢子,而是4個四分孢子原始細胞聚集在一起。此時在藻體表面上觀察到四分孢子囊直徑約15~20 μm,同時能明顯觀察到細胞分裂為2個細胞(圖2 a4,c4,e4)。
四分孢子釋放期,四分孢子囊母細胞在藻體上進行兩次減數分裂形成聚集在一起的一個由4個四分孢子原始細胞組成的四分孢子囊,整個四分孢子囊從藻體上脫離,游離到藻體外,在藻體表面留下孔洞(圖3 a5,a6,b5,b6,c5箭頭所示)。游離出的四分孢子囊,一般在10 min內完成四分孢子的釋放過程,四分孢子的釋放過程,由原來分裂形成的四分孢子原始細胞,發生原生質體流動及細胞變形,從四分孢子囊中脫離,形成球形四分孢子(圖5)。
3.2.3 不同品系龍須菜在四分孢子形成和發育過程中的差異
野生龍須菜四分孢子體、“魯龍1號”、“981”3種品系龍須菜在四分孢子形成過程中,觀察到野生龍須菜四分孢子體和“魯龍1號”四分孢子形成和發育過程與“981”龍須菜存在差異。
“981”龍須菜在形成四分孢子囊和四分孢子釋放過程中,與“魯龍1號”和野生四分孢子體相比:
(1)出現較多畸形發育的四分孢子囊,四分孢子囊發育不完全、細胞發生變形、顏色變為粉紅色(圖6a~f)。
(2)從藻體脫離的四分孢子囊,很大一部分不能正常釋放形成4個正常的四分孢子。一部分游離出的四分孢子囊,伴隨著色素的消失發生破裂溶解(圖6g~l);一部分釋放出的四分孢子很快破裂溶解,僅剩1~3個正常四分孢子(直徑20~25 μm)(圖6 m,n);一部分釋放出4個四分孢子大小存在明顯差異,直徑從5 ~25 μm不等,形成的較小的四分孢子會很快破裂內容物流出(圖6 o,p);一部分游離的四分孢子囊長時間(小于等于2 h)內,形態上無明顯變化,四分孢子不能正常釋放(圖7 f);另外還有一部分釋放4個正常四分孢子。

圖3 不同品系龍須菜四分孢子體四分孢子囊的發育和釋放過程Fig.3 Development of tetraspogonium in different strains of tetrasporophyte of G. lemaneiformisa1~a6,b1~b6,c1~c6. 分別是野生龍須菜四分孢子體,“魯龍1號”,“981”龍須菜四分孢子囊形成和釋放過程。a1~a4,b1~b5,c1~c4. 箭頭所示為四分孢子囊細胞;a5, a6,c5. 箭頭所示為四分孢子囊放散后留下的傷口,其中a6表示四分孢子已經釋放出來a1-a6,b1-b6,c1-c6. The development of tetraspogonium. a1-a4,b1-b5,c1-c4. The arrows showed the tetraspogonium; a5, a6,c5. The arrows showed the wound left after the release of tetraspogonium, a6. The tetraspores had been released

圖4 龍須菜四分孢子分裂后排列方式Fig.4 The arrangement pattern of the divided cells in tetraspogoniuma,b.“T”形排列四分孢子;c. “十”字形排列四分孢子a,b .“T” type; c. The cross vertical type

圖5 藻體外四分孢子釋放過程Fig.5 The releasing process of tetraspores outside the matrixa~e.顯示四分孢子釋放和發生變形變為球形的過程a-e.The process of releasing and deforming into spherical

圖6 “981”龍須菜畸形的四分孢子囊及異常的四分孢子Fig.6 The deformed tetraspogonia of cultivar 981 a~f. 畸形的四分孢子囊;a. 表皮層中的畸形四分孢子囊,顏色粉色且畸形;b. 表皮層細胞橫切面畸形四分孢子囊細胞;c,d. 四分孢子囊中的四分細胞不規則排布;e,f. 畸變四分孢子囊游離藻體外. g~l.四分孢子囊游離后溶解;g,h. 四分孢子囊開始溶解;i,j. 細胞溶解色素消失;k,l. 細胞中色素消失,溶解顆粒狀碎片. m~n.四分孢子部分發生溶解,僅剩1個或2個正常細胞;o~p. 同一個四分孢子囊形成2個正常大小的四分孢子和2個較小的細胞a. The deformed tetraspogonia in the epidermal layer, the color is pink and the cell shape is deformed; b. The deformed tetraspogonium in the epidermal layer in the transaction; c,d. Irregular arrangement of the tetraspores in the deformed tetraspogonium.; e,f. The deformed tetraspogonium outside the matrix. g-l. The tetraspores dissolved after released. g,h. The tetraspogonium began to dissolve; i,j. The cells dissolved and the pigment decrease; k,l. The pigment of the cells disapeared and dissolved into granular debris. m-n. The tetraspores dissolved partially, only one or two normal tetraspores left; o-p. two normal tetraspores and two small tetraspores from one tetraspogonium
3.3 龍須菜不同部位細胞特征及細胞連接觀察
3.3.1 龍須菜藻體不同部位細胞的組成和特征
龍須菜雌雄配子體和四分孢子體細胞組成,無明顯差異,在基部接近固著器的地方,無髓部細胞(圖7a),表皮層細胞5~20層,大小與最外表層細胞相近(圖7a,b),髓部細胞中的紅藻淀粉顆粒密度大,從基部到中部藻段,表皮層細胞層數減少到1~2層(圖7c,d),髓部細胞出現并增多變大,細胞中的紅藻淀粉顆粒密度減少(圖7d)。再往上到尖端部位時,表層細胞只有一層,髓部細胞中含有較多色素,基本無紅藻淀粉顆粒(圖7e)。
3.3.2 細胞連接
配子體和四分孢子體均能在表皮層、皮層、髓部細胞中觀察到細胞之間的連接,雌雄配子體和四分孢子體無明顯差異。
細胞連接廣泛存在龍須菜不同時期和不同部位的細胞之間。在表皮細胞之間、表皮細胞和皮層細胞之間,皮層細胞之間,皮層細胞與髓部細胞之間,髓部細胞之間普遍存在。細胞連接的數目,大小和形態在不同部位的連接存在差異。
(1)表皮細胞之間的細胞連接
最外一層的表皮細胞之間沒有觀察到細胞連接(圖8 a1);下層的表皮細胞之間存在連接(圖8 a2)。最外表皮細胞與下方緊鄰的一層表層細胞之間存在連接(圖8 b1~b3),由于大多數情況下,表皮細胞層數為1~2層,細胞連接存在于上下表皮細胞之間,及下層表皮細胞之間,兩個細胞之間的連接數目通常為1個細胞連接。但是在野生四分孢子體基部,靠近附著器的部位,進行切片觀察能觀察到表皮細胞層數能達到3~4層或更多層,位于下層的多層表皮細胞之間存在上下表皮層細胞間縱向的細胞連接和同層表皮層細胞間橫向的細胞連接(圖8 c1~c3)。表皮層細胞排列緊密,在光鏡下不經染色處理不易觀察到表層細胞之間的連接。綜上,表層細胞之間存在連接,連接數目通常為1個,細胞連接之間的方向排列較為規律,沿著橫切半徑方向或垂直于半徑方向(縱向連接),連接處的直徑大小約0.5 μm,長度約小于1 μm。染色結果顯示,連接處PAS染色呈現紅色,CBB染色呈現藍色,說明含有多糖和蛋白組分。
(2)表皮細胞與皮層細胞的細胞連接
通常一個皮層細胞能與多個表皮細胞之間存在細胞連接,細胞連接長度約3~5 μm,直徑大小約1~2 μm。通常2個細胞間連接長度不等長,表皮細胞的連接常短于皮層細胞的連接,2個表皮細胞連接到一個皮層細胞上,2個細胞連接呈”Y”型排列,表皮細胞與皮層細胞之間的細胞連接數目通常為1個(圖8 d1~d3)。
(3)皮層細胞之間的細胞連接
皮層細胞之間的細胞連接數目通常也為一個,細胞連接處長度約為3~6 μm,直徑大小約為1~2 μm,2個細胞之間的連接長度基本相同,2個細胞間的連接數目大多數為一個(圖8 e1,e2)。
(4)皮層細胞與髓部細胞之間的細胞連接
皮層細胞與髓部細胞之間的細胞連接長度約6~10 μm,連接處直徑大小約2~5 μm,細胞連接方向沒有明顯規律和方向性,皮層細胞與髓部細胞之間連接長度不等長,細胞連接的數目可能大于1個,1個皮層細胞可以與1個髓部細胞有1個或2個細胞連接,多個皮層細胞可以與1個髓部細胞間產生多個細胞連接(圖8 f1~f3)。
(5)髓部細胞之間的連接
髓部細胞之間連接通常比較明顯,細胞連接長度約為5~10 μm,連接處直徑大小約為3~5 μm,2個髓部細胞間的連接長度基本等長(圖8 g1~g5),2個相鄰的髓部細胞之間可以形成數目3個以上,甚至超過10個以上的細胞連接(圖8 g3)。髓部細胞在形成褶皺時,在同一個細胞褶皺處存在細胞連接(圖8 g6)。
龍須菜不同層細胞連接的特征見表1。

表1 各層細胞間細胞連接特征比較

圖7 龍須菜不同部位細胞組成及異常四分孢子囊Fig.7 Different parts of the cell composition in G. lemaneiformis and deformed tetraspogoniuma,b. 靠近固著器的基部;c. 基部藻段 表皮層細胞1~2層,淀粉顆粒密度大; d. 中部藻段 表皮層細胞1~2層,淀粉顆粒密度減少; e. 尖部藻段 表皮層細胞1層,無明顯淀粉顆粒,含有色素; f. 不能正常釋放四分孢子的游離四分孢子囊a,b. The base part near the holdfast; c. Base part, one or two layers of epidermal cells, with more starch granules; d. Middle part, one or two layers of epidermal cells, the density of the starch granules decreased; e. Tip part, only one layer of epidermal cells, little starch granules, had pigment granules; f. The deformed tetraspogonium did not release tetraspores

圖8 龍須菜不同層間的細胞連接Fig.8 The pit connection in different layers of G. lemaneiformisa1.最外表皮細胞, a2.下層表皮細胞之間的細胞連接;b1~b3.最外表皮層和下層表皮細胞之間的細胞連接;c1~c3.基部靠近固著器部位多層表皮細胞之間的細胞連接;d1~d3.表皮層與皮層細胞間的細胞連接呈現“Y”形;e1,e2.皮層細胞之間的細胞連接;f1~f3.皮層和髓部細胞之間的細胞連接;g1~g6.髓部細胞之間的細胞連接。a1,a2,b2,c2,d2,e1,e2. PAS染色;b3,c3,d3. CBB染色;箭頭示細胞連接a1. The most outside layer of epidermal cells, a2. The cell connections between the lower epidermal cells; b1-b3. Pit connection between the most outside epidermal cells and the lower epidermal cells; c1-c3. Pit connections between epidermal cells; d1-d3. The ”Y” pattern arrangement of pit connections between epidermal cells and the cortial cells; e1,e2. Pit connections between cortical cells; f1-f3. Pit connection between cortical cells and medullary cells; g1-g6. Pit connections between medullary cells, g1-g5. Pit connection between adjacent medullary cells; g6. Pit connection existed in the fold region of one medullary cell. a1,a2,b2,c2,d2,e1,e2. Dyeing by Perildate-Schiff reageant; b3,c3,d3. Dyeing by Coomassie Brilliant Blue; arrow showed cell connections
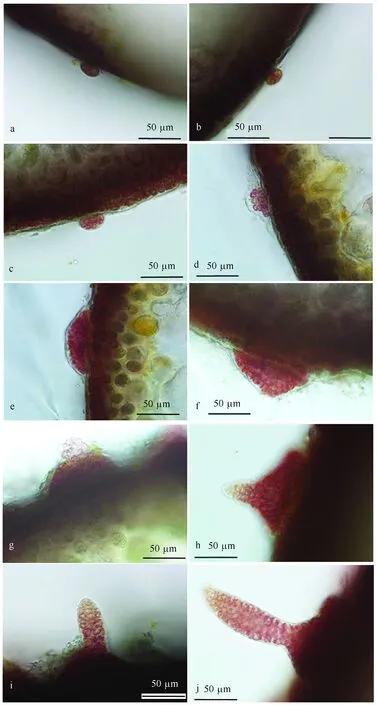
圖9 附著在四分孢子體藻體表面的四分孢子生長發育過程Fig.9 Development process of the attached tetraspores on the tetrasporophytea. 四分孢子附著到四分孢子體表面細胞變扁平;b. 四分孢子分裂產生四細胞;c. 細胞繼續分裂產生多層的細胞團;d. 細胞團向周邊擴張,附著面積增大;e,f. 細胞不斷分裂和擴張,形成半球形盤狀體;g. 盤狀體最頂端的細胞生長突出表面;h. 長出直立幼苗;i. 直立幼苗不斷生長;j. 直立幼苗基部縊縮區域a. The tetraspore attached to the surface of the tetrasporophyte and became flat; b. Tetraspore divided into four cells; c. Cells grew to multilayer cell cluster; d. Cell cluster grew, and the attached area enlarged; e,f. Cell cluster grew and became hemispherical discoidal body; g. The cells in the tip of the discoidal body extruded; h. Upright seeding formed; i. The seeding grew up; j. The constricted region of the seedling

圖10 配子體固著器包繞四分孢子體藻枝結構和藻體表面破損處配子體與四分孢子體細胞的分布及形態Fig.10 The structure of the holdfast grew surrounding the branch of the tetrasporophyte and the cell distribution between gametophyte and tetrasporophyte in epidermal damaged regiona,b.配子體固著器包繞覆蓋四分孢子體藻枝一周,c,d. 配子體包繞覆蓋四分孢子體藻枝橫切;e. 配子體固著器與四分孢子體相交部位分界面;f.配子體固著器與四分孢子體相交部位分界面放大;g.配子體固著器與四分孢子體相交部位明顯的分界線.(箭頭示配子體與四分孢子體的分界線).h~j.位于藻體表面破損處配子體與四分孢子體細胞的分布及形態a,b. The holdfast wrapped the tetrasporophyte branch; c,d. The transection of the holdfast wrapped the branch; e. The boundary of holdfast of gametophyte and tetrasporophyte; f. The magnification of the boundary of holdfast of gametophyte and tetrasporophyte; g. The boundary of holdfast of gametophyte and tetrasporophyte. (arrow showed the boundary); h-j. The cell distribution between gametophyte and tetrasporophyte in epidermal damaged region
3.3.3 四分孢子釋放后附著在藻體上生長發育過程
實驗室培養條件下,觀察到龍須菜釋放的四分孢子與四分孢子體在同一培養體系下,部分四分孢子會附著在四分孢子體的藻枝上,生長分裂形成配子體幼苗,在生長發育的過程中,部分配子體幼苗會從四分孢子體上脫落;部分配子體幼苗會一直附著在四分孢子體表面,固著器固著面積不斷擴大,覆蓋藻枝,四分孢子體和配子體混生在一起。而四分孢子附著在四分孢子體生長發育的過程如下:
(1)部分游離的四分孢子附著在四分孢子體藻體表面,四分孢子細胞變形,細胞由球形變為扁球形附于藻體表面(圖9 a)。
(2)細胞開始分裂,最開始的幾次分裂僅增加細胞數目,整體體積無變化,細胞體積不斷減小,使得四分孢子由一個細胞形成一個多層細胞團結構(圖9b,c)。
(3)細胞生長,細胞體積變大,細胞不斷進行分裂,附著的邊緣沿著藻體擴大,形成半球形的盤狀體(圖9 d,e)。
(4)半球形結構頂端的幾個細胞快速分裂和生長,形成突出半球形藻體表面的細小突起(圖9 f,g)。突起處的細胞不斷分裂生長,伸長產生幼小的主枝,主枝靠近盤狀體的下部藻段有一段縊縮區域(圖9 h,i,j)。
(5)主枝細胞繼續分裂生長,主枝伸長變粗并產生分枝,主枝生長過程中固著器沿著四分孢子體藻體表面不斷生長,固著面積不斷擴大,覆蓋四分孢子體藻體表面,甚至能夠包裹四分孢子體藻枝,擴大生長的固著器上能形成新的突起,繼續生長為新的藻枝,形成四分孢子體和配子體混生在一起的現象。
四分孢子附著在四分孢子體上生長發育為配子體過程中,有一部分配子體的固著器與藻體表面接觸較小,隨著主枝生長,沒有明顯生長,這種配子體容易從附著藻體表面脫落,在生長發育過程中很大一部分附著生長的配子體幼苗發生脫落。四分孢子附著在完整無破損的四分孢子體表面時,四分孢子發育產生的配子體與四分孢子體在橫切面上觀察分界明顯,配子體的固著器隨著主枝的生長也不斷分裂生長,附著面積不斷擴大,覆蓋甚至包繞四分孢子體藻體,使得配子體較為牢固的附著在四分孢子體上,外觀形態上配子體與四分孢子體生長在同一藻枝上(圖10 a,b),顯微鏡下切片觀察,配子體的固著器包繞四分孢子體藻段一周(圖10 c,d),配子體和四分孢子體之間能區分出細胞界線(圖10 e~g);四分孢子附著在有破損的四分孢子體上時,配子體的細胞分裂生長,填充四分孢子體的破損傷口處,使得四分孢子體和配子體細胞嵌合生長在一起(圖10 h~j),也導致配子體和四分孢子體不同世代混雜。
4 討論
4.1 配子體生殖結構生長發育過程
雌雄配子體在性成熟前經過幼苗期后,進入毛細胞期,表皮層中的出現毛細胞并伴隨毛細胞的生長,毛結構的伸長,藻體快速生長。徒手切片連續觀察沒有發現雌雄配子體性成熟之前的差異,將藻體雌雄區分開來。雌雄性別的確定在雜交實驗中至關重要,所以新的技術手段仍需要開發。Zhou等[17]和Li等[20]的SCAR標記,借助分子手段鑒定雌雄配子體,對于早期配子體幼苗的篩選具有重要指導意義。
本研究首次在龍須菜中報道了毛細胞的存在。毛細胞在紅藻中普遍存在,超過4 000種紅藻有產毛細胞[21],Sjostedt[22]對Gracilariacompressa毛細胞發育和結構進行了描述,毛細胞起源表皮細胞,起初大小和形狀與表皮細胞無差別,隨后細胞變大,頂端產生小突起并伸長產生毛結構。Yamamoto[23]對G.Punctata(Okam) Yamada和G.arcuateZanard的描述的毛細胞成簇分布于藻體表面,從對龍須菜毛細胞觀察結果來看,龍須菜的毛細胞和毛結構的特征與上述描述物種中的毛細胞結構特征一致,但龍須菜中毛細胞分布并不廣泛。有關毛細胞產生的條件在其他物種中均有報道與季節[24]、光周期和N元素[25—26],本實驗也觀察到龍須菜的毛細胞并不總是存在,每次出現時藻體狀態良好,可能在最適合其生長的條件下才會出現,毛細胞的出現可能是為了短暫滿足藻體的營養和能量需求。但是關于毛細胞產生毛的作用目前尚無定論。
4.2 不同品系龍須菜四分孢子體四分孢子形成過程的生長發育過程
四分孢子的形成和釋放過程伴隨著藻體細胞形態的一系列變化,四分孢子母細胞來源于表皮層細胞,顏色鮮紅色,細胞生長體積增大,隨后發生2次減數分裂,在四分孢子囊內形成4個四分孢子,成熟后的四分孢子囊從藻體上脫離,四分孢子在藻體外釋放變形形成球形四分孢子。在四分孢子囊的生長發育過程中,髓部細胞中的紅藻淀粉顆粒呈現減少趨勢,說明四分孢子囊的生長發育消耗了部分紅藻淀粉,紅藻淀粉是在紅藻中是一種能源儲備物質。Wang等[15]對龍須菜四分孢子形成釋放階段的ATP含量測定結果顯示,藻體從四分孢子形成到釋放過程,ATP含量呈現下降趨勢,也說明四分孢子的放散過程是一個能量大量消耗的過程,與形態學上觀察到的紅藻淀粉顆粒減少呈現一定相關性。當藻受到鎘脅迫[27]或營養鹽N/P脅迫[28]影響時紅藻淀粉顆粒增多,也說明紅藻淀粉作為能源儲備物質應對外界環境脅迫,而四分孢子放散后紅藻淀粉顆粒明顯減少,同時表皮細胞中存在破損傷口,可以推測后續隨著藻體的傷口愈合髓部細胞中紅藻淀粉會重新積累。四分孢子在四分孢子囊中的分布呈十字形的很少,在一個視野平面上多數能看到3個細胞,說明第二次分裂的2個細胞分裂面并不都是重合的,2個分裂面存在一定角度。四分孢子的釋放在藻體外進行,四分孢子從四分孢子囊中逐個釋放出來并變形呈球形,釋放的過程能看到細胞質的流動,在四分孢子囊中形成的四分孢子原始細胞并沒有細胞壁,在釋放變成球形四分孢子后才開始形成新的細胞壁。而“981”龍須菜形成的四分孢子囊畸形個數較多,能觀察到較多變形、顏色異常、分裂異常的四分孢子囊,這些與野生型龍須菜和“魯龍1號”良種存在差異,高畸形率可能是除自身形成四分孢子數量少外,導致“981”龍須菜低育的一個原因。
4.3 龍須菜不同部位細胞特征及特殊細胞結構觀察
龍須菜藻體不同部位的細胞組成和細胞特征存在差異,固著器及接近固著器的基部表皮層細胞層數較多,髓部細胞從無到有,靠近基部的藻體內淀粉顆粒密度大,沿形態學上端方向,表皮層細胞層數減少,髓部細胞數量增多,體積增大,含有的淀粉顆粒密度減少;到藻尖部位,表皮層1層,髓部細胞體積數目又變少,紅藻淀粉含量很少,含有色素顆粒。
細胞連接(pit connection)在紅藻多個種屬[29—32]中均有發現,在超微結構上不同種屬上存在差異,超微結構下細胞連接處都含有蛋白質栓塞(pit plug)[33]。在光鏡下,通過染色等手段,觀察到龍須菜不同部位和不同層次細胞之間的細胞連接的特征,在連接數量和大小方面存在差異,總體上從表皮層到髓部細胞,細胞連接由小到大,數量由少到多,與細胞大小變化趨勢一致。細胞連接根據連接來源可以分為初級和次級紋孔連接[34],最外表皮層細胞與下層表皮層細胞之間的細胞連接為初級紋孔連接,由于細胞有絲分裂不完全,保留在2個子代細胞間;皮層和髓部細胞間的細胞連接眾多,而PAS染色和CBB染色結果顯示,連接處含有多糖和蛋白質組分。
放散出的四分孢子能附著在四分孢子體上,進行生長產生配子體幼苗,出現世代混雜的現象。配子體附著在四分孢子體上,固著器會不斷生長擴大附著面積甚至包繞四分孢子體母體藻段而牢固結合或通過四分孢子體上的傷口侵入四分孢子體內與四分孢子體的細胞嵌合在一起。相關文獻中有報道江蘺科藻類在孢子早期發育中會發生相鄰盤狀體或孢子早期發育中的黏連嵌合現象,真江蘺果孢子盤狀體在發育過程中黏連,真江蘺中果孢子和四分孢子在早期發育中會發生盤狀體黏連[35],江蘺中也存在盤狀體黏連嵌合現象[36—37],真紅藻亞綱中很多物種在孢子早期生長發育過程中產生嵌合現象[38—39],江蘺屬Gracilariatikvahiae,G.deblilis,G.gracilis中也發現四分孢子體和配子體的嵌合混生現象[40]。說明世代混雜在江蘺科中普遍存在,增加了遺傳的多樣性和復雜性。
總的來說,龍須菜配子體和孢子體在生長發育過程中在形態和細胞結構上存在相似性,而在產生生殖結構的過程中表現出明顯差異,雌雄配子體前期的生長沒有明顯差異。觀察到了四分孢子的形成放散的完整過程,不同品系龍須菜形成的四分孢子存在差異,其中“981”龍須菜有較為明顯的畸形現象,在細胞形態層面上說明了“981”龍須菜低育的原因。另外對龍須菜不同部位不同層次的細胞特征及細胞連接進行觀察,對龍須菜生長發育研究有了更加深入的認識。
[1] Lapointe B E, Ryther J H. Some aspects of the growth and yield ofGracilariatikvahiaein culture[J]. Aquaculture, 1978, 15(3): 185-193.
[2] McHugh D J. Worldwide distribution of commercial resources of seaweeds includingGelidium[J]. Hydrobiologia, 1991, 221(1): 19-29.
[3] Chopin T, Buschmann A H, Halling C, et al. Integrating seaweeds into marine aquaculture systems: a key toward sustainability[J]. Journal of Phycology, 2001, 37(6): 975-986.
[4] Lu Huiming, Xie Haihui, Gong Yingxue, et al. Secondary metabolites from the seaweedGracilarialemaneiformisand their allelopathic effects onSkeletonemacostatum[J]. Biochemical Systematics and Ecology, 2011, 39(4/6): 397-400.
[5] 余杰, 王欣, 陳美珍, 等. 潮汕沿海龍須菜的營養成分和多糖組成分析[J]. 食品科學, 2006, 27(1): 93-97.
Yu Jie, Wang Xin, Chen Meizhen, et al. Analysis on nutritional components and polysaccharide composition ofGracilarialemaneiformisfrom Chaoshan coast[J]. Food Science, 2006, 27(1): 93-97.
[6] Lu Huiming, Liao Xiaojian, Yang Yufeng, et al. Effects of extracts fromGracilarialemaneiformon microalgae[J]. Ecological Science, 2008, 27(5): 424-426.
[7] 徐永健, 錢魯閩, 焦念志. 江蘺作為富營養化指示生物及修復生物的氮營養特性[J]. 中國水產科學, 2004, 11(3): 276-280.
Xu Yongjian, Qian Lumin, Jiao Nianzhi. Nitrogen nutritional character ofGracilariaas bioindicators and restoral plants of eutrophication[J]. Journal of Fishery Sciences of China, 2004, 11(3): 276-280.
[8] 張學成, 費修綆, 王廣策, 等. 江蘺屬海藻龍須菜的基礎研究與大規模栽培[J]. 中國海洋大學學報:自然科學版, 2009, 39(5): 947-954.
Zhang Xuecheng, Fei Xiugeng, Wang Guangce, et al. Genetic studies and large scale cultivation ofGracilarialemaneiformis[J]. Periodical of Ocean University of China, 2009, 39(5): 947-954.
[9] 孟琳, 徐滌, 陳偉洲, 等. 龍須菜新品系07-2的篩選及性狀分析[J]. 中國海洋大學學報, 2009, 39(S1): 94-98.
Meng Lin, Xu Di, Chen Weizhou, et al. Selection and characterization of a new strain ofGracilarialemaneiformis[J]. Periodical of Ocean University of China, 2009, 39(S1): 94-98.
[10] 周偉, 隋正紅. 龍須菜“魯龍1號”[J]. 中國水產, 2016(3): 56-57.
Zhou Wei, Sui Zhenhong. The Cultivar “Lulong NO.1” ofGracilariopsislemaneiformis(Gracilariaceae, Rhodophyta)[J]. China Fisheries, 2016(3): 56-57.
[11] 張學成, 秦松, 馬家海, 等. 海藻遺傳學[M]. 北京: 中國農業出版社, 2005.
Zhang Xuecheng, Qin Song, Ma Jiahai, et al. The Genetic of Marine Algae[M]. Beijing: China Agriculture Press, 2005.
[12] Dawson E Y. Studies of northeast pacific gracilariaceae[J]. Allan Hancock Foundation Publications, Occasional Papers, 1949, 7: 1-105.
[13] Fredericq S, Hommersand M H. Comparative morphology and taxonomic status ofGracilariopsis(Gracilariales, Rhodophyta)[J]. Journal of Phycology, 1989, 25(2): 228-241.
[14] Xu Di, Zhu Jianyi, He Yang, et al. Structure of reproductive apparatus ofGracilaria/Gracilariopsislemaneiformis(Gracilariaceae, Rhodophyta)[J]. Science in China Series C: Life Sciences, 2008, 51(12): 1137-1143.
[15] Wang Jinguo, Sui Zhenghong, Hu Yiyi, et al. Assessment of photosynthetic performance, carboxylase activities, and ATP content during tetrasporic development inGracilariopsislemaneiformis(Gracilariaceae, Rhodophyta)[J]. Journal of Applied Phycology, 2016, 28(5): 2939-2952.
[16] Ye Naihai, Wang Hongxia, Wang Guangce. Formation and early development of tetraspores ofGracilarialemaneiformis(Gracilaria, Gracilariaceae) under laboratory conditions[J]. Aquaculture, 2006, 254(1/4): 219-226.
[17] Zhou Wei, Ding Hongye, Sui Zhenghong, et al. Development of a SCAR marker for male gametophyte ofGracilariopsislemaneiformisbased on AFLP technique[J]. Chinese Journal of Oceanology and Limnology, 2014, 32(3): 522-526.
[18] Rover T, Simioni C, Hable W, et al. Ultrastructural and structural characterization of zygotes and embryos during development inSargassumcymosum(Phaeophyceae, Fucales)[J]. Protoplasma, 2015, 252(2): 505-518.
[19] Dring D M. A periodic Acid-Schiff technique for staining fungi in higher plants[J]. New Phytologist, 1955, 54(2): 277-279.
[20] Huan Li, He Linwen, Zhang Baoyu, et al. AFLP and SCAR markers associated with the sex inGracilarialemaneiformis(Rhodophyta)[J]. Journal of Phycology, 2013, 49(4): 728-732.
[21] Kraft G T, Woelkerling W J. Rhodophyta[M]//Clayton M N, King R J. Biology of Marine Plants. Melbourne: Longman Cheshire, 1990: 41-85.
[22] Sj?stedt L G. Floridean Studies[M]. Otto Harrassowitz: CWK Gleerup, 1926.
[23] Yamamoto H. Systematic and anatomical study of the genusGracilariain Japan[J]. Memoirs of the Faculty of Fisheries, Hokkaido University, 1978, 25(2): 97-152.
[24] Dixon P S. Biology of the Rhodophyta[M]. Edinburgh: Olivier and Bold, 1973: 285.
[25] Rueness J, Mathisen H A, Tananger T. Culture and field observations onGracilariaverrucosa(Huds.) Papenf. (Rhodophyta) from Norway[J]. Botanica Marina, 1987, 30(3): 267-276.
[26] O′connor K A, West J A. The effect of light and nutrient conditions on hair formation inSpyridiafilamentosa(Wulfen) Harvey (Rhodophyta)[J]. Botanica Marina, 1991, 34(4): 359-364.
[27] dos Santos R W, Schmidt é C, Bouzon Z L. Changes in ultrastructure and cytochemistry of the agarophyteGracilariadomingensis(Rhodophyta, Gracilariales) treated with cadmium[J]. Protoplasma, 2013, 250(1): 297-305.
[28] Yu Jiang, Yang Yufeng. Physiological and biochemical response of seaweedGracilarialemaneiformisto concentration changes of N and P[J]. Journal of Experimental Marine Biology and Ecology, 2008, 367(2): 142-148.
[29] Lee R E. The pit connections of some lower red algae: ultrastructure and phylogenetic significance[J]. British Phycological Journal, 1971, 6(1): 29-38.
[30] Ramus J. Pit connection formation in the red algaPseudogloiophloea[J]. Journal of Phycology, 1969, 5(1): 57-63.
[31] Wetherbee R, Quirk H M. The fine structure of secondary pit connection formation between the red algal alloparasiteHolmsellaaustralisand its red algal hostGracilariafurcellata[J]. Protoplasma, 1982, 110(3): 166-176.
[32] Bourne V L, Conway E, Cole K. On the ultrastructure of pit connections in the conchocelis phase of the red algaPorphyraperforataJ. Ag[J]. Phycologia, 1970, 9(1): 79-81.
[33] 王素娟, 裴魯青, 段德麟. 中國常見紅藻超微結構[M]. 寧波: 寧波出版社, 2004: 138-158.
Wang Sujuan, Pei Luqing, Duan Delin. Ultrastructure of Common Red Seaweeds in China[M]. Ningbo: Ningbo Press, 2004: 138-158.
[34] 許璞, 張學成, 王素娟, 等. 中國主要經濟海藻的繁殖與發育[M]. 北京: 中國農業出版社, 2013: 85-90.
Xu Pu, Zhang Xucheng, Wang Sujuan, et al. Reproduction and Development of Major Economic Marine Algae in China[M]. Beijing: China Agriculture Press, 2013: 85-90.
[35] Jones W E. Effect of spore coalescence on the early development ofGracilariaverrucosa(Hudson) papenfuss[J]. Nature, 1956, 178(4530): 426-427.
[37] Santelices B, Correa J A, Aedo D, et al. Convergent biological processes in coalescing Rhodophyta[J]. Journal of Phycology, 1999, 35(6): 1127-1149.
[38] Santelices B, Aedo D, Varela D. Causes and implications of intra-clonal variation inGracilariachilensis(Rhodophyta)[J]. Journal of Applied Phycology, 1995, 7(3): 283-290.
[39] Santelices B, Correa J A, Meneses I, et al. Sporeling coalescence and intraclonal variation inGracilariachilensis(Gracilariales, Rhodophyta)[J]. Journal of Phycology, 1996, 32(2): 313-322.
[40] Kain J M, Destombe C. A review of the life history, reproduction and phenology ofGracilaria[J]. Journal of Applied Phycology, 1995, 7(3): 269-281.
Microscopic observation of the reproductive development of gametophyte and tetrasporohyte ofGracilariopsislemaneiformis(Rhodophyta)
Mi Ping1, Sui Zhenghong1, Que Zhou1, Zhou Wei1, Shang Erlei1
(1.TheKeyLaboratoryofMarineGeneticsandBreeding,OceanUniversityofChina,MinistryofEducation,Qingdao266003,China)
A series of cell morphology and structure changes were displayed during the development of reproductive structure of gametophyte and tetrasporaphyte ofGracilariopsislemaneiformis. In this study, the gametophyte and different strains of tetrasporophyte were used to make continuous free hand section, in order to observe the development of the gametophyte and the formation of tetraspores in different strains ofG.lemaneiformis. The result showed that the development of male and female gametophytes undertook seedling phage (SP), hair cell phage (HCP) and sexual mature phage (SMP). There was no significant difference between male and female gametophyte in SP and HCP. The male and female gametophyte were differentiable after entering SMP when the reproductive apparatus formed. The tetraspores were derived from the epidermal cells of tetrasprophyte, the initial tetrasporogonium was scarlet, and 5-10 μm in diameter. It later grew to 20-25 μm in diameter and became mature. The mature tetrasporogonium divided into four initial tetraspores gathered together, and then the tetraspores were released out of the matrix and became globular. During the development of tetraspores, the density of floridean starch granules decreased in medullary part. Cultivar 981 formed more deformed tetraspores, which may be one of the reasons leading to the low fertility of cultivar 981. The layers of epidermal cells, the numbers and the volume of medullary cells changed continuously from the basal to the tip part. Pit connections existed wildly in the epidermal, cortical and medullary cells, however varying by size, numbers and length between different layers. The released tetraspores were observed attaching on the tetrasporophyte, and the holdfast grew to cover the tetrasporophyte or invaded into the wound tissue of tetrasporophyte, which may cause gametophyte and tetrasporophyte generation promiscuous and lead to the genetic complexity ofG.lemaneiformis.
Gracilariopsislemaneiformis; gametophyte; tetrasporophyte; reproductive apparatus; microscopic observation
10.3969/j.issn.0253-4193.2017.08.010Mi Ping, Sui Zhenghong, Que Zhou,et al. Microscopic observation of the reproductive development of gametophyte and tetrasporohyte ofGracilariopsislemaneiformis(Rhodophyta) [J]. Haiyang Xuebao,2017,39(8):99—114, doi:10.3969/j.issn.0253-4193.2017.08.010
2016-10-28;
2017-02-24。
國家自然科學基金(31372529);鰲山科技創新計劃課題(2015ASKJ02);中國博士后科學基金項目(2016M590662)。
米萍(1992—),女,山東省臨沂市人,主要研究藻類遺傳育種與發育。E-mail:miping10@163.com
*通信作者:隋正紅,教授,主要從事大型紅藻的遺傳育種與基因組研究。E-mail:suizhengh@ouc.edu.cn
S917.3
A
0253-4193(2017)08-0099-16
米萍,隋正紅,闕州,等. 龍須菜配子體發育和不同品系四分孢子體四分孢子形成過程顯微結構觀察[J].海洋學報,2017,39(8):99—114,

