接骨草總黃酮提取工藝及其抑菌作用的研究
黃國文,管天球,趙雨云,陳莫林,劉宏輝
(湖南科技學(xué)院生化系,湖南永州 425199)
?
接骨草總黃酮提取工藝及其抑菌作用的研究
黃國文,管天球,趙雨云,陳莫林,劉宏輝
(湖南科技學(xué)院生化系,湖南永州 425199)
以堿溶酸沉法研究接骨草總黃酮的提取條件和抑菌作用。以料液比、溫度、時間、提取液pH為影響因素,進行單因素實驗和正交實驗,研究提取接骨草總黃酮的最優(yōu)條件,調(diào)節(jié)提取液pH來沉淀總黃酮,并用比濁法和濾紙圓片法研究總黃酮的抑菌作用。結(jié)果表明,提取接骨草總黃酮的最優(yōu)條件是料液比1∶40 (g/mL)、溫度為80 ℃、時間為45 min、提取液pH10,此條件下接骨草總黃酮的得率為3.11%。調(diào)節(jié)總黃酮提取液pH3.5沉淀接骨草總黃酮的量較多,其得率為2.15%。接骨草總黃酮在酸性pH4~5時對金黃色葡萄球菌、枯草芽孢桿菌和大腸桿菌的抑制作用較強,并能夠增加三種細菌的電導(dǎo)率,對三種菌最小抑菌濃度分別為0.63、1.25、2.50 mg/mL。用堿溶酸沉法提取接骨草總黃酮的工藝簡單,總黃酮具有較高的抑菌活性,為進一步開發(fā)接骨草的總黃酮打下了基礎(chǔ)。
接骨草,總黃酮,提取工藝,抑菌作用
接骨草(SambucuschinensisLindl)為忍冬科接骨木屬多年生草本或半灌木植物[1],產(chǎn)于陜西、河南、湖南、貴州、云南等省區(qū)的路旁和林緣等地。莖無毛有棱;葉片無柄,橢圓形;雌雄異株,花期4~5月,果熟期8~9月。全草藥用,有活血散瘀、祛風(fēng)濕功效,能治療風(fēng)濕痹痛、腎炎、腳氣、慢性氣管炎、跌打損傷、骨折等疾病[2]。接骨草含有很多生物活性物質(zhì),已經(jīng)分離出黃酮類、三萜、甾體、酚酸、揮發(fā)油和苯丙素類等50多個化合物,其中,黃酮類主要以黃酮醇為主,具有由兩個羥基的苯環(huán)通過中央三個碳原子連接而成的母核,母核上羥基的氫原子可以被不同糖苷中的半縮醛羥基取代生成不同的黃酮苷[3]。植物中黃酮類化合物的含量與植物的木質(zhì)化程度有關(guān),存在于微管植物中[4],特別在植物的葉和花等器官中含量較高[5-6],黃酮類化合物具有保護心血管系統(tǒng)[7]、抗氧化[8]、抗菌[9-10]、抗病毒、抗腫瘤、殺蟲等作用[11-12],是保健食品的一種活性成分[13]。接骨草可以用于外敷、內(nèi)服,炮制的接骨草藥茶含有較多的黃酮類物質(zhì)[14]。接骨草黃酮的抗氧化作用已有報道[15],其抗菌作用報道較少,因此,有必要研究接骨草總黃酮提取及其抑菌作用。黃酮類化合物的提取方法有熱水提取、有機溶劑提取、堿溶酸沉、超聲波輔助提取、半仿生法、酶解、超臨界CO2萃取法等[16-17]。目前報道,用80%乙醇提取的接骨草成分含有槲皮素為苷元的黃酮醇,總黃酮含量為41.43 mg/g[18];用超聲輔助50%乙醇提取接骨草黃酮,其得率為8.352 mg/g[15]。與有機溶劑浸提和超聲輔助浸提法相比,堿溶酸沉法提取黃酮類物質(zhì)的得率低,但是具有設(shè)備簡單、操作方便、無環(huán)境污染、不使用有機溶劑、生產(chǎn)成本低廉等優(yōu)點[19-21]。本文采用堿溶酸沉法研究接骨草總黃酮的提取條件,并研究其對大腸桿菌、枯草芽孢桿菌和金黃色葡萄球菌的抑菌作用,為開發(fā)和利用接骨草總黃酮打下基礎(chǔ)。
1 材料與方法
1.1 材料與儀器
在湖南科技學(xué)院周圍的西山林緣于2015年11月份采集接骨草地上部分,在100 ℃殺青后烘干粉碎成粉末。按1∶8 (g/mL)比例加入石油醚,80 ℃回流60 min,過濾除去脂溶性成分,取干燥后的濾雜來提取總黃酮。供試菌種(大腸桿菌Escherichiacoli、金黃色葡萄球菌Staphylococcusaureus、枯草芽孢桿菌Bacillussubtilis) 由湖南科技學(xué)院微生物實驗室提供。試劑:蘆丁,瓊脂粉,蛋白胨,牛肉膏,氯化鈉,硝酸鋁,亞硝酸鈉,氫氧化鈉等均為分析純 均購于國藥集團。
HH三用恒溫水箱 江蘇國盛實驗儀器廠;TG16G型離心機 上海趙迪生物科技有限公司;DHG-9070AS型新型電熱恒溫鼓風(fēng)干燥箱 寧波江南儀器廠;AUY120型電子分析天平 日本島津;H722B可見分光光度計 天津市拓普儀器有限公司;DDS-11A上海雷磁電導(dǎo)率儀 上海右一儀器有限公司。
1.2 實驗方法
1.2.1 提取接骨草總黃酮條件的研究
1.2.1.1 提取接骨草總黃酮的單因素實驗 以堿性pH溶液(用10% NaOH調(diào)節(jié)成的水溶液)為溶劑用浸提法來提取接骨草總黃酮,固定提取條件:提取時間60 min,溫度60 ℃,料液比1∶40 (g/mL)和浸提pH10。改變因素料液比為1∶10、1∶20、1∶30、1∶40、1∶50 (g/mL),提取液pH8、9、10、11、12,溫度為60、70、80、90、100 ℃,時間為30、45、60、75、90 min。將各條件下提取的總黃酮溶液離心(6000 r/min,10 min),取上清液測定總黃酮含量。對四次生物學(xué)重復(fù)實驗結(jié)果作圖分析,并用SPSS軟件進行方差分析和LSD法進行多重比較,確定各因素的適合水平。
1.2.1.2 正交實驗 根據(jù)單因素實驗結(jié)果,設(shè)計正交因素水平表(表1),通過L9(34)正交表安排實驗,對結(jié)果進行極差分析和方差分析,優(yōu)化總黃酮的提取條件。
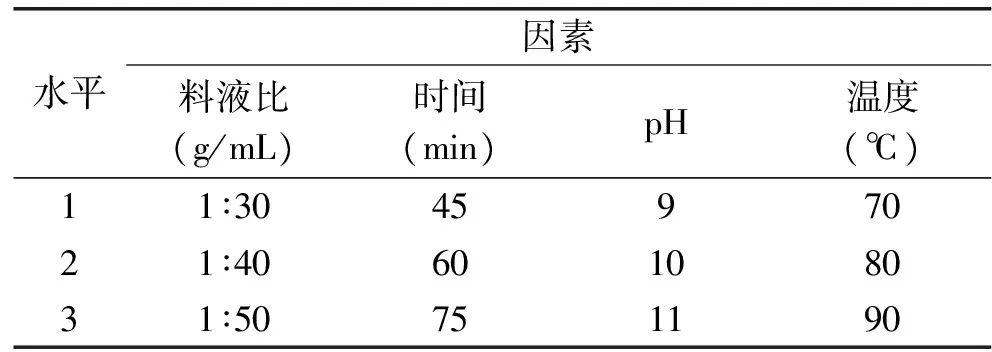
表1 提取接骨草總黃酮的正交實驗設(shè)計表Table 1 Orthogonal experiment design of the extraction of total flavonoids of Sambucus chinensis Lindl
1.2.2 pH沉淀總黃酮 準(zhǔn)確稱取5份烘干后的接骨草粉末各10.0 g,脫脂后按照最佳提取條件提取總黃酮。待材料浸出液冷卻后,離心(6000 r/min,10 min)收集上清液。分別緩慢滴加濃鹽酸調(diào)pH為2、3、4、5,靜置過夜,離心(3500 r/min,15 min),收集沉淀,沉淀物用乙醚洗滌2次后再用蒸餾水洗滌2次,60 ℃干燥后稱量其總黃酮質(zhì)量,計算其得率。

1.2.3 制作蘆丁標(biāo)準(zhǔn)曲線 用30%乙醇配制0.10 mg/mL[22]的蘆丁標(biāo)準(zhǔn)溶液100 mL。在6個10 mL容量瓶中分別加入蘆丁標(biāo)準(zhǔn)溶液0、0.1、0.2、0.3、0.4、0.5 mL。各加入0.3 mL 5%亞硝酸鈉溶液,搖勻后放置6 min,加入0.3 mL10%硝酸鋁溶液,搖勻后放置6 min,加入4.0 mL 4%氫氧化鈉溶液,再用30%乙醇定容,搖勻后放置10 min。以沒有加入蘆丁標(biāo)準(zhǔn)溶液的混合溶液為空白參比,在波長400~600 nm之間測定各樣品的吸收光譜,確定最大吸收波長為510 nm[23]。經(jīng)過實驗,蘆丁標(biāo)準(zhǔn)曲線為Y=0.119X-0.0182,R2=0.9994,式中Y為吸光度,X為蘆丁的質(zhì)量濃度(mg/mL)。
1.2.4 總黃酮含量測定方法 根據(jù)蘆丁的標(biāo)準(zhǔn)曲線測定方法測定接骨草提取液的總黃酮濃度,再計算黃酮的得率。總黃酮的得率=(CV/103W)×100%,式中:W為接骨草干粉的質(zhì)量(g),C為提取液的濃度(mg/mL),V為提取液的體積(mL)。其值表示生物學(xué)重復(fù)樣品三次測定的平均值±SD。
1.2.5 菌懸液的制備方法 在超凈工作臺中,在牛肉膏蛋白胨固體培養(yǎng)基上,對大腸桿菌、金黃色葡萄球菌、枯草芽孢桿菌等細菌分別劃線培養(yǎng)(37 ℃,24 h),用接種環(huán)挑取一個菌落接種到液體培養(yǎng)基中,37 ℃振蕩培養(yǎng)(200 r/min,24 h)。菌液用無菌水稀釋到吸光度為0.6~0.8時,用于抑菌研究。
1.2.6 不同濃度的接骨草總黃酮對三種菌的抑制作用 用濾紙圓片法。將最佳提取條件和最優(yōu)pH沉淀條件下制備的接骨草總黃酮用蒸餾水溶解,配制成濃度為0.31、0.63、1.25、2.5、5.0、10 mg/mL的溶液,浸泡濾紙圓片(直徑6 mm)1 h。在牛肉膏蛋白胨固體培養(yǎng)基上加入200 μL菌懸液,用涂布棒涂勻菌液并干燥。用無菌鑷子夾取濾紙圓片貼在含菌培養(yǎng)基表面,每個培養(yǎng)皿上放置3個處理濾紙片和1個水處理的濾紙圓片(陰性對照),置于37 ℃下培養(yǎng)24 h,測量抑菌圈直徑。
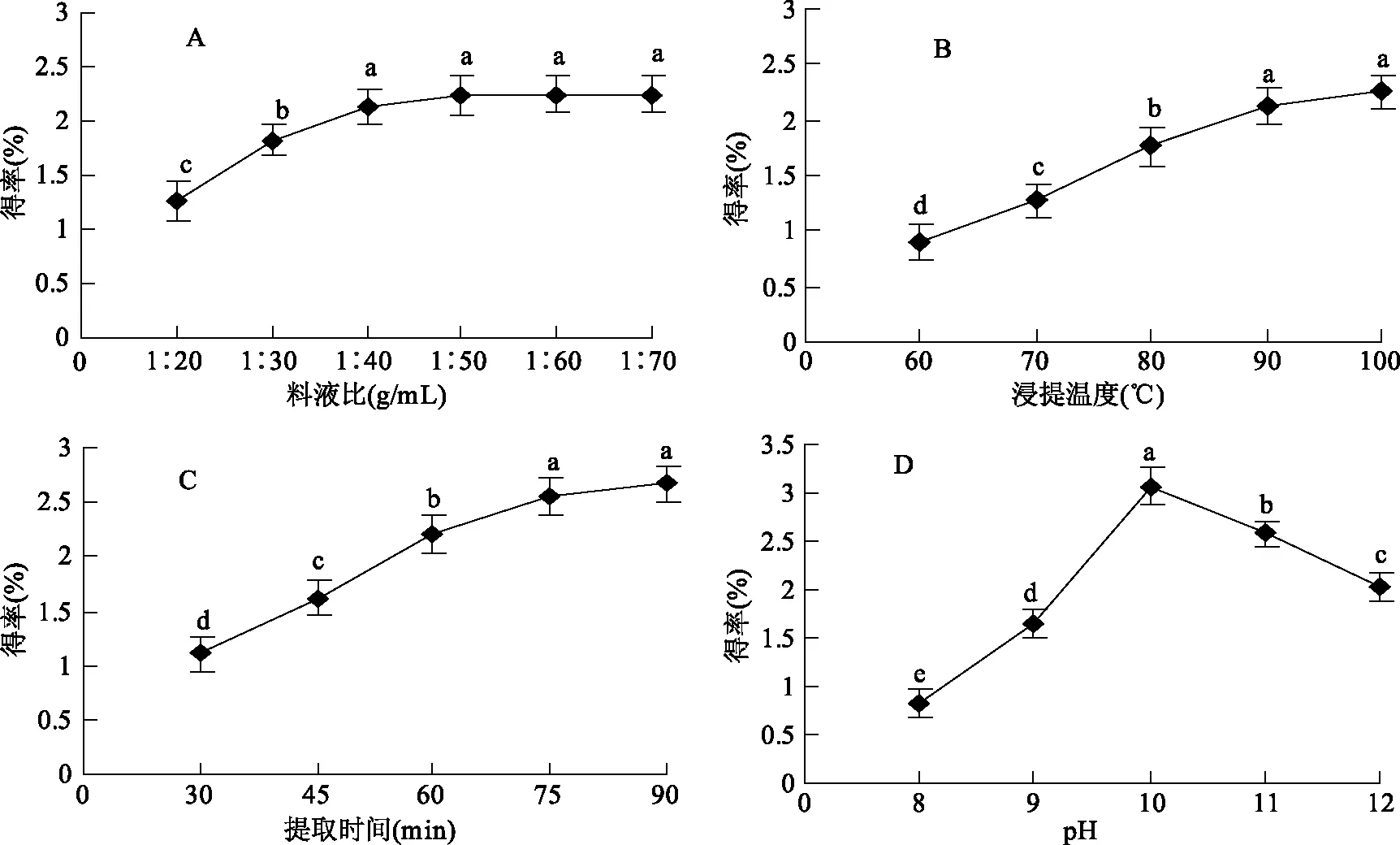
圖1 提取條件對接骨草總黃酮得率的影響Fig.1 Effects of extracting conditions on the extracting rate of total flavonoids of Sambucus chinensis Lindl注:不同字母表示差異顯著(p<0.05)。
1.2.7 不同作用時間的接骨草總黃酮對三種菌抑制作用 用比濁法。在無菌狀態(tài)下,向5 mL的牛肉膏蛋白胨液體培養(yǎng)基里加入菌懸液200 μL,并加入一定濃度的接骨草總黃酮。于37 ℃搖床里振蕩培養(yǎng)(200 r/min),以培養(yǎng)液作為對照,在600 nm下測定細菌懸液的吸光度(A)。每個菌設(shè)定3個生物學(xué)重復(fù),每培養(yǎng)2 h測定各個重復(fù)樣品3次,求平均值,計算抑菌率,計算公式如下:
抑菌率(%)=(菌懸液的吸光度-含有總黃酮的菌懸液的吸光度)/菌懸液的吸光度×100
1.2.8 不同pH接骨草總黃酮對三種菌抑制作用 用濾紙圓片法。稱取一定量的接骨草總黃酮5份,分別加入到用0.1 mol/L HCl和0.1 mol/L NaOH配制成的pH為4、5、6、7、8的溶液中,配成總黃酮質(zhì)量體積濃度10%(g/mL),混勻。將濾紙圓片浸泡到總黃酮溶液中1 h,取出瀝干后貼在含菌培養(yǎng)基表面,每個培養(yǎng)皿上放置3個濾紙片,置于37 ℃培養(yǎng)24 h,測量抑菌圈直徑。
1.2.9 電導(dǎo)率的測定 取18只大試管,分別加入5 mL牛肉膏蛋白胨培養(yǎng)基和200 μL OD600為0.6~0.8的三種細菌培養(yǎng)物以及10%總黃酮提取物。其中三個試管只加入蒸餾水代替總黃酮作為對照組。將試管放在200 r/min,37 ℃條件下振蕩培養(yǎng)0、1、2、3、4、5 h。分別測定培養(yǎng)液的電導(dǎo)率值,從電導(dǎo)率變化趨勢來說明菌膜的完整性。
2 結(jié)果與分析
2.1 接骨草總黃酮的提取條件
2.1.1 料液比對接骨草總黃酮得率的影響 料液比對總黃酮得率有顯著影響(圖1A),隨著料液比的增加,接骨草總黃酮的得率逐漸增加,當(dāng)料液比達到1∶40 (g/mL)以后,總黃酮得率增加較少。可能原因是一定體積的溶劑能夠增加死細胞內(nèi)的蛋白質(zhì)和多糖等物質(zhì)的溶脹作用,引起細胞膜的通透性增加或者膜破裂,從而溶解并釋放出接骨草總黃酮,再增加溶劑的體積總黃酮量也很難增加。方差分析結(jié)果表明料液比對總黃酮得率有重要影響,選擇1∶30、1∶40、1∶50 (g/mL)料液比作為優(yōu)化條件。
2.1.2 提取溫度對接骨草總黃酮得率的影響 提取溫度明顯影響總黃酮得率(圖1B),隨著溫度增高總黃酮得率逐漸增高,但90 ℃之后得率增加相對不多,表明在一定的溫度范圍內(nèi),較高溫度能夠疏松或破碎細胞壁而使黃酮容易滲出;過高的溫度(100 ℃)雖然會破壞更多的細胞壁和滲出更多黃酮,但是也引起溶劑蒸發(fā)和破壞黃酮結(jié)構(gòu),導(dǎo)致總黃酮增加不多,并且增加了耗能。方差分析結(jié)果表明,提取溫度對總黃酮得率有重要影響,選擇70、80、90 ℃作為優(yōu)化條件。
2.1.3 提取時間對接骨草總黃酮得率的影響 提取時間對總黃酮的得率有明顯影響(圖1C),隨提取時間增加,接骨草總黃酮得率逐漸增高,但75 min之后,黃酮得率的增加量不明顯,可能是大部分總黃酮已經(jīng)完全溶解。另外,提取的時間越長,提出的雜質(zhì)就越多[24],也不利于后續(xù)分離純化。方差分析結(jié)果表明,提取時間對總黃酮得率有重要影響,選擇45、60、75 min作為優(yōu)化條件。
2.1.4 pH對接骨草總黃酮得率的影響 提取液pH對總黃酮得率有較大影響(圖1D)。在pH10.0時提取效果最好,在pH10.0之前隨著pH增大得率相應(yīng)提高,但在pH10.0之后隨著pH增大得率反而逐漸降低。說明過高pH可能引起黃酮結(jié)構(gòu)的破壞,導(dǎo)致得率下降[25]。方差分析結(jié)果表明,pH對總黃酮得率有重要影響,選擇pH為9、10、11作為優(yōu)化條件。
2.1.5 提取接骨草總黃酮的正交實驗 根據(jù)單因素實驗結(jié)果,選擇料液比、浸提溫度、浸提時間和浸提液pH這四個因素,以正交表為(L9(34))安排實驗。結(jié)果見表2和表3。
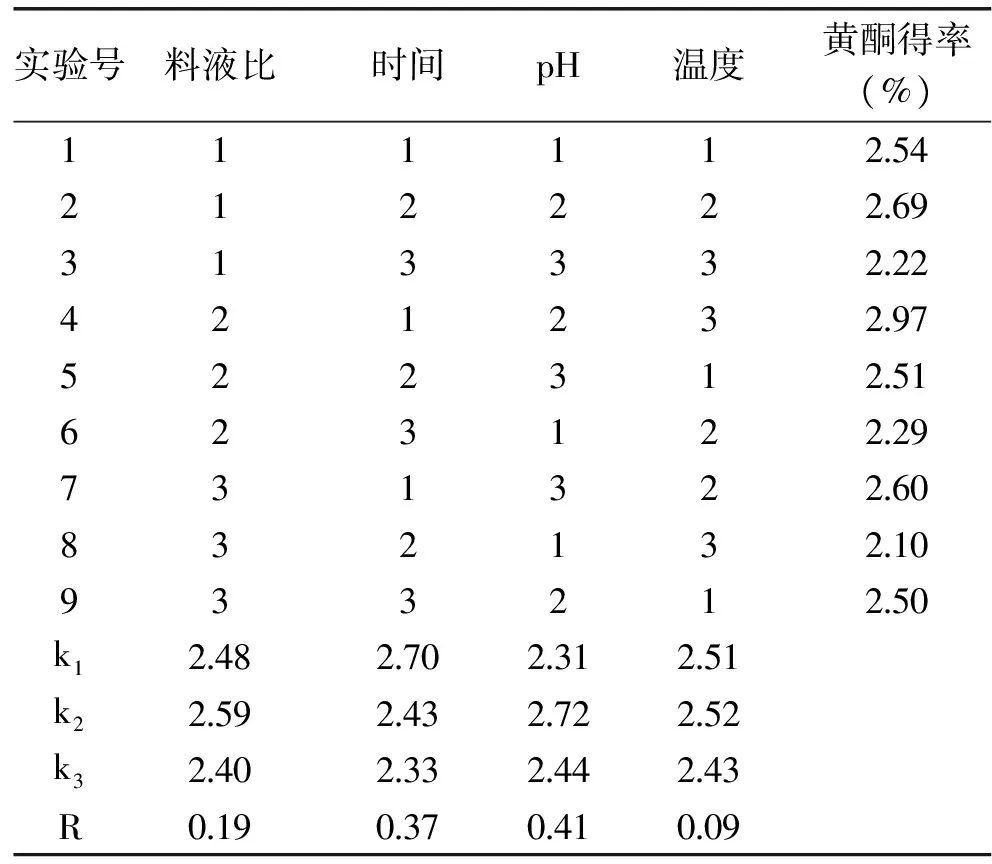
表2 提取接骨草總黃酮的正交實驗結(jié)果和極差分析Table 2 L9(34)experimental results and analysis of extracting total flavonoids of Sambucus chinensis Lindl
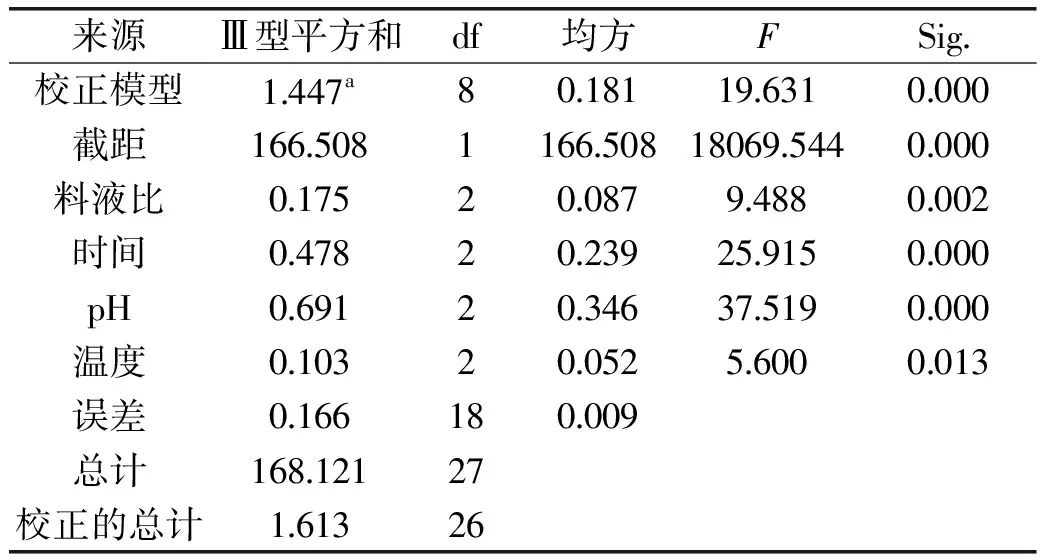
表3 提取接骨草總黃酮的正交實驗結(jié)果方差分析表Table 3 Mean standard deviation analysis of L9(34)experimental results of extracting total flavonoids of Sambucus chinensis Lindl
注:a.R2=0.897(調(diào)整R2=0.851)。
分析接骨草總黃酮的提取結(jié)果(表2和表3),影響提取接骨草總黃酮的因素順序為浸提液pH>提取時間>料液比>提取溫度,表明提取液pH是影響接骨草總黃酮提取的主要因素。提取接骨草總黃酮的最佳條件是浸提液pH10,提取時間為45 min,料液比為1∶40 (g/mL)、提取溫度為80 ℃。
2.2 驗證結(jié)果
稱取接骨草粉末20.0 g三份,按照總黃酮的最佳提取條件提取黃酮,分別測定總黃酮含量,計算總黃酮得率的平均值為3.11%。
2.3 酸沉pH對接骨草總黃酮得率的影響
以提取總黃酮的最佳工藝條件提取脫脂后(可以去除脂溶性物質(zhì)如色素和磷脂等)接骨草粉末中的總黃酮,提取液經(jīng)過用濃鹽酸調(diào)酸性pH來沉淀總黃酮,測定酸性pH沉淀接骨草總黃酮的得率(圖2)。結(jié)果表明,在調(diào)節(jié)成pH3.5的溶液中沉淀的總黃酮含量較大。此后,調(diào)節(jié)的pH越大,沉淀的黃酮含量越少。說明不同類型的黃酮化合物在酸性過強的溶液中生成烊鹽而析出[26]。用酸沉pH3.5溶液來沉淀接骨草總黃酮,其得率2.15%。比較最佳提取條件下提取的總黃酮得率3.11%,pH3.5溶液來沉淀接骨草總黃酮得率少,說明提取液中還有部分黃酮沒有成鹽析出。

圖2 酸性pH對接骨草總黃酮得率的影響Fig.2 Effects of pH on extracting rate of total flavonoids of Sambucus chinensis Lindl
2.4 接骨草總黃酮的抑菌作用
2.4.1 不同濃度接骨草總黃酮對三種細菌生長的影響 以pH3.5沉淀提取液得到的總黃酮,用無菌水溶解,配制成濃度為0.31、0.63、1.25、2.5、5.0、10 mg/mL的溶液,檢測其抑菌作用(圖3)。表明,隨著濃度的增大,接骨草總黃酮對這三種細菌的抑制作用逐漸增強;對照組無抑菌作用。根據(jù)抑菌圈明顯大于6 mm有抑菌性,接骨草總黃酮對金黃色葡萄球菌的抑制作用最強,最小抑菌濃度約為0.63 mg/mL;對枯草芽孢桿菌的抑制作用較強,最小抑菌濃度約為1.25 mg/mL;對大腸桿菌的抑制作用較弱,最小抑菌濃度約為2.5 mg/mL。因此,接骨草總黃酮對革蘭氏陽性菌枯草芽孢桿菌和金黃色葡萄球菌的抑菌作用較強,對革蘭氏陰性菌大腸桿菌的抑菌作用較弱。可能是與這兩種菌的細胞壁不同有關(guān)。革蘭氏陽性菌的細胞壁主要是由肽聚糖和磷壁酸組成的,結(jié)構(gòu)簡單;而革蘭氏陰性細菌的細胞壁除了含有少量肽聚糖以外,還含有蛋白質(zhì)、類脂質(zhì)、脂多糖等成分,使得陽性菌對理化因子的敏感性強于陰性菌[27]。

圖3 不同濃度接骨草總黃酮對三種菌抑制作用Fig.3 Inhibition of different concentrations of total flavonoids of Sambucus chinensis Lindl on the three bacteria fruit
2.4.2 不同作用時間接骨草總黃酮對三種細菌生長的影響 在液體培養(yǎng)基中加入10%接骨草總黃酮來培養(yǎng)細菌以研究對三種菌的抑制作用。結(jié)果表明,隨著培養(yǎng)時間的增長,接骨草總黃酮對三種菌的抑制作用逐漸增強,并且抑菌強弱為金黃色葡萄球菌>枯草芽孢桿菌>大腸桿菌,在處理10 h以后對金黃色葡萄球菌的抑菌率達到100%(圖4)。由于黃酮類物質(zhì)通過抑制細菌細胞壁和細胞膜的合成、抑制細菌的能量代謝和核酸合成起作用[10],這種作用不是瞬時就可以完成,因此隨著作用時間延長抑菌率逐漸增加。
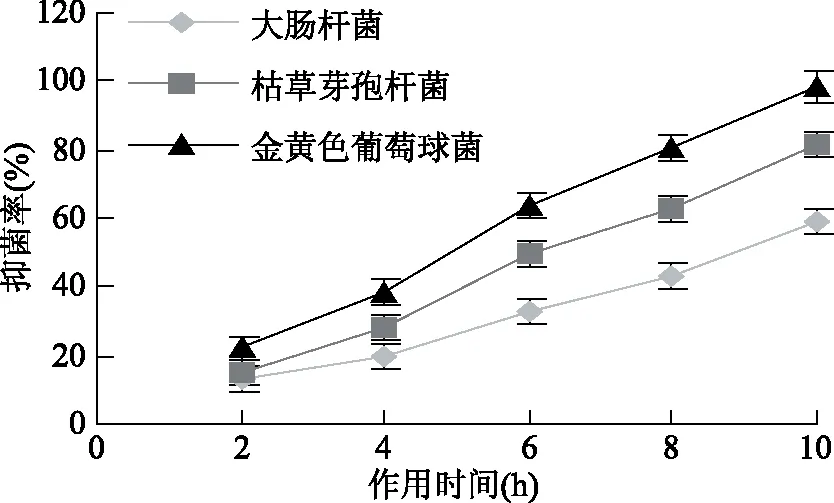
圖4 接骨草總黃酮不同處理時間對三種菌的抑制作用Fig.4 Inhibiton of total flavonoids of Sambucus chinensis Lindl of diffrent incubation times on the three bacteria
2.4.3 不同pH接骨草總黃酮溶液對三種細菌的抑制作用 測定不同pH的10%接骨草總黃酮溶液對三種菌的抑制作用(圖5)。結(jié)果表明,在pH4~5時接骨草總黃酮對這三種菌都有較強抑制作用,在pH6以后抑菌作用大幅度降低,在pH8時抑菌作用很弱了。可能是由于大多數(shù)黃酮化合物含有酚羥基呈酸性,在酸性溶液中結(jié)構(gòu)穩(wěn)定,在強堿性條件下可能會破壞其母核[28],因而降低了其抑菌活性。

圖5 不同pH接骨草總黃酮對三種菌的抑制作用Fig.5 Inhibition of total flavonoids of Sambucus chinensis Lindl of different pH on the three bacteria
2.4.4 接骨草總黃酮對三種細菌細胞膜通透性的影響 為了檢測接骨草總黃酮處理條件下細菌細胞膜的完整性,用10%的接骨草總黃酮提取物培養(yǎng)三種菌一段時間測量其電導(dǎo)率。表明,隨著培養(yǎng)時間的延長,三種菌液的電導(dǎo)率都增加(圖6)。結(jié)果說明,接骨草總黃酮破壞了三種菌的細胞膜,導(dǎo)致細菌細胞質(zhì)的電解質(zhì)外滲,破壞細胞結(jié)構(gòu),從而產(chǎn)生了抑菌作用[29]。與對照相比,在培養(yǎng)5 h時,菌液的電導(dǎo)率以金黃色葡萄球菌的增加的幅度最多,而大腸桿菌培養(yǎng)液的電導(dǎo)率增加的最少,枯草芽孢桿菌的電導(dǎo)率增加的幅度居中。因此,接骨草總黃酮對菌膜的傷害作用以金黃色葡萄球菌的最強,枯草芽孢桿菌次之,大腸桿菌的最差。
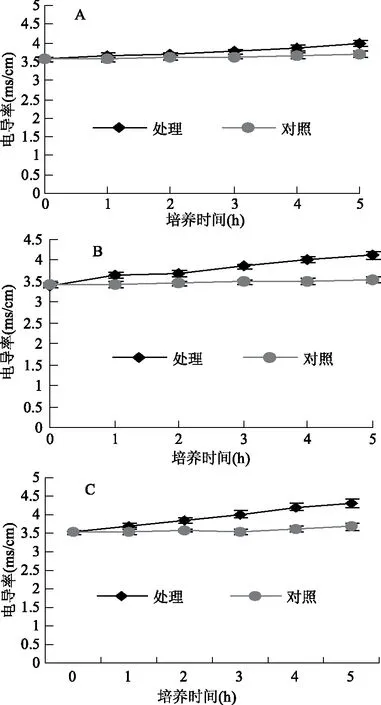
圖6 接骨草總黃酮對三種菌電導(dǎo)率的影響Fig.6 Effects of total flavonoids of Sambucus chinensis Lindl on the electrical conductivity of the three bacteria注:A:大腸桿菌;B:枯草芽孢桿菌;C:金黃色葡萄球菌。
3 結(jié)論
本文用堿溶酸沉法研究了接骨草總黃酮的提取條件,確定了堿提工藝的最優(yōu)條件為浸提液pH10,提取時間45 min,料液比1∶40 (g/mL)、溫度為80 ℃;在這種條件下接骨草總黃酮的得率為3.11%。最優(yōu)提取工藝條件下的接骨草總黃酮提取液經(jīng)過用濃鹽酸調(diào)節(jié)pH3.5時能夠沉淀2.15%的總黃酮。用堿溶酸沉法提取的接骨草總黃酮抑制金黃色葡萄球菌作用最強、抑制枯草芽孢桿菌的作用較強、抑制大腸桿菌的作用較弱,其最小抑菌濃度分別是0.63、1.25、2.50 mg/mL。接骨草總黃酮對這三種菌的抑制作用隨著處理時間(0~10 h)的延長逐漸增強,在處理時間為10 h時對金黃色葡萄球菌的抑菌率可以達到100%,同時引起三種菌的電導(dǎo)率增加。接骨草總黃酮在酸性pH時對這三種菌都有抑制作用,且在pH4~5時抑制作用強,在堿性pH8時抑制作用很弱。由于接骨草總黃酮具抑菌作用,所以,接骨草總黃酮用于食品的保鮮防腐有待于研究。這種研究為進一步開發(fā)和利用接骨草總黃酮提供了積極的指導(dǎo)作用。
[1]馬養(yǎng)民,吳昊.接骨木屬植物的化學(xué)成分研究進展[J].有機化學(xué),2012,32:2063-2072.
[2]方建新.接骨草的開發(fā)利用[J].中國林副特產(chǎn),2007(6):85-86.
[3]姚元枝,伍賢進,黎曉英,等.接骨草的化學(xué)成分與藥理活性研究進展[J].中成藥,2015,37(12):2726-2732.
[4]王長遠,吳洪奎,于長青,等.黃酮類化合物研究進展[J]. 黑龍江八一農(nóng)墾大學(xué)學(xué)報,2007,19(2):75-78.
[5]朱文振,馬龍,李國榮.黃酮類化合物的抗癌作用及作用機制[J].生命科學(xué),2012,24(5):444-449.
[6]何佳珂,于洋,陳西敬,等.黃酮類化合物的藥物代謝研究進展[J].中國中藥雜志,2010,35(21):2789-2794.
[7]胡彥武,劉凱,閆夢彤,等.淫羊藿總黃酮及淫羊藿苷的心血管保護作用及機制研究進展[J].中國實驗方劑學(xué)雜志,2015(13):227-230.
[8]Wang LJ,Yang XS,Qin PY,et al. Flavonoid composition,antibacterial and antioxidant properties of tartary buckwheat bran extract[J].Industrial Crops and Products,2013,49:312-317.
[9]鄧紅梅,馬超. 皇帝柑皮中粗黃酮的提取及其抑菌活性研究[J]. 食品工業(yè),2013(1):21-24.
[10]柯春林,任茂生,王娣,等.黃酮化合物抗菌機理的研究進展[J].食品工業(yè)科技,2015,36(2):388-391.
[11]魏良柱,李筱玲.黃酮類化合物藥理活性研究進展[J].陜西農(nóng)業(yè)科學(xué),2014,60(12):52-56.
[12]Kumar S,Pandey AK. Chemistry and biological activities of flavonoids:an overview[J].Science World Journal,2013. doi:10.1155/2013/162750.
[13]耿敬章,馮君琪.黃酮類化合物的生理功能與應(yīng)用研究[J]. 中國食物與營養(yǎng),2007(7):62-65.
[14]熊燕,姚元枝,安曉剛,等.接骨草藥茶的炮制及黃酮類化合物含量的比較[J].中國民族醫(yī)藥雜志,2013(9):53-55.
[15]李偉.接骨草黃酮類物質(zhì)超聲提取工藝優(yōu)化及其抗氧化活性[J].中藥材,2011,34(11):1789-1791.
[16]劉寧,朱沛沛,李嘉樂.黃酮類化合物提取工藝研究進展[J].飲料工業(yè),2012,15(7):7-9.
[17]Pan GY,Yu GY,Zhu CH,et al.Optimization of ultrasound-assisted extraction(UAE)of flavonoids compounds(FC)from hawthorn seed(HS)[J]. Ultrasonics Sonochemistry,2012,19:486-490.
[18]蔡凌云.接骨草黃酮成分的初步研究[J]. 凱里學(xué)院學(xué)報,2010,28(6):62-64.
[19]陳繼光,米麗雪,上官新晨,等.青錢柳愈傷組織總黃酮堿溶酸沉提取工藝[J].食品科學(xué),2011,32(16):103-107.
[20]田哲榕,侯先槐.干豌豆中皂苷與黃酮類化合物含量研究[J].忻州師范學(xué)院學(xué)報,2011,27(2):128-130.
[21]Li XN,Huang JL,Wang ZD,et al.Alkaline extraction and acid precipitation of phenolic compounds from longan(Dimocarpus longan L.)seeds[J]. Separation and Purification Technology,2014,124:201-205.
[22]趙洪,楊穎,黎李.堿溶液提取竹葉總黃酮工藝的初步研究[J].山東化工,2015,44:58-59,62.
[23]唐紅軍.中國藥典2000年版一部檢測蘆丁含量方法的改進[J].中國醫(yī)院藥學(xué)雜志,2002,22(1):60.
[24]趙文紅,范青生,馬永花,等.杜仲葉中總黃酮的醇提工藝[J].南昌大學(xué)學(xué)報(理科版),2007,31(1):69-72.
[25]張雁,池建偉,張名位,等.新鮮葛根中總黃酮和淀粉的提取工藝研究[J].中國食品學(xué)報,2008,8(3):73-77.
[26]盛玉青,侍海嬌,鄧曉亞,等. 大孔吸附樹脂純化鳳尾草總黃酮工藝研究[J].現(xiàn)代中藥研究與實踐,2014,28(6):52-55.
[27]鄭津輝,王威,黃輝.苦參提取液中黃酮類化合物的抑菌作用[J].武漢大學(xué)學(xué)報(理學(xué)版),2008,54(4):439-442.
[28]許明,韓亮,李艷琴,等.苦蕎黃酮類化合物的穩(wěn)定性研究[J].食品與藥品,2012(9):305-308.
[29]陳國妮,孫飛龍,閆亞茹,等.馬齒莧黃酮類化合物抑菌機理的研究[J].化學(xué)與生物工程,2015,32(10):34-37.
Study on the extraction and antibacterial effect oftotal flavonoids fromSambucuschinensisLindl
HUANG Guo-wen,GUAN Tian-qiu,ZHAO Yu-yun,CHEN Mo-lin,LIU Hong-hui
(Department of Biological Sciences and Chemical Engineerings,Hunan College ofScience and Technology,Yongzhou 425199,China)
By using alkali soluble and acid sinking method,total flavonoids ofSambucuschinensisLindlwere extracted,and its antibacterial effect were studied in this paper. The extraction conditions including solid-liquid ratio,extraction temperature,extraction time,pH of xetraction liquid of flavonoids fromSambucuschinensisLindlwere optimized by single factor experiments and orthogonal experiments,and meanwhile the sinking efficiency of total flavonoids were studied by acidic pH precipitation,and the antibacterial activity of total flavonoids was studied by filter paper discs method and turbidimetric method. The results showed that the optimum extraction conditions of total flavonoids ofSambucuschinensisLindlwere as follow:solid-liquid ratio 1∶40 (g/mL),extraction temperature 80 ℃,extraction time 45 min,extraction liquid pH10,in which the extraction rate of total flavonoids ofSambucuschinensisLindlwas 3.11%. Adapting the extract to pH3.5 with HCl could better precipitate about 2.15% total flavonoids ofSambucuschinensisLindl. Total flavonoids ofSambucuschinensisLindlhad a stronger antibacterial activity onStaphylococcusaureus,Bacillussubtilis,Escherichiacoliat acidic pH4~5 than at neutral pH and alkaline pH value,and these bacteria conductivity was increased by total flavonoids. The minimum inhibitory concentration of total flavonoids ofSambucuschinensisLindlon three bacteria were 0.63,1.25,2.50 mg/mL,respectively. The extracting process of total flavonoids fromSambucuschinensisLindlby using alkali soluble and acid sinking method was simple and inexpensive,and its total flavonoids had a great antibacterial activity,in which played a foundation on the development and utilization of total flavonoids ofSambucuschinensisLindl.
SambucuschinensisLindl;flavonoids;extraction process;antibacterial effect
2016-12-29
黃國文(1965-),男,博士,講師,從事植物生物學(xué)的教學(xué)和研究工作,E-mail:huanggwdax@163.com。
湖南省科技計劃項目(2014NK2021);湘南優(yōu)勢植物資源綜合利用湖南省重點實驗室資助項目(XNZW15C19)。
TS201.3
A
1002-0306(2017)13-0036-06
10.13386/j.issn1002-0306.2017.13.007

