響應面優化鹽析法姬松茸多糖脫蛋白研究
吳 春,孫 寧,劉 寧,黎晨晨,李 健
(哈爾濱商業大學食品工程學院 黑龍江省高校食品科學與工程重點實驗室,黑龍江哈爾濱 150076)
?
響應面優化鹽析法姬松茸多糖脫蛋白研究
吳 春,孫 寧,劉 寧,黎晨晨,李 健*
(哈爾濱商業大學食品工程學院 黑龍江省高校食品科學與工程重點實驗室,黑龍江哈爾濱 150076)
目的:探討鹽析法對姬松茸多糖脫蛋白的最佳工藝。方法:采用鹽析法對姬松茸多糖脫蛋白,探討在磁力攪拌器的影響下,其鹽析溫度、鹽析轉數、鹽析時間及硫酸銨粉末飽和度對蛋白脫除率和多糖回收率的影響,以單因素實驗為基礎,通過響應曲面分析確定最佳工藝。結果:各因素對姬松茸多糖蛋白脫除率和多糖回收率的影響由大到小依次為:鹽析溫度>鹽析轉數>鹽析時間。最佳工藝為:鹽析溫度為51 ℃,鹽析轉數為660 r/min,鹽析時間為31 min,硫酸銨粉末飽和度為20%時,蛋白脫除率和多糖回收率分別為80.29%和79.59%。結論:鹽析法可安全便捷、快速有效地脫除姬松茸多糖中的蛋白,同時能夠得到較高的蛋白脫除率和多糖回收率。
鹽析法,姬松茸多糖,脫蛋白條件,響應面分析
姬松茸又叫巴西蘑菇,是一種珍貴的藥食兼用真菌[1],其子實體中含有多種具有高抗腫瘤活性和刺激T細胞作用的多糖[2-5]。目前姬松茸多糖提取方法有:溶劑法、酶法、超聲波法、微波法、超濾技術等。如梁婷等[6],唐小俊等[7],張艷榮等[8]采用微波法提取姬松茸多糖。付志英[9]等采用超聲波技術提取姬松茸多糖。聶志勇[10]采用酶解法提取姬松茸多糖。李峰[11]利用復合酶法提取姬松茸多糖。王艷[12]等應用超聲波協同復合酶法提取姬松茸多糖。彭勇勝[13]等采用熱水提取法提取姬松茸多糖。沈愛英[14]等采用水提醇沉法提取姬松茸多糖。丁重陽[15]等采用堿提法提取姬松茸多糖。韓永萍等[16]應用超濾技術提取姬松茸多糖。但提取的粗多糖中往往混雜著蛋白質,粗多糖進行脫蛋白提純以后,其生物活性更高[17]。常用的脫除蛋白質方法有TCA法[18],Sevage法,鹽酸法,三氯乙酸法,三氟三氯乙烷法,酶解法等[19-21]。Sevage法是實驗室經典的脫蛋白方法,條件較溫和,但煩瑣、費時,有機試劑用量大,并且破壞多糖結構,多糖損失較大。另外在生產過程中,分液后,多糖溶液中還殘留有有機溶劑,有機溶劑毒性較大,需蒸發除去[22]。鹽酸法脫蛋白的效果雖然較好,但若實驗條件不能嚴格控制,不但多糖的損失率會高,而且存在多糖水解缺點[23]。三氯乙酸法除蛋白質隨著三氯乙酸濃度增大,除蛋白質效果越好,但對多糖結構的影響也越大,可能是酸性溶液中,多糖鏈可能被三氯乙酸降解[24]。三氟三氯乙烷法除蛋白質的效果較好,但溶劑沸點較低、易揮發,因此很難大量應用到實驗中[25]。酶解法可以將糖鏈上蛋白質水解,提高蛋白質脫除率,但如果加酶量控制不當,反而會引入外源蛋白,而且實驗成本較高[26]。
本研究選擇鹽析法,為姬松茸多糖脫蛋白提供一種新的參考方法。鹽析法根據不同蛋白質在一定濃度鹽溶液中沉淀程度不同而到達彼此分離。鹽析一般是指溶液中加入無機鹽類來改變溶解物的溶解度,而使溶解的物質析出的過程。如:加硫酸銨粉末使蛋白質凝聚的過程。蛋白質隨著鹽濃度的變大,溶解度會隨之升高,這個過程是鹽溶。但當鹽濃度達到一定數值時,其溶解度又會逐漸下降,直至蛋白質沉淀析出,這個過程是鹽析。鹽析的發生在于鹽濃度增高到一定數值時,導致水活度降低,進而使蛋白質分子表面電荷逐漸被中和,蛋白質表面水化膜逐漸被破壞,使蛋白質相互結合聚集形成沉淀析出[27]。
1 材料與方法
1.1 材料與儀器
姬松茸粗多糖提取液 實驗室制備;牛血清白蛋白、考馬斯亮藍G250 分析純,上海國藥集團化學試劑廠;磷酸 分析純,天津市耀華化學試劑有限責任公司;乙醇 分析純,天津市永大化學試劑有限公司;硫酸銨 分析純;天津市科密歐化學試劑有限公司;蒸餾水。
電子天平FA2004 上海越平科學儀器有限公司;DF-101S集熱式恒溫加熱磁力攪拌器 鞏義市予華儀器有限責任公司;紫外可見分光光度計5100B 上海元析儀器有限公司;循環水式多用真空泵SHB-Ⅲ 鄭州長城科工貿有限公司;臺式離心機TDL-4A 上海菲恰爾分析儀器有限公司;電熱鼓風干燥箱DHG-9123A 上海一恒科技有限公司。
1.2 實驗方法
1.2.1 姬松茸多糖純化的工藝流程 姬松茸粗多糖提取液→磁力攪拌器攪拌→加入硫酸銨粉末至設定飽和度→冷卻至室溫后離心去沉淀(4000 r/min,20 min)→抽濾→收集濾液→含量測定。
1.2.2 含量測定
1.2.2.1 蛋白質含量測定——考馬斯亮藍法 參考文獻[28]的方法,測得595 nm下的吸光度值(Y)對牛血清白蛋白含量(X,單位:μg)作線性回歸,得測定蛋白質含量標準曲線的回歸方程:Y=0.0072X+0.0157,R2=0.9984,由此可知橫縱坐標在一定范圍內線性相關且相關性顯著。姬松茸多糖蛋白脫除率如式(1)所示[30]。
蛋白脫除率(%)=(溶液初始蛋白含量(μg)-脫蛋白后蛋白含量(μg))/溶液初始蛋白含量(μg)×100
式(1)
1.2.2.2 多糖含量測定——苯酚硫酸法 參考文獻[29]的方法,測得吸光度值(Y)對葡萄糖標準溶液的濃度(X,單位:mg/mL)作線性回歸,得測定總糖含量的標準曲線回歸方程:
Y=12.38X+0.0296,R2=0.9990,由此可知橫縱坐標在一定范圍內線性相關且相關性顯著。姬松茸多糖回收率如式(2)所示[30]。
多糖含量(mg)=單位體積多糖的量(mg)×提取多糖體積(mL)×稀釋倍數

式(2)
1.2.3 單因素實驗
1.2.3.1 硫酸銨粉末飽和度對脫除姬松茸多糖中蛋白的影響 量取姬松茸多糖提取液20 mL置于燒杯中,放在磁力攪拌器上邊攪拌邊慢慢加入硫酸銨粉末至設定飽和度分別為10%、20%、30%、40%、50%、60%、70%,轉數650 r/min,溫度50 ℃,攪拌30 min。冷卻至室溫后離心去沉淀(4000 r/min,20 min),收集濾液最后用1.2.2的方法測姬松茸多糖脫蛋白率。
1.2.3.2 鹽析轉數對脫除姬松茸多糖中蛋白的影響 量取姬松茸多糖提取液20 mL置于燒杯中,放在磁力攪拌器上邊攪拌邊慢慢加入硫酸銨粉末至設定飽和度20%,轉數分別為430、540、650、760、870、980、1080 r/min,溫度50 ℃,攪拌30 min。冷卻至室溫后離心去沉淀(4000 r/min,20 min),收集濾液最后用1.2.2的方法測姬松茸多糖脫蛋白率。
1.2.3.3 鹽析溫度對脫除姬松茸多糖中蛋白的影響 量取姬松茸多糖提取液20 mL置于燒杯中,放在磁力攪拌器上邊攪拌邊慢慢加入硫酸銨粉末至設定飽和度20%,轉數650 r/min,溫度分別為20、30、40、50、60、70、80 ℃,攪拌30 min。冷卻至室溫后離心去沉淀(4000 r/min,20 min),收集濾液最后用1.2.2的方法測姬松茸多糖脫蛋白率。
1.2.3.4 鹽析時間對脫除姬松茸多糖中蛋白的影響 量取姬松茸多糖提取液20 mL置于燒杯中,放在磁力攪拌器上邊攪拌邊慢慢加入硫酸銨粉末至設定飽和度20%,轉數650 r/min,溫度50 ℃,攪拌時間分別為10、20、30、40、50、60、70 min。冷卻至室溫后離心去沉淀(4000 r/min,20 min),收集濾液最后用1.2.2的方法測姬松茸多糖脫蛋白率。
1.2.4 鹽析法純化姬松茸多糖的工藝優化實驗 進行響應面優化實驗時,選取鹽析溫度(因素A)、鹽析轉數(因素B)、鹽析時間(因素C)3個為蛋白脫除率和多糖回收率的因素。采用Design Expert 8.0.6軟件進行3因素3水平的設計。
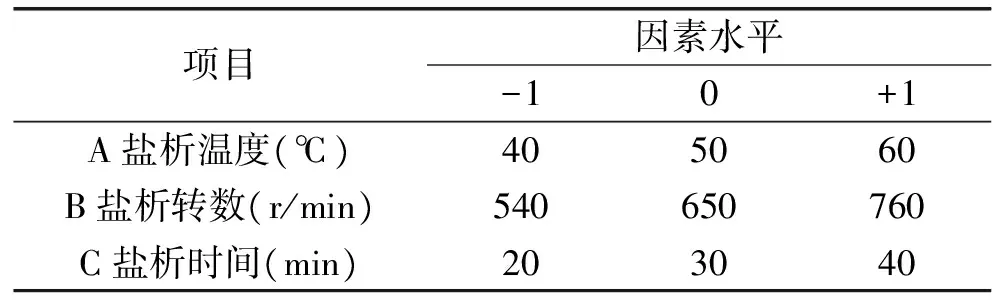
表1 鹽析法純化姬松茸多糖因素水平Table 1 Neuter salt method of purification ofAgaricus blazei murill polysaccharides reference factors and levels
1.3 數據統計分析
本實驗采用Excel軟件做圖分析單因素影響,并在數據圖上顯示誤差線Y推斷顯著性標準。采用設計專家軟件(Design-Expert 8.0.6,簡稱DE 8.0.6)對所得數據進行分析,確定最佳脫蛋白工藝。
2 結果與分析
2.1 單因素實驗
2.1.1 硫酸銨粉末飽和度對脫除姬松茸多糖中蛋白的影響 如圖1所示,多糖的回收率持續下降,硫酸銨粉末飽和度為20%時多糖蛋白脫除率有顯著影響。硫酸銨粉末用量少時,由于鹽的濃度低,蛋白質無法沉淀完全,因而,在一定程度上,多糖蛋白脫除率隨著硫酸銨用量的增加而升高。當硫酸銨粉末飽和度大于20%時,鹽的濃度過高,所得沉淀多為蛋白酸銨,反而不利于蛋白質的沉淀。同時硫酸銨用量過大時,也會增加后續脫鹽難度,造成硫酸銨和脫鹽液的浪費,增加實驗成本,同時多糖損失顯著。綜上選擇20%為后續實驗硫酸銨粉末飽和度,但在響應面實驗中不對其進行優化分析[31]。
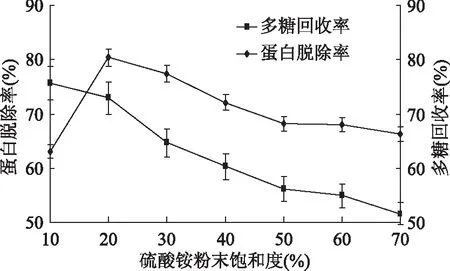
圖1 硫酸銨粉末飽和度對蛋白脫除率和多糖回收率的影響Fig.1 Effect of saturation of ammonium sulfate powder on protein removal rate and polysaccharide recovery rate
2.1.2 鹽析轉數對脫除姬松茸多糖中蛋白的影響 如圖2所示,多糖的回收率持續下降,鹽析轉數為650 r/min時對多糖蛋白脫除率最高。這可能是因為隨著轉數的增加,易使蛋白質析出,但過高的鹽析轉數會導致環境不穩定性增強,析出的部分蛋白質沉淀溶解,從而影響多糖蛋白脫除率,同時多糖損失。因而,鹽析轉數為650 r/min時多糖蛋白脫除率最高。
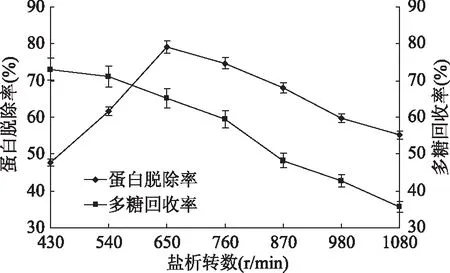
圖2 鹽析轉數對蛋白脫除率和多糖回收率的影響Fig.2 Effects of revolution of salting-out on protein removal rate and polysaccharide recovery rate
2.1.3 鹽析溫度對脫除姬松茸多糖中蛋白的影響 如圖3所示,脫蛋白溫度對多糖含量的影響較小,鹽析溫度為50 ℃時對多糖蛋白脫除率有顯著影響。這可能是因為鹽析時,溫度過低,蛋白質沉淀速率慢,并且沉淀不完全,故多糖蛋白脫除率低。溫度過高時,高溫會導致部分蛋白質沉淀溶解,甚至破壞蛋白質結構,降低多糖蛋白脫除率。因而,鹽析溫度為50 ℃時多糖蛋白脫除率最高[32]。

圖3 鹽析溫度對蛋白脫除率和多糖回收率的影響Fig.3 Effects of temperature of salting-out on protein removal rate and polysaccharide recovery rate
2.1.4 鹽析時間對脫除姬松茸多糖中蛋白的影響 如圖4所示,多糖的回收率持續下降,特別是攪拌時間超過40 min后,多糖回收率急劇下降,鹽析時間為30 min時對多糖蛋白脫除率有顯著影響。這可能是因為鹽析時,鹽析時間過長,蛋白質沉淀可能會發生部分溶解,從而降低多糖脫蛋白率。而攪拌時間過短時,由于一部分蛋白質來不及沉淀,導致鹽析作用不完全,使多糖蛋白脫除率低。因而,鹽析時間為30 min時多糖蛋白脫除率最高[33]。
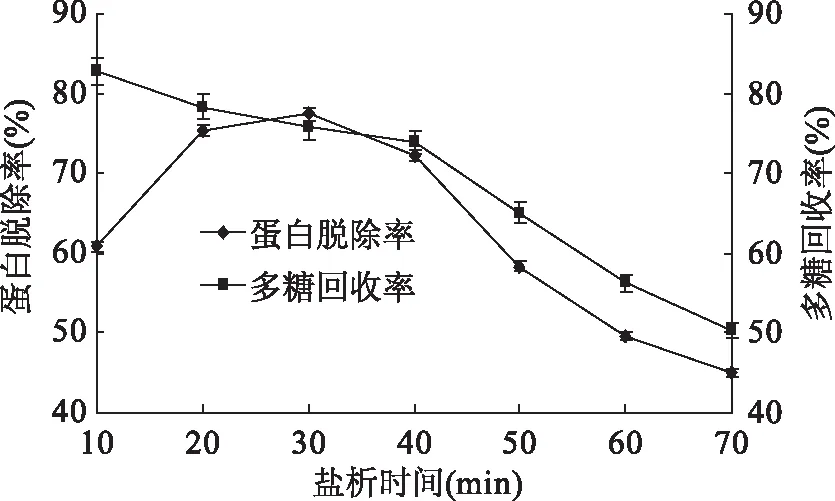
圖4 鹽析時間對蛋白脫除率和多糖回收率的影響Fig.4 Effects of time of salting-out on protein removal rate and polysaccharide recovery rate
2.2 響應曲面優化實驗
2.2.1 回歸模型的建立及統計檢驗 回歸模型的建立及統計檢驗見表2,采用設計專家軟件(Design-Expert 8.0.6,簡稱DE 8.0.6)對所得數據進行分析,結果見表3。
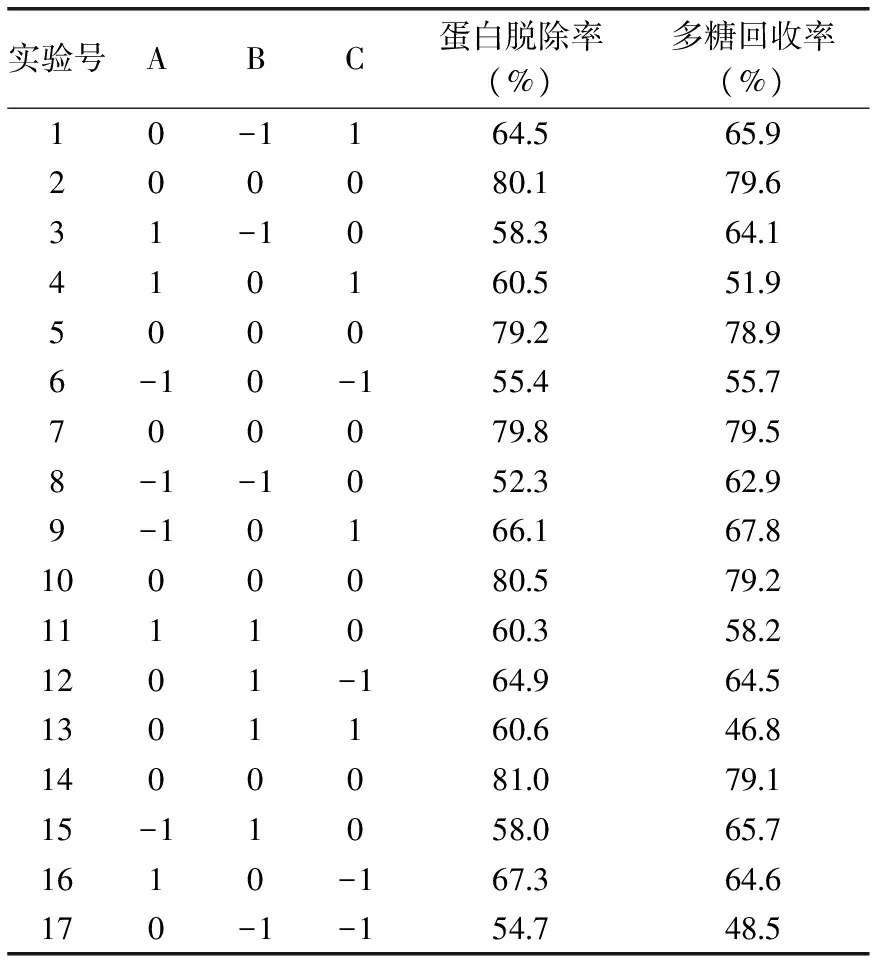
表2 鹽析法純化姬松茸多糖響應面分析實驗結果Table 2 Neuter salt method of purification ofAgaricus blazei murill polysaccharides reference response and the analysis of experimental
以蛋白脫除率為響應值,各因素經回歸擬合后,得回歸方程:Y1(蛋白脫除率,%)=80.12+1.83A+1.75B+1.17C-0.93AB-4.38AC-3.52BC-10.87A2-12.02B2-6.92C2。
表3為蛋白脫除率回歸模型方差分析結果,從中可以看出該模型回歸顯著(p<0.0001),R2=0.9982,失擬項不顯著,說明該模型與實際實驗擬合程度較好,可用上述回歸方程描述各因子與響應值的關系,以多糖回收率為響應值,各因素經回歸擬合后,得回歸方程:Y2(多糖回收率,%)=79.26+1.66A+0.77B+0.11C-2.18AB-6.20AC-8.78BC-6.48A2-10.05B2-12.78C2。
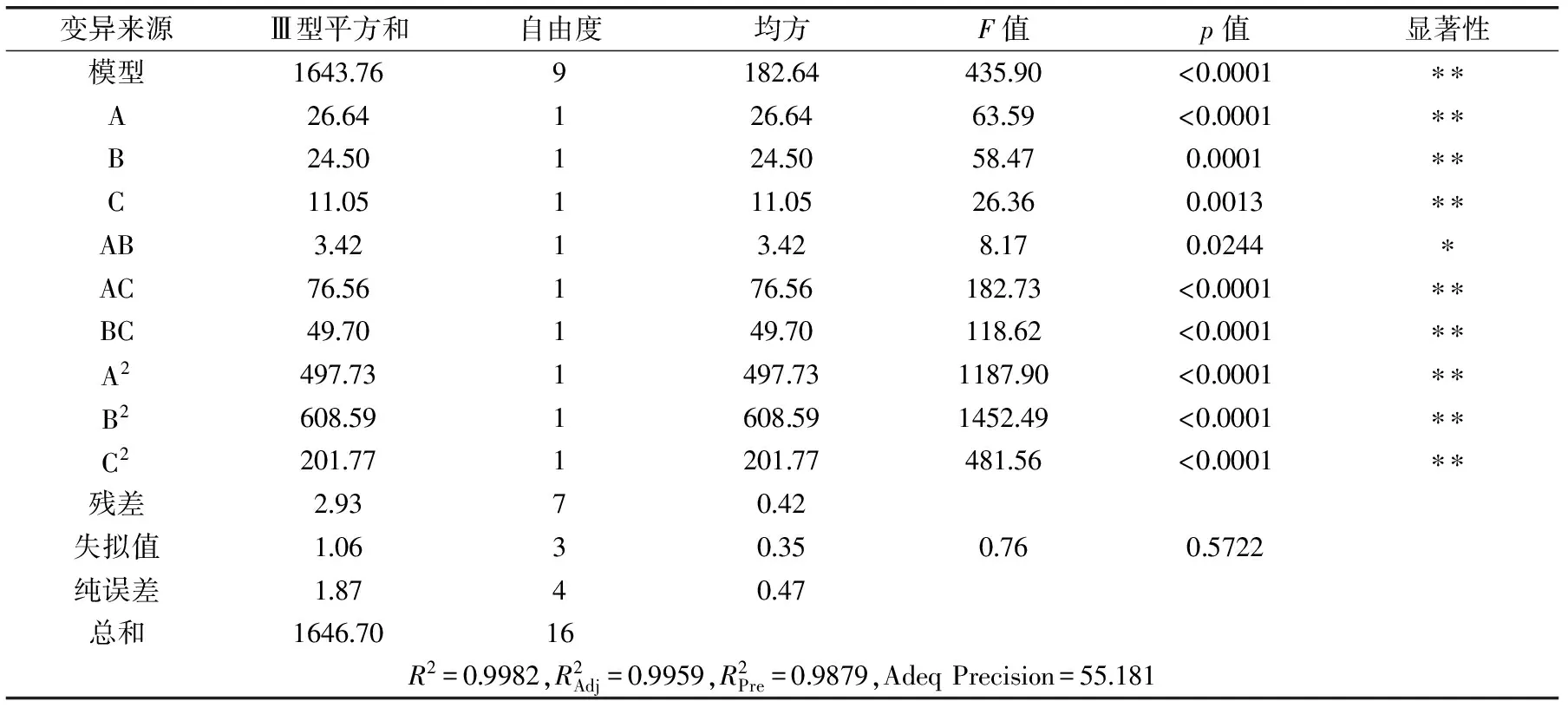
表3 蛋白脫除率回歸模型方差分析結果Table 3 Protein removal rate of the regression model of variance analysis results
注:**代表p<0.01,極顯著;*代表p<0.05,顯著。對鹽析法脫蛋白工藝進行預測。各項的p值(A:<0.0001、B:0.0001、C:0.0013)可以說明鹽析溫度、鹽析轉數、鹽析時間對蛋白脫除率影響顯著。從各項的F值(A:63.59、B:58.47、C:26.36)可以看出,在所選的各因素水平范圍內,對姬松茸多糖蛋白脫除率影響大小的順序為:鹽析溫度>鹽析轉數>鹽析時間。
表4為多糖回收率回歸模型方差分析結果,從中可以看出該模型回歸顯著(p<0.0001),R2=0.9998,失擬項不顯著,說明該模型與實際實驗擬合程度較好,可用上述回歸方程描述各因子與響應值的關系,對鹽析法脫蛋白工藝進行預測。各項的p值(A:<0.0001、B:<0.0001、C:0.2272)可以說明鹽析溫度、鹽析轉數對多糖回收率影響顯著。從各項的F值(A:382.64、B:83.15、C:1.75)可以看出,在所選的各因素水平范圍內,對姬松茸多糖回收率影響大小的順序為:鹽析溫度>鹽析轉數>鹽析時間。
2.2.2 鹽析法純化姬松茸多糖各因素間的交互作用 從圖5A可看出,從圖形的弧面看出鹽析溫度對蛋白脫除率的影響比鹽析轉數的影響明顯,且兩因素間存在較強的相互作用。從圖5B可看出,鹽析溫度對蛋白脫除率的影響大于鹽析時間,且兩因素之間存在較強的相互作用。從圖5C可看出鹽析轉數對蛋白脫除率的影響高于鹽析時間,且兩因素間存在較強的相互作用。從圖5D可看出,從圖形的弧面看出鹽析溫度對多糖回收率的影響比鹽析轉數明顯,且兩因素間存在一定的相互作用。從圖5E可看出,鹽析溫度對蛋白脫除率的影響大于鹽析時間,且兩因素之間存在較強的相互作用。從圖5F可看出鹽析轉數對蛋白脫除率的影響高于鹽析時間,且兩因素間存在較強的相互作用。
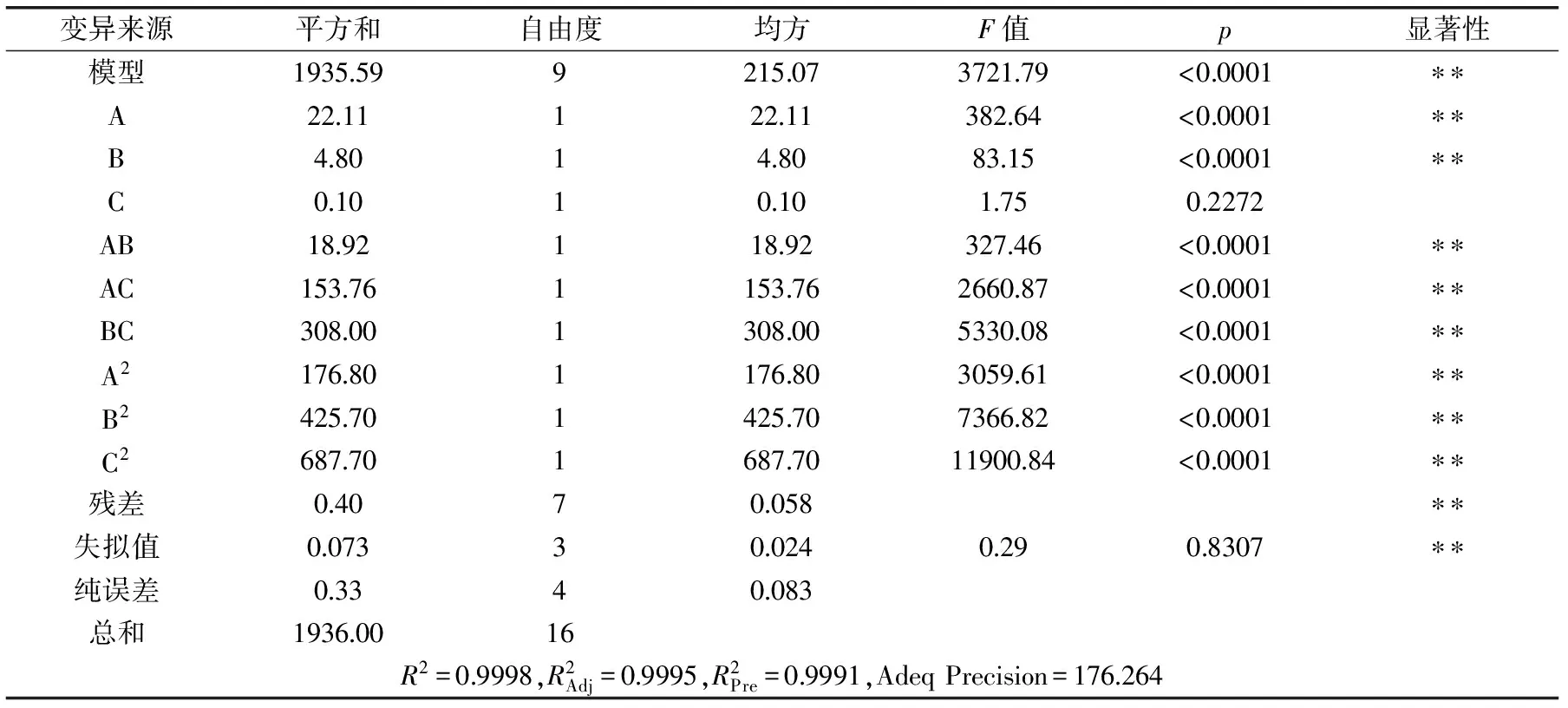
表4 多糖回收率回歸模型方差分析結果Table 4 Polysaccharide recovery regression model of variance analysis
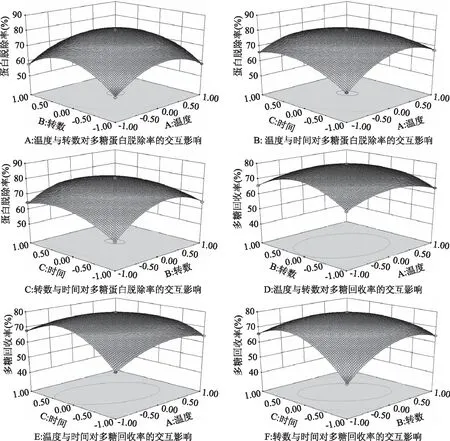
圖5 各因素交互作用的響應面圖Fig.5 Response surface plots for the effects of three process conditions
注:**代表p<0.01,極顯著;*代表p<0.05,顯著。本研究采用硫酸按鹽析法對姬松茸多糖粗品脫蛋白,對其進行工藝優化,并詳細探討了鹽析過程中的鹽析溫度、鹽析轉數、鹽析時間對其脫蛋白效果均有影響。隨著鹽析溫度的上升,蛋白脫除率呈現出先升高后降低的趨勢。蛋白質在一定溫度條件下雖然性質穩定,但是溫度較低不利于鹽析反應的進行。同時適宜溫度,糖類物質易與蛋白質結合,所以純化溶液具有糖蛋白的部分性質,溫度過高會引起蛋白的變性,從而影響蛋白的濃度。隨著鹽析轉數的增加,蛋白脫除率呈現出先迅速升高后降低的過程。硫酸銨鹽析的原理是硫酸銨溶液中高濃度的鹽離子與水分子的親和力大于蛋白質,并且適當的鹽析轉數賦予純化環境能量,從而破壞蛋白質表面的水化膜,溶解度下降,因此從溶液中沉淀析出。隨著鹽析溫度的增加,蛋白脫除率隨著鹽析時間的增加先增加后減少。這說明蛋白在鹽溶液中的反應需要一定的時間,在鹽析時,蛋白質可以與鹽離子充分反應,達到最大程度的沉淀,最后充分沉淀析出[34]。
為保證脫蛋白過程中,姬松茸多糖結構盡可能不被破壞,達到蛋白脫除效果,結合回歸模型分析結果可知,鹽析法脫蛋白的最佳工藝條件為硫酸銨粉末飽和度為20%,鹽析溫度為50.73 ℃,鹽析轉數為656.93 r/min,鹽析時間為30.46 min,此時姬松茸多糖的蛋白脫除率為80.2681%,多糖回收率為79.5627%。為驗證此方法的結果,并考慮實際可操作性,將最佳工藝參數修正為:硫酸銨粉末飽和度為20%,鹽析溫度為51 ℃,鹽析轉數為660 r/min,鹽析時間為31 min。進行蛋白脫除率和多糖回收率的驗證實驗,經3次平行實驗,實際蛋白脫除率和多糖回收率的平均值分別為80.29%和79.59%,實驗結果與模型符合良好,說明該模型能較好預測姬松茸多糖脫蛋白工藝。
3 結論
本文選用鹽析法脫蛋白,在多糖純化技術方面進行應用具有一定的創新性。但從實驗結果可以看出,多糖結構發生變化,有損失,而此時蛋白并沒有完全去除。為保證脫蛋白過程中,姬松茸多糖結構盡可能不被破壞,在蛋白脫除率高時,多糖回收率也高的前提下,實現分離純化。由鹽析法純化姬松茸多糖及利用DE 8.0.6軟件分析數據結果結合考慮實際可操作性,將最佳工藝參數修正為:硫酸銨粉末飽和度為20%,鹽析溫度為51 ℃,鹽析轉數為660 r/min,鹽析時間為31 min。進行蛋白脫除率和多糖回收率的驗證實驗,經3次平行實驗,實際蛋白脫除率和多糖回收率的平均值分別為80.29%和79.59%,數值相差范圍在0~0.05%可忽略不計。此方法簡單快捷,安全可行,極大降低了實驗成本與實驗時間,提供了大量實驗數據,為姬松茸多糖脫蛋白的方法提供了新的參考依據。
[1]陳智毅,李清兵,吳娛明.巴西蘑菇的食療價值[J].中國食用菌,2001,20(4):4-6.
[2]Chen L,Shao H J,Su Y B. Coimmunization ofAgaricusblazeiMurillextract with hepatitis Bvirus core protein through DNA vaccine enhances cellular and humoral immune respons-es[J]. International Immunopharmacology,2004,4:403-409.
[3]Takaku Takeshi,Kimura Yoshiyuki,Okuda Hiromichi. Isolation of an antitumor compound fromAgaricusblazeiMurilland its mechanism of action[J]. Journal of Nutrition,2001,131(5):1409-1413.
[4]Kimura Yoshiyuki,Kido Tadashi,Takaku Takeshi,et al. Isolation of an anti-angiogenic substance fromAgaricusblazeiMurill:Its antitumor and antimetastatic actions[J]. Cancer Science,2004,95(9):758-764.
[5]Mizuno M,Morimoto M,Minatio K,et al. Polysaccharides formAgaricusblazeistimulate lymphocyte T cell sub sets in mice[J]. Biosci. Biotechnol. Biochem.,2014,62(3):434.
[6]梁婷,趙亞男,劉愛麗,等. 微波法提取姬松茸多糖的工藝研究[J].食品工業科技,2012,34(4):236-238.
[7]唐小俊,張名位,池建偉,等. 姬松茸多糖的微波輔助提取與含量測定[J]. 中國食品學報,2006,6(1):267-272.
[8]張艷榮,單玉玲,劉婷婷,等. 微波萃取技術在姬松茸多糖提取中的應用[J]. 食品科學,2006,27(12):267-269.
[9]付志英,林花,丁玲. 應用超聲波技術提取姬松茸多糖工藝的優化研究[J].江西農業學報,2015,27(10):92-95.
[10]聶志勇. 酶法提取姬松茸多糖的研究[D]. 長沙:中南大學,2009:48-59.
[11]李峰. 姬松茸多糖不同提取與干燥方法的比較研究[D]. 天津:天津大學,2014:12-37.
[12]王艷,聶志勇,賀瑛,等. 超聲波協同復合酶法提取姬松茸多糖[J]. 天然產物研究與開發,2009,21:866-870.
[13]彭勇勝,王江之,黃程,等. 響應面法優化姬松茸多糖的提取工藝[J]. 現代食品科技,2015,27(9):1119-1122.
[14]沈愛英,谷文英. 姬松茸子實體水溶性多糖提取工藝的研究[J]. 中國食用菌,2002,21(1):15-17.
[15]丁重陽,張笑然,張梁,等. 姬松茸胞內多糖堿提取工藝[J]. 生物加工過程,2008,6(5):21-26.
[16]韓永萍,何江川,繆剛. 超濾提純姬松茸多糖的研究[J]. 中國食用菌,2005,24(2):44-46.
[17]刑小黑,吳明忠,朱述鈞,等. 靈芝多糖化學研究[J]. 中國食用菌,1996,15(3):1-16.
[18]Xie Li yuan,Peng Wei hong,Gan Bing cheng. Optimization of Protein Removal. Method and Condition of Polysaccharide from Phellinus Linteus[J]. Agricultural Science & Technology,2011,12(9):1249-1251.
[19]伍善廣,賴泰君,孫建華,等. 蠶蛹多糖脫蛋白方法研究[J]. 食品科學,2011,32(14):21-24.
[20]劉成海,萬茵,涂宗財,等. 百合多糖脫蛋白方法的研究[J]. 食品科學,2002,23(1):89-90.
[21]張坤,吳皓,王令充,等. 四角蛤蜊多糖脫蛋白方法比較[J]. 食品科學,2011,32(8):50-53.
[22]候卓. 蒙古口蘑多糖的提取、分離及純化技術的研究[D].長春:吉林農業大學,2008:28-29.
[23]鄭曉翠,蘇瑛,唐詠,等. 淫羊藿多糖的提取及其蛋白的脫除[J]. 華西藥學雜志,2009,24(2):155-157.
[24]李翠麗,王煒,張英,等. 中藥多糖提取、分離純化方法的研究進展[J].中國藥房,2016,27(19):2701.
[25]姚新生,吳立軍,吳繼洲,等.天然藥物化學(第4版)[M]. 北京:人民衛生出版社,2006:102.
[26]王金璽. 平菇多糖分離純化、結構表征與修飾及抗氧化性的研究[D]. 揚州:揚州大學,2013:2.
[27]張帆. 苦杏仁蛋白提取及其對人結腸腺癌細胞生長影響[D]. 北京:北京林業大學,2011:7.
[28]南亞,李宏高. 考馬斯亮藍G250法快速測定牛乳中的蛋白質[J]. 飲料工業,2007,10(12):41-42.
[29]張惟杰. 糖復合物生化研究技術(第2版)[M]. 杭州:浙江大學出版社,1998. 11-12.
[30]王金璽. 平菇多糖分離純化、結構表征與修飾及抗氧化性的研究[D]. 揚州:揚州大學,2013:34.
[31]劉義武,王碧. 檸檬皮中果膠提取工藝研究[J]. 內江師范學院學報,2011,26(10):14-17.
[32]鄧紅,宋紀蓉. 鹽析法從蘋果渣中提取果膠的工藝條件研究[J]. 食品研究與開發,2002,23(3):57-60.
[33]黎想. 鹽析法和黃孢原毛平革菌處理柑橘罐頭廢水的研究[D]. 長沙:湖南大學,2014:23.
[34]胡靜. 視黃醇結合蛋白的純化、抗血清的制備和檢測方法的建立[D].南京:南京理工大學,2013:14-15.
Optimization of deproteinization process fromAgaricusblazeimurillpolysaccharides by salting-out method
WU Chun,SUN Ning,LIU Ning,LI Chen-chen,LI Jian*
(Key Laboratory for Food Science and Engineering of Heilongjiang Province,College ofFood Engineering,Harbin University of Commerce,Harbin 150076,China)
Objective:To explore deproteinization process fromAgaricusblazeimurillpolysaccharides by salting-out method. Methods:Salting-out method was used to the deproteinization of polysaccharides fromAaricusblazeimurill,the effect of salting-out temperature,salting-out speed,salting-outtime and saturation of ammonium sulfate powder on the protein removal rate and polysaccharide recovery rate were investigated under the influence of the magnetic stirrer,and the conditions were optimized on the basis of single factor experiment through the response surface analysis. Results:Effects of protein removal rate and polysaccharide recovery rate by various factors as order:salting-out temperature>salting-out speed>salting-out time. The best parameters were salting-out temperature of 51 ℃,salting-out speed of 660 r/min,salting-out time of 31 min,saturation of ammonium sulfate powder of 20%,protein removal rate and polysaccharide recovery rate were 80.29% and 79.59%. Conclusions:The experimental results show that deproteinization process fromAgaricusblazeimurillpolysaccharides by salting-outt method is safe and convenient,fast and efficient,and can get higher protein removal rate and polysaccharide recovery rate at the same time.
salting-out method;Agaricusblazeimurillpolysaccharides;deproteinization condition;response surface analysis
2016-12-06
吳春(1962-),女,碩士,教授,研究方向:食品化學,E-mail:wuchun1962@126.com。
*通訊作者:李健(1956-),男,本科,教授,研究方向:食品科學,E-mail:lijian4852147@163.com。
黑龍江省教育廳項目(12541199)。
TS201.1
B
1002-0306(2017)13-0191-07
10.13386/j.issn1002-0306.2017.13.036

