綠原酸在小鼠3T3-L1前脂肪細胞分化進程中的作用
朱 琪,康勁翮,楊佳蒴,彭曙光*,王 征*
(1湖南農業大學生物科學技術學院,長沙 410128; 2中國科學院亞熱帶農業生態研究所/中國科學院亞熱帶農業生態過程重點實驗室/湖南省農業生態過程重點實驗室,長沙 410125;3湖南省煙草科學研究所,長沙 410125)
綠原酸在小鼠3T3-L1前脂肪細胞分化進程中的作用
朱 琪1,康勁翮2,楊佳蒴3,彭曙光3*,王 征1*
(1湖南農業大學生物科學技術學院,長沙 410128;2中國科學院亞熱帶農業生態研究所/中國科學院亞熱帶農業生態過程重點實驗室/湖南省農業生態過程重點實驗室,長沙 410125;3湖南省煙草科學研究所,長沙 410125)
目的:探討綠原酸(CGA)對小鼠3T3-L1前脂肪細胞分化的影響。方法:培養小鼠3T3-L1前脂肪細胞,分別設置空白對照組(CG)、陽性對照組羅格列酮組(RG)、陰性對照組GW9662組 (GG)和綠原酸組(CGA)。油紅O染色觀察小鼠3T3-L1前脂肪細胞分化后的細胞形態變化以及脂滴形成情況;組織細胞甘油三酯(TAG)酶法測定各組分化后的細胞TAG積累量;實時熒光定量PCR技術(qPCR)檢測小鼠3T3-L1前脂肪細胞在分化過程中關鍵基因PPARγ2 mRNA表達水平。結果:CGA組被油紅O染色的區域大于CG組和GG組,但CGA組顏色沒有RG組鮮艷,且脂滴形狀也與RG組存在差異。CGA組TAG積累量低于CG組和RG組,與CG組比較無顯著性差異(P>0.05),但與RG組比較有顯著性差異(P<0.05)。在分化過程中,CGA組和RG組PPARγ2 mRNA的表達量高于CG組和GG組,有顯著性差異(P<0.01),GG組PPARγ2 mRNA的表達量自細胞分化第4d起低于CG組,有顯著性差異(P<0.01)。結論:CGA可以促進小鼠3T3-L1前脂肪細胞的分化,同時降低分化后成熟脂肪細胞中TAG的積累量,其機制與分化相關因子PPARγ2的表達有關。
綠原酸(CGA);3T3-L1前脂肪細胞;細胞分化;PPARγ2;甘油三酯(TAG)
脂肪細胞分化與肥胖與胰島素抵抗等慢性疾病有密切關系。肥胖是一種慢性低度炎癥,造成肥胖的主要原因就是脂肪組織的炎癥現象,肥胖引起的慢性炎癥與諸多代謝性疾病如胰島素抵抗、2型糖尿病和心血管疾病等密切相關[1-3]。很多研究表明,多種茶飲、水果及蔬菜中都富含多酚類物質,具有降糖降脂等生物活性。
綠原酸(CGA)是由咖啡酸與奎尼酸組成的羧酚酸[4]。綠原酸是植物體有氧呼吸代謝的產物,具有抗炎癥、抗氧化活性、抗病毒活性、抗腫瘤活性和神經保護效應等多種生物活性[5]。Liu SL等[6]研究發現,綠原酸可以改善肥胖及相關代謝紊亂,通過阻礙炎癥途徑NF- kB通路,并上調PPARγ2的表達。Huang K等[7]研究發現,綠原酸可有效改善飼喂高脂SD大鼠的肝臟脂代謝,增加肝臟PPARα的表達,加速脂肪酸的β-氧化,下調脂肪酸合成限速酶乙酰CoA羧化酶的表達。宋卓等[8]研究表明,綠原酸可以調節大鼠脂肪組織的脂肪合成。Shimoda H等[9]研究表明,口服綠原酸有降低大鼠內臟脂肪堆積和體脂量的作用,這可能與綠原酸能夠降低肝臟TG水平有關。De Sotillo D V R等[10]研究發現,大鼠通過靜脈注射綠原酸5mg/mL,連續注射3w,其血漿中的膽固醇以及甘油三醋含量分別下降了44%和58%,而且綠原酸也能夠顯著降低肝臟中的甘油三酯水平。這些研究表明,綠原酸對脂代謝的調節起到了很有效的作用,對因肥胖引起的慢性炎癥有明顯的抑制。Dos Santos M D等[11]研究表明,綠原酸對角叉萊膠和福爾馬林誘導炎癥的動物具有抗炎、鎮痛作用,這可能與動物外周炎癥介質的合成和釋放有關。Matsuda E等[12]研究發現,杜仲提取物能夠抑制脂質在3T3-L1脂肪細胞中的堆積,杜仲提取物的主要組成成分有兒茶素、原兒茶酸、沒食子酸、綠原酸。楊斌等[13]通過研究廣西山銀花綠原酸體外抗炎作用及分子機制發現綠原酸具有體外抗炎作用,其作用機制可能與抑制TNF-α、IL-6等炎癥因子的活化以及影響花生四烯酸(AA)代謝有關。
我們前期工作表明,綠原酸可以上調飼喂高脂的SD大鼠脂肪細胞PPARγ的表達,但是綠原酸組SD大鼠并沒有出現明顯的肥胖。為了進一步研究其機理,我們擬研究綠原酸對小鼠3T3-L1前脂肪細胞分化的影響及其影響機制,探討綠原酸改善肥胖、抵抗炎癥在前脂肪細胞中的作用,為膳食結構的調整和和優化提供有意的參考數據。
1 材料與方法
1.1 試劑與儀器
小鼠3T3-L1前脂肪細胞系、油紅O染液,中國維爾生物;乙醇、異丙醇、三氯甲烷、多聚甲醛,國藥;RIPA裂解液,中國北京普利萊;組織細胞甘油三酯酶法測定試劑盒,中國碧云天;引物,上海生工;高糖培養基、磷酸緩沖液,美國Hyclone公司;小牛血清、胎牛血清、胰蛋白酶、青霉素/鏈霉素溶液,美國GIBCO公司;綠原酸(≥95%)、羅格列酮(≥98%)、GW9662(≥99%)、二甲基亞砜(DMSO)、胰島素、3-異丁基-1-甲基黃嘌呤(IBMX)(≥99%)、焦碳酸二乙酯(DEPC),美國Sigma公司;TRIzol Reagent,美國Invitrogen公司;地塞米松,日本TCI公司;RNA反轉錄試劑盒、SYBR Premix Ex TaqTM Ⅱ(Tli RNaseH Plus),日本TaKaRa公司。
超凈工作臺,蘇州集團安泰空氣技術有限公司;恒溫水浴鍋HH-S2,中國河南金博;旋渦混合器,中國江蘇其林貝爾;細胞培養恒溫箱、超低溫冰箱、實時熒光PCR儀,美國Thermo公司;酶標儀,美國Biotek公司;Allegra X-22R Centrifuge離心機,美國Beckman coulter公司;DMI3000B倒置顯微鏡,德國Leica公司。
1.2 方法
1.2.1 小鼠3T3-L1前脂肪細胞的培養 小鼠3T3-L1前脂肪細胞用完全培養基(DMEM高糖培養基+10%小牛血清+1%青霉素/鏈霉素溶液)在條件為37°C、5%CO2的細胞培養箱中培養,當細胞長滿培養皿的80%~90%時,用于接種細胞培養板。
1.2.2 小鼠3T3-L1前脂肪細胞的誘導分化 細胞按105個/mL的密度接種于6孔細胞培養板中,2mL/孔,當細胞增殖至接觸抑制時,換完全培養基繼續培養2d,然后換分化培養基1(DMEM高糖培養基+10%胎牛血清+500μmol/L IBMX+1μmol/L地塞米松+5μg/mL胰島素)培養(分化第0d),2d后換分化培養基2(DMEM高糖培養基+10%胎牛血清+5μg/mL胰島素)培養,2d后換分化維持培養基(DMEM高糖培養基+10%胎牛血清)培養,之后每隔2d換1次分化維持培養基,連續培養6d,至大部分前脂肪細胞分化為脂肪細胞,細胞中可見明顯脂滴。
1.2.3 小鼠3T3-L1前脂肪細胞加藥處理 在細胞分化的第0天分別在陽性對照組中加入羅格列酮,在陰性對照組中加入GW9662,在綠原酸組中加入綠原酸,藥物作用2d,并設置空白對照組。
1.2.4 油紅O染色法觀察細胞誘導分化情況 在細胞分化的第10d,棄去細胞培養基,用預冷的PBS清洗細胞兩次。加入4%多聚甲醛室溫下固定30~60min,棄去固定液。加入1mL油紅O稀釋液(油紅O染液:去離子水=3:2),使其完全覆蓋細胞表面,室溫下染色1h,棄去染色液。75%酒精多次漂洗,除去多余的染料。超純水多次沖洗,倒置顯微鏡下觀察,拍照記錄。
1.2.5 組織細胞甘油三酯測定試劑盒檢測分化后細胞甘油三酯積累情況 在細胞分化的第10d收集細胞,按照組織細胞甘油三酯測定試劑盒說明書操作。測定波長550nm處的吸光值。繪制標準曲線并計算甘油三酯濃度。以每mg蛋白濃度或細胞數校正甘油三酯含量。
1.2.6 qPCR法檢測小鼠3T3-L1前脂肪細胞PPARγ2的表達 在細胞分化的第0、2、4、6、8、10d,提取細胞RNA并檢測RNA濃度;按RNA反轉試劑盒步驟反轉成cDNA(總體積20μL);用Primer Premier 5.0進行引物設計,以β-actin為參照基因進行qPCR[10μL體系:SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)5μL+PCR Forward Primer(10μmol/L)0.5μL+PCR Reverse Primer(10μmol/L)0.5μL+樣本cDNA1μL+dH2O 3mL]。反件:stage1:預變性95°C 30sec,stage2:PCR反應95°C 5sec、60°C 30sec(single)40cycles,stage3:溶解曲線分析95°C 5sec、60°C 1min、97°C 1cycle,stage4:降溫40°C 30sec 1cycle。反應結束后導出CT值進行分析計算,基因的相對表達量=2-△△CT。引物設計如附表。

附表 目的基因及引物序列
1.2.7 統計分析 所有數據均以平均值±標準差表示,通過SPSS 19.0軟件進行統計分析,P<0.05表示有顯著性差異、P<0.01表示有極大顯著性差異、P>0.05表示無顯著性差異。
2 結果與分析
2.1 CGA對小鼠3T3-L1前脂肪細胞分化的影響
細胞分化第10d油紅O染色后,通過倒置光學顯微鏡對細胞染色情況進行觀察拍照,結果見圖2。CG組被油紅O染色的區域較少,顏色較淺,呈圓形的細胞較少,大部分細胞還是呈梭形的前脂肪細胞(圖1-A)。RG組有大量被油紅O染色的圓形脂滴,顏色鮮紅,80%以上的細胞都是呈圓形的脂肪細胞(圖1-B)。GG組和其他組相比,被油紅O染色的區域是最少的,顏色很淺,呈圓形的細胞也最少(圖1-C)。CGA組也有大片區域被油紅O染成紅色,但其顏色沒有RG組鮮艷,也不是像RG組那樣是明顯的圓形脂滴,有大量呈圓形的細胞(圖1-D)。
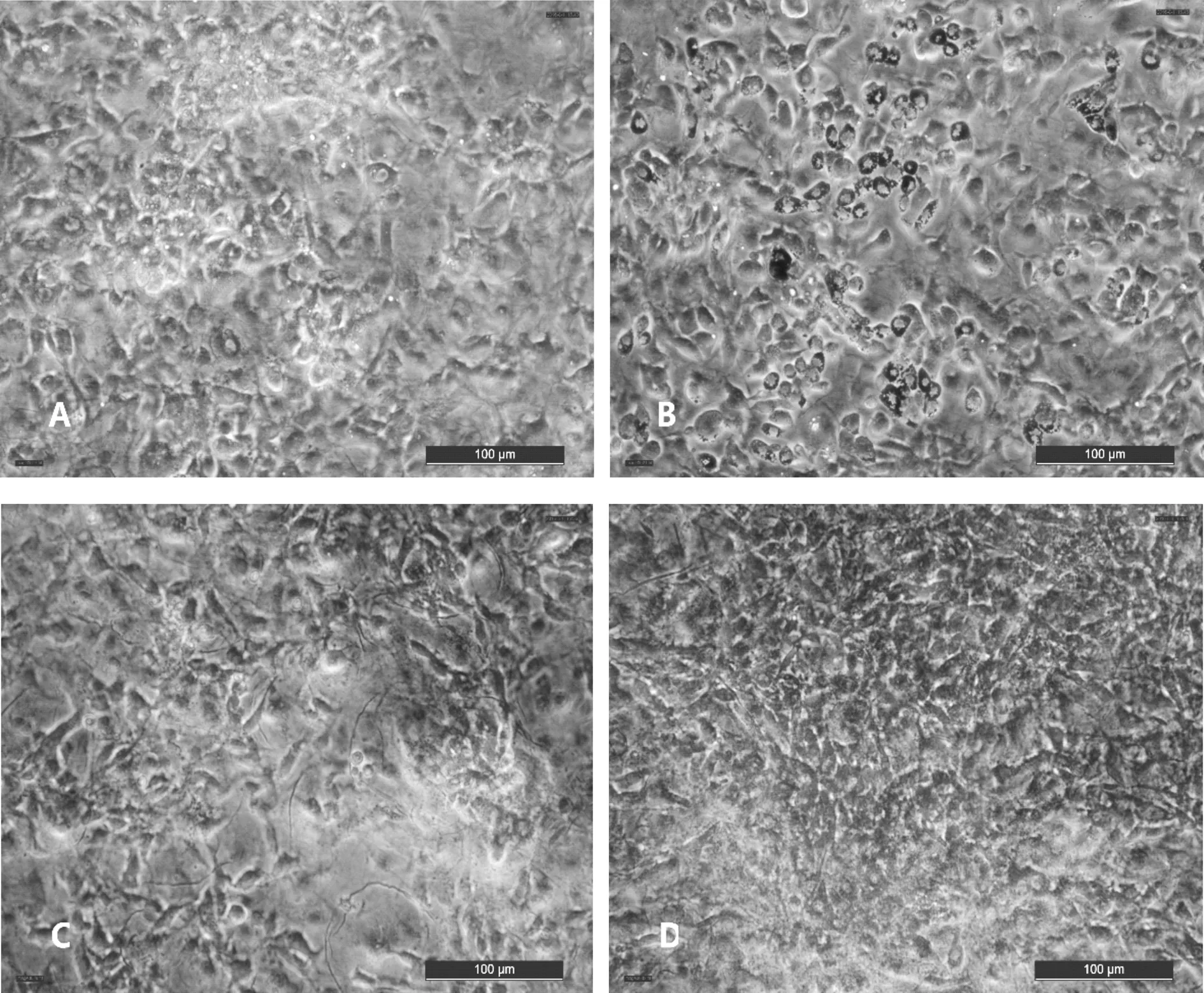
A:CG組 B:RG組 C:GG組 D:CGA組圖1 CGA對小鼠3T3-L1前脂肪細胞分化的影響(油紅o染色×200)注:*P<0.05 vs CG、**P<0.01 vs CG、#P<0.05 vs RG、##P<0.01 vs RG(同圖2、圖3)。
2.2 CGA對小鼠3T3-L1前脂肪細胞分化后TAG積累量的影響
細胞分化第10d后,收集細胞用組織細胞甘油三酯測定試劑盒檢測分化后細胞TAG積累情況,結果如圖2。RG組TAG積累量最大,與CG組相比有顯著性差異(P<0.05)。GG組TAG積累量最少,與CG組相比無顯著性差異,但與RG組相比有顯著性差異(P<0.05)。CGA組TAG積累量與CG組相比無顯著性差異(P>0.05),與RG組相比有顯著性差異(P<0.05)。
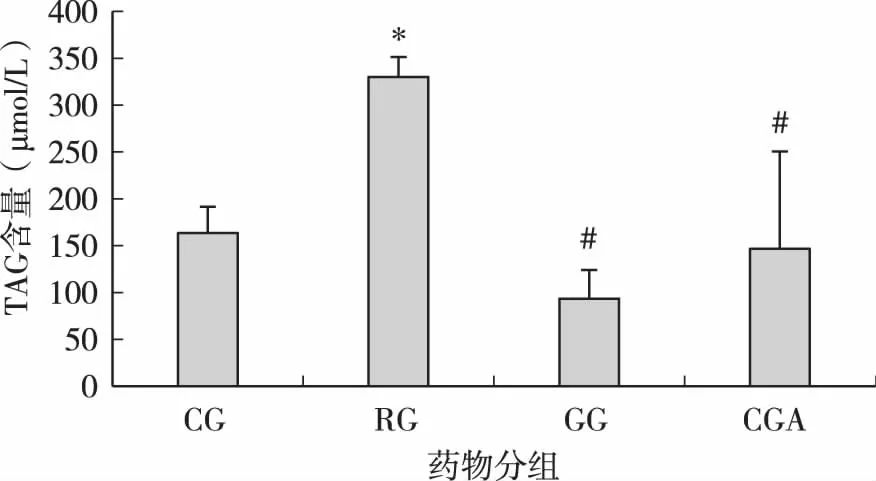
圖2 CGA對小鼠3T3-L1前脂肪細胞分化后TAG積累量的影響
2.3 CGA對小鼠3T3-L1前脂肪細胞分化過程中PPARγ2表達的影響
如圖3,在細胞分化的第2d各組PPARγ2 mRNA的表達量相比,RG組和CAG組的表達量高于CG組和GG組,CGA組表達量最高,與其他組相比有顯著性差異(P<0.01),GG組與CG組相比無顯著性差異(P>0.05)。在細胞分化的第4d各組PPARγ2 mRNA的表達量相比,RG組和CGA組的表達量高于CG組和GG組,CGA組和RG組相比無顯著性差異(P>0.05),與CG組比較有顯著性差異(P<0.01),GG組表達量最低,與其他組比較有顯著性差異(P<0.01)。在分化的第6、8、10d各組PPARγ2 mRNA的表達量相比,RG組和CGA組的表達量高于CG組和GG組,CGA組表達量最高,GG組表達量最低,與CG組比較有顯著性差異(P<0.01)。隨著分化的進行PPARγ2 mRNA的表達有逐漸上升的趨勢,在分化后期處于高表達的水平。
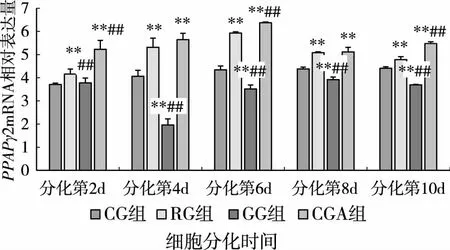
圖3 CGA對小鼠3T3-L1前脂肪細胞分化過程中PPARγ2 mRNA表達的影響
3 結論
綠原酸可以促進小鼠 3T3-L1前脂肪細胞的分化,其機制是綠原酸能夠上調分化相關基因PPAPγ2的表達。與羅格列酮不同是,雖然兩者都能提高PPARγ2的表達,但被綠原酸干預的前脂肪細胞分化后的得到的成熟脂肪細胞中TAG的積累量卻并不高,我們課題組在之前的實驗結果表明,綠原酸干預的高脂飼喂SD大鼠組中,脂肪組織激素敏感脂肪酶mRNA表達上調,三酰甘油加速代謝[8]。我們認為,雖然綠原酸可以上調PPARγ2的表達,促進前脂肪細胞的分化,但并不造成三酰甘油的含量的積累。其機制有待作進一步研究。
4 討論
脂肪組織主要由大量群集的脂肪細胞構成,聚集成團的脂肪細胞由薄層疏松結締組織分隔成小葉。脂肪細胞是高度分化的成熟細胞,在脂肪組織中形成并儲存脂肪,在脊椎動物體內能量的平衡中發揮著重要的作用。成人體內脂肪細胞的數量是恒定的,保持不變的,而且約10%的脂肪細胞在成人年齡和身體質量指數水平下,每年更新1次[14]。成熟的脂肪細胞中有大量脂滴的積累,它可以由前脂肪細胞分化形成。前脂肪細胞是呈梭形或多邊形的,且不含脂滴,成熟的脂肪細胞呈圓形,且細胞內有大量脂滴積累[15]。
脂肪細胞增殖、分化異常會引起脂肪組織的過多堆積,繼而導致脂肪細胞內分泌功能失調,引起肥胖和胰島素抵抗的發生[16]。Liu SL等[6]研究發現,綠原酸能降低高脂飼喂SD大鼠血清中總膽固醇、甘油三酯、游離脂肪酸水平,有效緩解高脂飲食造成的體重增加。Harmon A W等[17]研究了染料木黃酮及柚皮素對3T3-L1前脂肪細胞中脂代謝的影響,發現染料木黃酮能抑制3T3-L1 前脂肪細胞的增殖、減少胞內甘油三酯的積聚并上調PPARγmRNA 的表達,而柚皮素無此作用。Hu E等[18]研究表明,PPARγ和C/EBPα是前脂肪細胞分化為脂肪細胞的關鍵轉錄因子,PPARγ能促進培養的成肌細胞轉化為脂肪細胞,尤其在與C/EBPα共表達時作用更加明顯。本試驗以PPARγ激動劑羅格列酮作陽性對照,以PPARγ抑制劑GW9662作陰性對照;油紅O染色結果可以看出RG組的細胞分化程度較其他組高,且可見大量被染成紅色的脂滴,脂滴形狀呈圓形。作為能抑制其表達,油紅O染色結果可以看出GG組中被染色的區域較其他組少,且顏色較淺,呈圓形的脂肪細胞也很少。CGA組被油紅O染色的區域較CG組多,但其顏色較淺,且脂滴形狀與RG組有差異,脂滴大小也較RG組小。TAG測定結果顯示,RG組TAG的積累量最多,高出空白組1倍。GG組TAG積累量最低,但其與CG組無顯著性差異,CGA組TAG積累量略低于CG組,與CG組無顯著性差異。說明CGA可以促進細胞的分化,并且降低分化后的脂肪細胞中的脂質積累,其機制可能與CGA能夠上調前脂肪細胞中PPARγ表達有關。
前脂肪細胞的分化過程有很多分化相關因子的參與,其中起關鍵作用的是PPARγ[19]。PPARγ是重要的細胞分化轉錄因子,在哺乳動物的脂肪組織、血管平滑肌組織、心肌組織中均有表達,它至少有兩種亞型:在大多數組織中都表達的PPARγ1和特異表達于脂肪組織的PPARγ2[20]。PPARγ必須與類視黃醇X受體(Retinoid X receptor,RXR)形成二聚體,才能結合DNA表現出轉錄活性;在前脂肪細胞中通過PPARγ、C/EBPs和ADD1/SREBP-1的相互作用來調控細胞的分化[21]。PPARγ和C/EBPα在前脂肪細胞分化的調控中處于同一途徑,C/EBPα的活動依賴于PPARγ,此外,PPARγ和C/EBPα還能協同激活分化相關基因的表達[22]。本試驗PPARγ2 mRNA表達結果顯示:羅格列酮能夠促進PPARγ2 mRNA的表達,在細胞分化的第2d時PPARγ2 mRNA的表達量已經高于CG組;GW9662能夠抑制PPARγ2 mRNA的表達,在細胞分化的第4d,GG組PPARγ2 mRNA的表達量明顯低于CG組,表現出抑制效果。CAG組在細胞分化的第2dPPARγ2 mRNA的表達量高于CG組,之后其表達逐漸上調。說明CGA和羅格列酮有一樣的功能,CGA可以促進PPARγ2 mRNA的表達。總的來說,CGA具有促進小鼠 3T3-L1前脂肪細胞PPARγ2表達,從而促進細胞分化的作用。這與黃康[23]綠原酸對大鼠肝臟脂肪代謝調節機制研究和Liu SL等[6]的研究結果相似。◇
[1]詹莉莉,楊志秋,傅正偉.肥胖與慢性炎癥的研究進展[J].中國細胞生物學學報,2011(3):297-305.
[2]Baker R G,et al.NF-κB,inflammation,and Metabolic disease[J]. Cell metabolism,2011,13(1):11-22.
[3]Wellen K E,Hotamisligil G S.Obesity-induced inflammatory changes in adipose tissue[J]. Journal of Clinical Investigation,2003,112(12):1785.
[4]孫健,吳國娟.綠原酸的研究進展[C].北京畜牧獸醫領域青年科技工作者“新思想、新觀點、新方法”論壇,2009.
[5]劉穎,郭明曄,白根本.綠原酸的研究進展[J]. 中藥材,2012,35(7):1180-1185.
[6]Liu S L,Peng B J,Zhong Y L,et al.Effect of 5-caffeoylquinic acid on theNF-κBsignaling pathway,peroxisome proliferator-activated receptor gamma 2,and macrophage infiltration in high-fat diet-fed Sprague-Dawley rat adipose tissue[J]. Food & Function,2015,6(8):2779-2786.
[7]Huang K,Liang X,Zhong Y,et al.5-Caffeoylquinic acid decreases diet-induced obesity in rats by modulatingPPARαandLXRαtranscription[J]. Journal of the Science of Food and Agriculture,2015,95(9):1903-1910.
[8]宋卓,蔡小慶,閆曉東,等.綠原酸對高脂飼喂SD大鼠脂肪組織三酰甘油合成降解關鍵酶基因表達的影響[J].食品工業科技,2015,36(11):336-340.
[9]Shimoda H,Seki E,Aitani M.Inhibitory effect of green coffee bean extract on fat accumulation and body weight gain in mice[J]. BMC Complementary and Alternative Medicine,2006,6(1):1-9.
[10]De Sotillo D V R,Hadley M.Chlorogenic acid modifies plasma and liver concentrations of:cholesterol,triacylglycerol,and minerals in (fa/fa)Zucker rats[J]. The Journal of Nutritional Biochemistry,2002,13(12):717-726.
[11]Dos Santos M D,et al.Evaluation of the anti-inflammatory,analgesic and antipyretic activities of the natural polyphenol chlorogenic acid.[J]. Biological & Pharmaceutical Bulletin,2006,29(11):2236-2240.
[12]Matsuda E,et al.Effects of Eucommia ulmoides Oliver leaf extract on 3T3-L1 differentiation into adipocytes[J]. Journal of Natural Medicines,2006,60(2):126-129.
[13]楊斌,丘岳,王柳萍,等.廣西山銀花綠原酸體外抗炎作用及分子機制研究[J].中國藥理學通報,2009,25(4):542-545.
[14]Spalding K L,et al.Dynamics of fat cell turnover in humans[J]. Nature,2008,453(7196):783-787.
[15]Moreno-Navarrete J M,Fernández-Real J M.Adipocyte Differentiation[M].Adipose Tissue Biology,2012:17-38.
[16]蔡東升.脂肪細胞分化與肥胖,胰島素抵抗[J].國外醫學:內分泌學分冊,1999,19(3):97-100.
[17]Harmon A W,Harp J B.Differential effects of flavonoids on 3T3-L1 adipogenesis and lipolysis[J]. American Journal of Physiology-cell Physiology,2001,280(4):C807-C813.
[18]Hu E,Tontonoz P,Spiegelman B M.Transdifferentiation of myoblasts by the adipogenic transcription factorsPPARgammaandC/EBPalpha[J]. Proceedings of the National Academy of Sciences,1995,92(21):9856-9860.
[19]Lefterova M I,Lazar M A.New developments in adipogenesis.[J]. Medical Clinics of North America,2009,20(3):107-114.
[20]陳永熙,王偉銘,周同,等.PPAR-γ作用及其相關信號轉導途徑[J].中國細胞生物學學報,2006,28(3):382-386.
[21]Morrison R F,Farmer S R.Hormonal signaling and transcriptional control of adipocyte differentiation[J]. The Journal of Nutrition,2000,130(12):3116S-3121S.
[22]Rosen E D,Hsu C H,Wang X,et al.C/EBPαinduces adipogenesis throughPPARγ:a unified pathway[J]. Genes & Development,2002,16(1):22-26.
[23]黃康.綠原酸對大鼠肝臟脂肪代謝調節機制研究[D].湖南農業大學,2014.
(責任編輯 李婷婷)
Effects of Chlorogenic Acid During Differentiation Process of Mouse 3T3-L1 Preadipocytes
ZHU Qi1,KANG Jin-he2,YANG Jia-shuo3,PENG Shu-guang3,WANG Zheng1
(1College of Bioscience and Biotechnology,Hunan Agricultural University,Changsha 410128,China;2Institute of Subtropical Agriculture,The Chinese Academy of Sciences / Key Laboratory of Agro-ecological Processes in Subtropical Region/Hunan Key Laboratory of Agro-ecological Processes,,Changsha 410125,China;3Research Institute of Hunan Tobacco Science,Changsha 410125,China)
ObjectiveTo investigate the effects of chlorogenic acid(CGA)on the differentiation of mouse 3T3-L1 preadipocytes .MethodThe culture of mouse 3T3-L1 preadipocytes were divided into 4 groups including control group(CG),the positive control group of rosiglitazone group(RG),the negative control group of GW9662 group (GG)and chlorogenic acid group(CGA).The cell morphological changes and formation of lipids droplet of mouse 3T3-L1 preadipocytes after differentiation were observed by oil red O staining method.The triacylglyceride (TAG)accumulation of differentiation cells in different groups was determined by tissue cell triglyceride enzyme method.The expressions ofPPARγ2 mRNA during the differentiation process of mouse 3T3-L1 preadipocytes was determined by quantitative Real-time PCR(qPCR).ResultIn CGA group,the area of oil red O staining was larger than that of CG group and GG group,but the color of CGA group was not bright and the shape of lipids droplet was also different from that of RG group.In CGA group,the accumulation of TAG was lower than that in CG group and RG group,and compared with CG group it was not significantly (P>0.05)but compared with RG group it was significantly (P<0.05).During the differentiation process of mouse 3T3-L1 preadipocytes:The expressions ofPPARγ2 mRNA in CGA group and RG group was higher than that in CG group and GG group (P<0.01).To begin fourth days of differentiation,the expressions ofPPARγ2 mRNA in GG group was lower than that in CG group (P<0.01).ConclusionCGA can promote the differentiation of mouse 3T3-L1 preadipocytes,and decrease the accumulation of TAG in mouse 3T3-L1 preadipocytes after differentiation.The mechanism is connected with the expression ofPPARγ2.
CGA;3T3-L1 preadipocytes;cell differentiation;PPARγ2;TAG
湖南省教育廳重點項目(項目編號:14A071);中國煙草總公司湖南省公司科技項目(項目編號:15-17Aa04)。
朱琪(1993— ),女,學術型碩士研究生,研究方向:天然產物的開發與利用。
*共同通信作者:王征(1967— ),女,博士,教授,博士生導師,研究方向:食物營養與藥理;彭曙光(1973— ),男,高級農藝師,研究方向:煙草資源利用。

