菜籽肽的ACE、腎素抑制活性及抗氧化性研究
王鳳章 楊毅杰 何 榮 鞠興榮 袁 建
(南京財經大學食品科學與工程學院;江蘇高校糧油質量安全控制及深加工重點實驗室,南京 210023)
菜籽肽的ACE、腎素抑制活性及抗氧化性研究
王鳳章 楊毅杰 何 榮 鞠興榮 袁 建
(南京財經大學食品科學與工程學院;江蘇高校糧油質量安全控制及深加工重點實驗室,南京 210023)
本研究采用1、3 、5 、10 ku的超濾膜分離菜籽蛋白嗜熱菌蛋白酶水解物(TPH),得到了4種不同分子質量的菜籽肽,研究了各菜籽肽的血管緊張素轉化酶-Ⅰ(ACE)抑制活性、腎素抑制活性、氧自由基吸附能力(ORAC)和細胞抗氧化(CAA)活性。結果表明,菜籽肽的分子質量與其ACE抑制活性、腎素抑制活性以及ORAC值有明顯的正相關性(P<0.05);<1 ku的菜籽肽的ORAC值遠高于TPH的,其ORAC值(Trolox)高達(4 363.53±45.87)μmol TE/g,是谷胱甘肽(GSH)的2.4倍,其中2個菜籽肽的ORAC值與GSH相當(P<0.05);細胞抗氧化試驗表明TPH的CAA值最高,為(26.53±1.71)μmol QE/g,其次是<1 ku組分,其CAA值是(23.91±0.69)μmol QE/g。研究認為,菜籽蛋白酶水解物及各菜籽肽不僅具有ACE和腎素雙重抑制活性,還有一定的氧自由基吸收能力。因此,菜籽蛋白可用于開發降血壓制劑或相關功能性產品。
菜籽蛋白 膜分離 ACE抑制活性 腎素抑制活性 抗氧化性
據WHO統計,心血管疾病已成為全球最大的致死因素,而高血壓是造成心血管疾病的主要原因之一[1]。腎素-血管緊張素系統(RAS)是重要的機體血壓調節系統,在RAS中,腎素是系統鏈的初始限速酶,腎素水解血管緊張素原生成血管緊張素-Ⅰ,而血管緊張素-Ⅰ會在血管緊張素轉化酶-Ⅰ(ACE)的作用下進一步水解成血管緊張素-Ⅱ,血管緊張素-Ⅱ會與血管緊張素受體結合,使血管收縮,引起醛固酮的釋放,進而導致鈉離子濃度的增加和高血壓[2]。因此,RAS系統中最重要的2種水解酶:腎素和ACE的活性對于調節血壓的高低有重要的作用。
研究表明,許多來源于食物蛋白酶解的多肽都具有顯著的降血壓活性功能。食物源生物活性肽因具有安全、低成本、高活性、易吸收、營養價值高等特點,現已成為食品工業研究的熱點領域之一。Udenigwe等[3]用不同的蛋白酶水解亞麻籽蛋白得到的多肽片段表現出腎素和ACE雙重抑制活性。Garcia-Mora等[4]用堿性蛋白酶解得到的豌豆多肽不僅具有ACE抑制活性,還具有氧自由基吸收能力(ORAC)。此外,氧化應激反應也是引起高血壓的重要原因之一,朱麗娟[5]研究發現,玉米蛋白水解物的抗氧化性與ACE抑制活性間存在顯著相關性。因此,抗氧化性的強弱與機體血壓升高或降低也有一定的關系。
我國是世界上菜籽粕產量最大的國家,菜籽中含有21%~24%的蛋白質,脫脂菜籽粕中含有33%~39%的蛋白質[6]。菜籽蛋白中含有豐富的含硫氨基酸和賴氨酸,它除了具有較好的營養特性外,其功能特性也優于其它蛋白,特別是吸油性、保水性和乳化性能優于大豆蛋白[7],是極具開發潛力的植物蛋白資源。研究認為,菜籽蛋白水解物有較強的抗氧化性和抗腫瘤活性[8-9]。因此,本研究將菜籽蛋白的嗜熱菌蛋白酶水解物(TPH)經過超濾獲得4種分子質量不同的肽組分,采用體外ORAC和細胞內CAA 2種抗氧化方法評價TPH及各菜籽肽的抗氧化能力,進一步探討了分子質量大小、氨基酸組成對菜籽肽ACE、腎素抑制活性以及抗氧化能力的影響,為研究菜籽蛋白降血壓肽或相關功能性產品提供參考。
1 材料與方法
1.1 材料與試劑
菜籽粕(Brassicanapus):東海糧油工業有限公司;嗜熱菌蛋白酶Thermolysin、血管緊張素轉化酶-Ⅰ(ACE)、6-羥基-2,5,7,8-四甲基色滿-2-羧基(Trolox)、2,2'-偶氮二異丁基脒二鹽酸鹽(2, 2'-Azobis (2-amidinopropane) dihydrochloride,ABAP)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(MTT)、槲皮素、Trolox、2',7'-二氯熒光素二乙酸酯(2',7'-Dichlorofluorescin diacetate,DCFH-DA)和還原型谷胱甘肽(GHS):美國Sigma公司;青霉素、鏈霉素、磷酸鹽緩沖液(PBS)、二甲基亞砜(DMSO)、胰蛋白酶-EDTA消化液、高糖培養基(DMEM)、胎牛血清(FBS)、Hank′s平衡鹽溶液(HBSS):美國Thermo Fisher公司;腎素活性測定試劑盒:Cayman Chemical公司。試驗所用試劑均為分析純。
1.2 儀器與設備
FP-6300熒光分光光度計:日本JASCO;SpectraMax M2e型熒光酶標儀:美國Sspectra MAX Gemini; AKTA purify10蛋白質純化儀:美國通用公司;Stirred Cell 8010超濾裝置:美國Millipore;96孔白色底部透明微孔板:美國Corning公司;MSC-Advantage-12生物安全柜、SL16R冷凍離心機、XD30A倒置顯微鏡、HERACELL-150i型CO2培養箱:美國Thermo Fisher公司。
1.3 試驗方法
1.3.1 菜籽蛋白質的制備
采用He等[10]的方法制備菜籽蛋白。將菜籽粕粉碎、過80 目篩,分散于10 倍體積的蒸餾水中,用1 mol/L NaOH調節pH 為11.0,并維持不變,室溫攪拌2 h 后,8 000×g 離心1 h,收集上清液,用1 mol/L HCl 調節上清液pH 至4.5,靜置2 h 后離心,得到下層沉淀蛋白質。
1.3.2 菜籽蛋白質水解物和膜分離組分的制備
采用He等[10]的方法制備菜籽蛋白水解物及各膜分離組分。將菜籽蛋白質溶解在蒸餾水中,配制成5%的溶液,調pH 為7.5、溫度37 ℃,向其中加入4% (以樣品菜籽蛋白質量計) 的嗜熱菌蛋白酶,水解4 h,水解過程中通過滴加1 mol/L 的NaOH 保持反應體系的pH 恒定。水解反應結束后,將水解物加熱至90 ℃ 并保溫10 min 滅酶,冰水浴快速冷卻后以8 000×g 離心1 h,上清液依次通過截留分子質量1、3、5、10 ku的超濾膜,透過液和水解液冷凍干燥得到菜籽蛋白水解物和不同分子質量組分。采用lowry法[11]測定組分中蛋白質的含量。根據式(1)計算菜籽蛋白各膜分離組分的得率。

(1)
1.3.3 氨基酸組成的測定
采用氨基酸自動分析儀,按照說明書對樣品進行酸水解后再進行氨基酸組成的測定。
1.3.4 ACE抑制活性的測定
采用Holmquist等[12]方法測定菜籽蛋白水解物和不同分子量組分的ACE抑制活性。在比色杯中加入1 mL 0.5 mmol/L FAPPG(溶解于50 mmol/L Tris-HCl緩沖液,含0.3 mol/L NaCl,pH 7.5),20 μL ACE(1 U/mL,最終活力為20 mU),200 μL樣品(溶解于上述緩沖液,最終質量濃度1 mg/mL),室溫下混勻,于2 min內在345 nm下測定吸光值的降低速率。空白以Tris-HCl緩沖液代替樣品。根據式(2)計算ACE抑制活性:
(2)
式中,ΔA·min-1(樣品)和ΔA·min-1(空白)分別為樣品和空白的ACE活性變化速率。
1.3.5 腎素活性的測定
采用He等[10]的方法測定菜籽蛋白水解物和各分子質量組分的腎素抑制活性。具體方法為:在96孔板中依次加入:(1)空白:20 μL底物,160 μL測試用緩沖液,10 μL純水;(2)空白對照:20 μL底物,150 μL測試用緩沖液,10 μL純水;(3)樣品:20 μL底物,150 μL測試用緩沖液,10 μL樣品(最終濃度為1 mg/mL)。然后分別向每個孔中加入10 μL腎素以啟動反應,37 ℃下預熱15 min后,在10 min內應用熒光酶標儀測定樣品的熒光強度(FI),激發波長340 nm,發射波長490 nm。根據式(3)計算樣品的腎素活性抑制率:
(3)
式中:ΔFI·min-1(樣品)和ΔFI·min-1(空白)分別為樣品和空白的腎素活性變化速率。
1.3.6 氧自由基吸附能力(ORAC)的測定
根據You等[13]的方法,測定菜籽蛋白水解物及其膜分離組分的氧自由基吸附能力。將樣品溶解于pH為7.4,0.075 mol/L磷酸鹽緩沖溶液(熒光素、Trolox和AAPH也用該溶液配制),使其質量濃度為50 mg/L。在96孔板中依次加入120 μL熒光素(0.008 μmol/L)和20 μL 的樣品或者濃度分別為50、25、12.5、6.25 μmol/L抗氧化劑Trolox,在37 ℃下保溫20 min后,向每個樣品孔中加入60 μL AAPH (0.15 mol/L)以啟動反應,熒光酶標儀在60 min 內每隔1 min記錄1次樣品的熒光強度 (λex=485 nm, λem=530 nm)。抗氧化劑作用時熒光衰減曲線下面積分面積,扣除無抗氧化劑的空白曲線下面積,得出抗氧化劑的保護面積(AUC)。通過對比樣品熒光衰退曲線的AUC與標準抗氧化劑Trolox的AUC,計算樣品的ORAC值。
1.3.7 細胞培養
采用DMEM高糖完全培養基,含10%胎牛血清,1%雙抗(青霉素和鏈霉素)、1%非必需氨基酸,1%谷氨酰胺。HepG2細胞于37 ℃、5%CO2、相對濕度90%的培養箱中培養,隔天換液,待細胞貼壁生長至70%~80%,用含0.25%EDTA的胰蛋白酶消化,按1∶4比例傳代。
1.3.8 MTT細胞毒性試驗
采用MTT法[14]進行細胞毒性試驗。將TPH和4種肽用培養液配制成7個質量濃度梯度:50、100、200、400、600、800、1 000 mg/L。取對數生長期的HepG2細胞,于96孔板中每孔接種104個細胞,于37 ℃、5%CO2細胞培養箱中培養24 h后,棄去培養液,向每孔中加入100 μL不同濃度梯度的樣品,每個濃度均設6個復孔,對照組不加入樣品,只加培養液,繼續培養24 h后,向每孔中加入20 μL的MTT(5 mg/mL),繼續培養4 h,棄去培養液后,每孔加入150 μL DMSO,于37 ℃下振蕩20 min,使藍紫色結晶充分溶解,然后在酶標儀波長570 nm下測吸光值,按照式(4)計算細胞成活率。
(4)
1.3.9 細胞抗氧化(CAA)活性試驗
采用Wolfe等[15]和Song等[16]建立的細胞模型進行細胞內抗氧化活性試驗。在96孔板上接種HepG2細胞,每孔加入100 μL細胞懸液,使細胞密度達到每孔6×104個,培養24 h細胞貼壁后,去除上清液,用PBS清洗每個孔。然后每孔加入100 μL樣品處理液(含有25 μmol/L的DCFH-DA),以不含樣品的處理液為對照,在37 ℃、5%CO2培養箱中繼續培養1 h。取出96孔板,去除上清液,每孔加入100 μL HBSS(含有600 μmol/L的ABAP),將96孔板放入熒光酶標儀中掃描,保持恒溫37 ℃,在波長485 nm處激發,每5 min在波長538 nm處釋放,測定1h。
1.3.10 細胞抗氧化能力的定量
扣去空白和初始熒光在值后,每個多肽濃度對應時間-熒光值曲線下的面積即為CAA 值,根據式(5)計算樣品的CAA(unit):
(5)

1.3.11 數據分析
采用SAS軟件對數據進行單因素方差分析Duncan多重比較,以P<0.05為有顯著差異。每組試驗重復3次,結果均采用“平均值±標準差”表示。
2 結果與討論
2.1 菜籽蛋白TPH及其膜分離組分的得率
嗜熱菌蛋白酶是一種內肽酶,采用其水解菜籽蛋白質,并根據分子質量大小用超濾膜分離水解物得到了4種不同分子質量的菜籽肽,得率如圖1所示。由圖1可知,TPH的得率最高,為(70.92±2.05)%,其次是分子質量小于1 ku的菜籽肽,得率是(40.96±0.60)%,隨著菜籽肽分子質量的增大,得率逐漸減小,說明嗜熱菌蛋白酶水解菜籽分離蛋白可以有效的釋放低分子質量的多肽。并且,水解物中分子質量小于3 ku的多肽占比多達60%以上。有研究表明,肽的抗氧化能力和肽鏈的長短、分子質量的大小有關。Pena-Ramos等[17]研究發現,分子質量在350~1 500 u的肽對脂質體系中乳清蛋白水解物的總抗氧化能力起著重要作用,Wu等[18]認為分子質量在1 400 u左右的肽,比大于1 400 u的肽具有更強的抗氧化活性。

圖1 菜籽蛋白水解物及各膜分離組分的得率
2.2 菜籽蛋白水解物及各膜分離組分的氨基酸組成分析
研究認為,肽所含的親疏水性氨基酸的比例、相對分子質量及肽段中攜帶的氨基酸的電性或酸堿性等對肽的抗氧化性都有一定的影響[19]。TPH及其膜分離組分的氨基酸組成如表1所示。由表1可知,TPH及不同分子質量的肽都含有較高比例的疏水性氨基酸(HAA),其中>10 ku肽的HAA比例高達52.08%,其余組分所含的HAA也在40%以上。研究發現,疏水性可增強肽與脂類的相互作用,以及與靶器官的疏水性結合,有利于實現其抗氧化作用[20]。此外,TPH的Tyr含量最高,Tyr中的酚羥基可以作為氫供體,有利于提高肽的抗氧化能力[21]。另外,3~5 ku的肽則含有較高的His,His中的咪唑環可以干擾氧化還原反應產生的羥基自由基,還可與單線態氧直接作用[22],其本身就有抗氧化性。因此,His、Tyr、Lys的存在有利于提高肽的抗氧化能力。
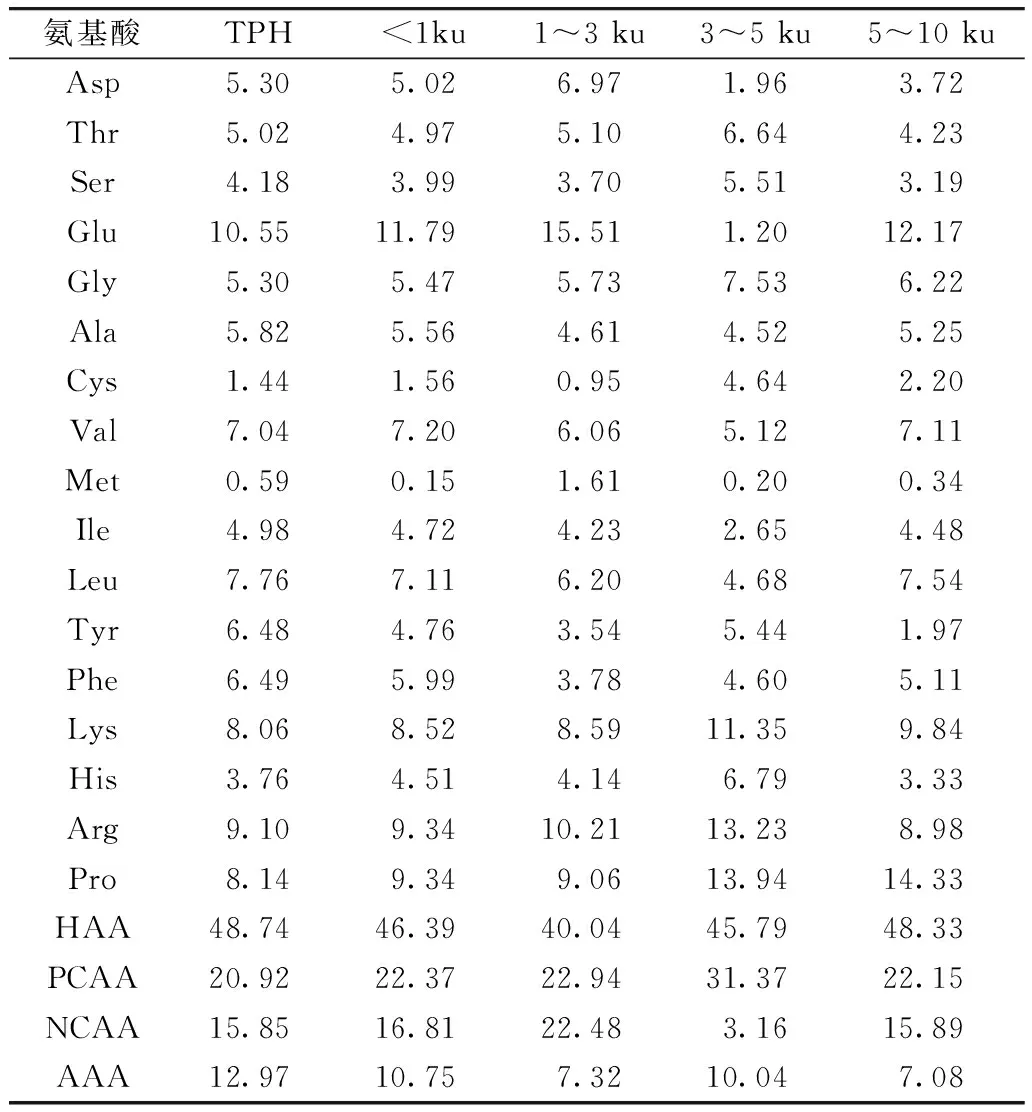
表1 菜籽蛋白嗜熱菌蛋白酶水解物(TPH)及其膜分離組分的氨基酸組成
注:疏水性氨基酸(HAA) 為Ala、Val、Ile、Leu、Tyr、Phe、Pro、Met、Cys;帶正電荷的氨基酸(PCAA) 為Arg、His、Lys;帶負電荷的氨基酸(NCAA) 為Asp、Glu;芳香族氨基酸(AAA) 為Phe、Tyr。
2.3 ACE抑制活性分析
菜籽蛋白水解物及其膜分離組分的血管緊張素轉化酶-Ⅰ(ACE)抑制活性如圖2所示。由圖2可知,<1 ku的肽的ACE抑制活性最高,為87.39%,并隨著分子質量增大,ACE抑制活性逐漸降低,其中1~3 ku和3~5 ku組分的ACE抑制率相當,分別為(80.63±0.64)%和78.38%,TPH的ACE抑制率最低,為(70.27±2.50)%。由圖2可得,<5 ku的各菜籽肽的ACE抑制活性高于5~10 ku菜籽肽的ACE抑制活性。這與之前的研究結果一致[23],低分子質量的肽具有更高的ACE抑制活性。這可能是因為,低分子質量的肽含有更多的疏水性氨基酸和芳香族氨基酸,而芳香族氨基酸C-末端的環狀結構有利于與ACE活性部位的結合,疏水性氨基酸則加強了肽與ACE的親和力,從而增強了低分子質量菜籽多肽的ACE抑制活性。劉萍[24]和張寧浩[25]對玉米蛋白酶解產物和花生短肽的研究也有相似的結論。

圖2 菜籽蛋白水解物及其膜分離組分的血管緊張素轉化酶-Ⅰ(ACE)抑制活性
2.4 腎素抑制活性分析
由圖3可知,TPH的腎素抑制活性很低,只有(10.32±2.51)%,而<1 ku的組分和1~3 ku組分的腎素抑制活性很高,分別為(78.89±1.24)%和(59.10±2.11)%,隨著分子質量的增大,肽的腎素抑制活性逐漸減小。和圖2相比得出,低分子質量的肽不僅有較高的ACE活性,還有較高的腎素抑制活性,因此,低分子質量的菜籽肽對ACE和腎素具有雙重抑制功能。

圖3 菜籽蛋白水解物及其膜分離組分的腎素抑制活力
2.5 抗氧化性分析(ORAC法)
ORAC法是評價食品抗氧化性的標準方法,用于檢測抗氧化物質對過氧化自由基的清除能力。菜籽蛋白水解物及其膜分離組分吸附氧自由基能力如圖4所示。<1 ku的肽顯示出最高的抗氧化活性,為(4 363.53±45.87)μmol TE/g,其次是TPH水解物,為(2 123.42±68.74) μmol TE/g,1~3 ku和3~5 ku的ORAC值與GSH相當,分別為(1 935.98±70.06)μmol TE/g和(1 864.86±24.40)μmol TE/g。當分子質量超過5 ku時,肽的ORAC值明顯降低,說明菜籽蛋白水解物的ORAC值與分子質量之間存在著相關性(P<0.05),隨著分子質量的增大,ORAC值逐漸減小。與其他相關研究相比,菜籽蛋白具有較高的氧自由基吸附能力。例如,Zhang等[26]研究的大豆蛋白的Alcalase水解物的ORAC值為23~83.3μmol TE/mg蛋白質,Wattanasirit等[27]用胰蛋白酶水解米糠蛋白的水解物的ORAC值為1.096~4.067 μmol TE/mg蛋白質,都顯著低于本研究中TPH及各菜籽肽的ORAC值。

圖4 菜籽蛋白水解物及其膜分離組分的氧自由基吸附能力
2.6 細胞毒性分析
本試驗配制的樣品濃度梯度為50~1 000 mg/L,菜籽蛋白水解物及各分離組分對HepG2細胞的毒性如圖5所示。當樣品質量濃度在100 mg/L以下時,細胞成活率大都在90%以上,當質量濃度超過600 mg/L時,加有分子質量大于3 ku組分的細胞成活率基本下降到80%以下,當質量濃度增大到1 000 mg/L時,樣品各組分都顯示了一定的細胞毒性,細胞成活率只有70%左右。因此在后續CAA試驗中,以50~600 mg/L的質量濃度范圍為依據,作為細胞無毒性的試驗劑量。
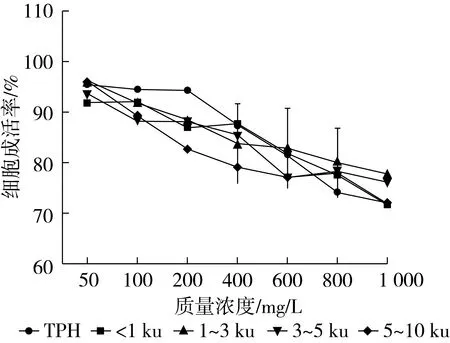
圖5 菜籽蛋白水解物及各膜分離組分對細胞的毒性影響
2.7 抗氧化性分析(CAA法)
CAA法比一般的化學抗氧化分析方法更具有生物學意義,它涉及到細胞對抗氧化物質的吸收及細胞的新陳代謝等。CAA的主要原理是,熒光探針DCFH-DA進入細胞后被胞內酯酶水解為DCFH,然后加入自由基引發劑AAPH,AAPH可產生穩定的過氧自由基(ROO·),DCFH可被ROO·氧化生成熒光物質DCF,而抗氧化劑能有效猝滅ROO·。因此,熒光強度越低,說明抗氧化劑能力越強。菜籽蛋白水解物及各膜分離組分的EC50值和CAA值分別如圖6、圖7所示。其中,TPH組分的EC50值最低,為(134.36±8.67)mg/L,而CAA值最高,為(26.53±1.71)μmol QE/g;5~10 ku組分的EC50值最高,為(289.42±10.52)mg/L,而CAA值最低,為(12.30±0.45)μmol QE/g,說明菜籽蛋白水解物TPH的抗氧化性最高。隨著分子質量的增大,各組分的CAA值在逐漸減小,<1 ku的肽的抗氧化性高于其它分子質量肽的抗氧化性,這可能是因為分子質量較小的物質更容易進入到細胞發揮抗氧化能力。陳源[28]在研究不同分子質量的麥麩小分子肽的抗氧化性時,也得出超濾膜透過液的 CAA 值隨著超濾膜孔徑的增大而減小的結論。

圖6 菜籽蛋白水解物及各膜分離組分的EC50值

圖7 菜籽蛋白水解物及各膜分離組分的CAA值
3 結論
嗜熱菌蛋白酶可以有效水解菜籽蛋白釋放其中的抗氧化肽,其水解物中小于1 ku的肽得率高達(40.96±0.60)%,不同分子質量的的肽中都含有40% 以上的疏水性氨基酸,疏水性氨基酸的存在有利于提高肽的抗氧化性;菜籽肽的分子質量與其ACE抑制活性、腎素抑制活性以及氧自由基吸附能力都有明顯的正相關性(P<0.05),隨著分子質量的增大,其ACE抑制活性與腎素抑制活性都逐漸降低;<1 ku離組分的氧自由基吸附能力(ORAC)遠高于菜籽蛋白嗜熱菌蛋白酶水解物TPH的,其ORAC值高達(4 363.53±45.87)μmol TE/g,是GSH的2.4倍,其中1~3 ku和3~5 ku 2個組分的ORAC值與GSH相當(P<0.05);體外抗氧化法(ORAC)和細胞內抗氧化法(CAA)的結果表明,4種不同分子質量的肽具有相同的變化規律,<1 ku肽抗氧化活性最高,其余組分的抗氧化性強弱為1~3 ku肽>3~5 ku肽>5~10 ku肽。本試驗研究表明,菜籽蛋白水解物及各膜分離組分不僅具有ACE和腎素雙重抑制活性,還有一定的抗氧化性,這為菜籽肽在降血壓制劑的開發或相關功能性產品的應用上提供了參考。
[1]World Health Organization.Global status report on noncommunicable diseases 2014. Geneva, Switzerland
[2]Daien V, Duny Y, Ribstein J, et al. Treatment of hypertension with renin-angiotensin system inhibitors and renal dysfunction:a systematic review and meta-analysis[J]. American Journal of Hypertension, 2012, 25(1): 126-132
[3]Udenigwe C C, Lin Y S, Hou W C, et al. Kinetics of the inhibition of renin and angiotensin I-converting enzyme by flaxseed protein hydrolysate fractions[J]. Journal of Functional Foods, 2009, 1(2): 199-207
[4]Patricia G M, Juana F, Elena P, et al. Simultaneous release of peptides and phenolics with antioxidant, ACE-inhibitory and anti-inflammatory activities from pinto bean(PhaseolusvulgarisL. var. pinto) proteins by subtilisins[J]. Journal of Functional Foods, 2015, 18: 319-332
[5]朱麗娟. 玉米蛋白水解物體外消化產物的抗氧化ACE抑制活性研究 [D]. 無錫:江南大學,2008 Zhu Lijuan. The Research of in vitro digestion product of corn protein hydrolysates’ antioxidant and ACE Inhibitory Activity [D]. Wuxi: Jiangnan University, 2008
[6]Schwenke K D. Rapeseed proteins[M] //Hudson B J F New and Development Sources of Food Proteins. Chapman&Hall, 1994
[7]郭興鳳,周瑞寶,湯堅,等. 菜籽蛋白的制備[J]. 鄭州工程學院學報,2001,3 (22):60 Guo Xingfeng, Zhou Ruibao, Tang jian, et al. The preparation of rapeseed protein [J]. Journal of Zhengzhou Engineering College, 2001, 3 (22): 60
[8]Zhang S B, Wang Z, Xu S Y, et al. Purification and characterization of a radical scavenging peptide from rapeseed protein hydrolysates[J]. Journal of the American Oil Chemists,Society, 2009, 86: 959-966
[9]Xue Z H, Liu Z W, Wu M C, et al. Effect of rapeseed peptide on DNA damage and apoptosis in Hela cells[J]. Experimental and Toxicologic Pathology, 2010, 62(5): 519-523
[10]He R, Girgih A T, Malomo S A, et al. Antioxidant activities of enzymatic rapeseed protein hydrolysates and the membrane ultrafiltration fractions[J]. Journal of Functional Foods, 2013, 5(1) : 219-227
[11]Markwell M A K, Haas S M, Bieber L, et al. A modification of the Lowry procedure to simplify protein determination in membrane and lipoprotein samples[J]. Analytical biochemistry, 1978, 87(1): 206-210
[12]Holmquist B, Bünning P, Riordant J F. A continuous spectrophotometric assay for angiotensin converting enzyme[J]. Analytical biochemistry, 1979, 95(2): 540-548
[13]You S J, Udenigwe C C, Aluko R E, et al. Multifunctional peptides from egg white lysozyme [J].Food Research International, 2010, 43(3): 848-855
[14]王立峰,王玉梅,鞠興榮,等. 菜籽蛋白水解物體外和細胞內抗氧化性評價及氨基酸分析研究[J]. 食品科學,2014,13:49-53 Wang Lifeng, Wang Yumei, Ju Xingrong, et al. In vitro and cellular antioxidant activity evaluation and amino acid analysis of rapeseed protein hydrolysates [J]. Food Science, 2014, 13:49-53
[15]Wolfe K L, Liu R H. Cellular antioxidant activity (CAA) assay for assessing antioxidants,foods, and dietary supplements[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22):8896-8907
[16]Song W, Derito C M, Liu R H, et al. Cellular antioxidant activity of common vegetables[J]. Journal of Agricultural and Food Chemistry, 2010, 58(11): 6621-6629
[17]Pena-Ramos E A, Xiong Y L. Antioxidative activity of soy protein hydrolysates in aliposomal system[J]. Food Science, 2002(67): 2952-2956
[18]Wu H C, Chen H M, Shiau C Y. Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomberaustriasicus)[J]. Food Research International, 2003, 36(9): 949-957
[19]陳潔, 胡曉赟. 蛋白水解物的抗氧化性研究與展望[J]. 中國食品學報,2011,9:111-119 Chen Jie, Hu Xiaoyun. Antioxidant activity research and prospect of protein hydrolysates[J]. Journal of Chinese Food, 2011, 9: 111-119
[20]Samaranayaka A G P, Eunice C Y,Lic. Food-derived peptidic antioxidants: a review of their production, assessment, and potential applications[J]. Journal of Functional Foods, 2011, 3(4): 229-254
[21]Pihlanto A. Antioxidative peptides derived from milk proteins[J].International Dairy Journal, 2006, 16(11): 1306-1314
[22]Wade A M, Tucker H N. Antioxidant characteristics of L-histidine[J].The Journal of Nutritional Biochemistry, 1998, 9(6): 308-315
[23]He R, Abraham T G, Sunday A, et al. Antioxidant activities of enzymatic rapeseed protein hydrolysates and the membrane ultrafiltration fractions[J]. Journal of Functional Foods, 2013, 5(1): 219-227
[24]劉萍. 酶解玉米蛋白提取ACE抑制肽的研究 [D]. 無錫:江南大學,2006 Liu Ping. The Research of enzymatic hydrolysis of corn protein and extraction of ACE inhibitory peptides [D]. Wuxi: Jiangnan University, 2006
[25]張宇昊. 花生短肽制備及其功能活性研究 [D]. 北京:中國農業科學院,2007 Zhang Yuhao. The research of preparation and functional activities of short peanut peptides [D]. Beijing: Chinese Academy of Agricultural Science, 2007
[26]Zhang Lei, Li Jianrong, Zhou Kequn. Chelating and radical scavenging activities of soy protein hydrolysates prepared from microbial proteases and their effect on meat lipid peroxidation[J]. Bioresource Technology, 2010, 101(7): 2084-2089
[27]Wattanasiritham L, Theerakulkait C, Wickramasekara S, et al. Isolation and identification of antioxidant peptides from enzymatically hydrolyzedrice bran protein[J]. Food Chemistry, 2016, 192: 156-162
[28]陳源. 酶膜耦連制備麥麩小分子肽及其抗氧化活性研究 [D]. 烏魯木齊: 新疆農業大學,2014 Chen Yuan.Study on antioxidant activity of low-molecular weight peptides from wheat bran by enzymatic membrance reactor[D].Wulumuqi:Xinjiang Agricultwal University,2014.
Research of Rapeseed Peptides′ ACE, Renin Inhibition and Antioxidant Activity
Wang Fengzhang Yang Yijie He Rong Ju Xingrong Yuan Jian
(College of Food Science and Engineering; Key Laboratory of Grains and Oils Quality Safety Control and Further Processing of Jiangsu Province,Nanjing University of Finaces & Economics, Nanjing 210023)
This paper studied the ACE-I inhibition activity, renin inhibition activity, ORAC and CAA of rapeseed peptides with four different molecular masses obtained from TPH of rapeseed protein seperated by membrane ultrafiltration of 1,3,5,10 ku. The results showed that there was a significant positive correlation (P<0.05) between molecular masse of rapeseed and its ACE-I inhibition activity, renin inhibition activity as well as ORAC. The ORAC value of rapeseed peptides <1 ku was (4 363.53±45.87) μmol TE/g, much higher than that of TPHs and 2.4 times of GSH. The ORAC values of two rapeseed peptides were equal to that of GSH (P<0.05). Cellular antioxidant experiment showed that CAA value (26.53±1.71)μmol QE/g of TPH is the highest, followed by <1 ku component with the CAA value being (23.91±0.69) μmol QE/g. It was concluded that rapeseed protein hydrolysates and rapeseed peptides had ACE and dual inhibitory activity of renin and also had certain absorptive capacity of oxygen free radicals. So rapeseed protein could be used to develop natural blood pressure-lowering agents or other related functional products.
rapeseed protein, membrane separation, ACE-inhibitory activity, renin inhibitory activity, antioxidant activity
國家自然科學基金(31501522,31571767),江蘇省高校自然科學基金(14KJB550003),南京市農業科技攻關計劃(2015SA213018)
2015-11-20
王鳳章,女,1993年出生,碩士,糧食、油脂及植物蛋白質工程
何榮,男,1983年出生,講師,食品營養 鞠興榮,男,1957年出生,教授,博士生導師,食品營養、功能食品及農產品深加工
Q514
A
1003-0174(2017)05-0050-07

