超微粉碎處理對小麥面筋蛋白性質的影響
郭武漢 關二旗 卞 科
(河南工業大學糧油食品學院,鄭州 450001)
超微粉碎處理對小麥面筋蛋白性質的影響
郭武漢 關二旗 卞 科
(河南工業大學糧油食品學院,鄭州 450001)
研究超微粉碎處理對小麥面筋蛋白結構和功能性質的影響,為拓寬小麥面筋蛋白的應用領域提供理論依據。以小麥面筋蛋白為原料,經超微粉碎處理,得到6種不同粒度的面筋蛋白樣品,借助傅里葉變換紅外光譜儀(FTIR)、紫外可見分光光度計等設備,以及常規化學分析方法,研究超微粉碎處理對面筋蛋白巰基含量、二級結構、溶解性、起泡性、乳化性等的影響。結果表明,經超微粉碎處理后,面筋蛋白粉體的粒度(D50)由109.35 μm減小到3.60 μm。隨著面筋蛋白粉體粒度的減小,總巰基含量顯著下降,暴露巰基含量則呈先增后減的變化規律。FTIR分析表明,超微粉碎后面筋蛋白的β-折疊、無規卷曲結構顯著增加,分子柔性顯著提高。蛋白功能特性分析結果顯示,隨著粉體粒度的減小,面筋蛋白的溶解度發生顯著變化;起泡性和乳化性均得到顯著改善。其中,面筋蛋白的起泡能力提高了50%,泡沫穩定性提高了20%,乳化活性提高了6%,乳化穩定性提高了1.1%。因此,超微粉碎處理對面筋蛋白的結構和功能性質有顯著影響。采用超微粉碎技術對面筋蛋白進行處理,粒度(D50)達到5 μm左右時,其巰基含量發生顯著變化,蛋白柔性顯著提高,溶解度發生明顯變化,乳化性、起泡性得到顯著改善。
小麥面筋蛋白 超微粉碎 巰基 二級結構 功能特性
小麥面筋蛋白主要是蛋白單體或通過二硫鍵形成的高分子化合物,是小麥的主要貯藏蛋白[1-2],主要由醇溶蛋白和谷蛋白構成,營養價值較高,但較低的溶解度、乳化性等功能特性限制了小麥面筋蛋白在食品和非食品工業中的應用[3]。超微粉碎技術是利用機械或流體動力的方式克服固體內部凝聚力使物料破碎的粉碎技術,可使物料的粒度達到10~25 μm,甚至達到1 μm的超細粉體水平[4]。有研究表明蛋白粉體粒度的變化對其半胱氨酸含量、溶解度及消化吸收能力均有顯著影響[5]。因此,研究超微粉碎對蛋白結構和功能性質影響的客觀規律,對于改善蛋白質特性、拓寬蛋白質資源的利用范圍具有重要的實際應用價值和科學指導意義。目前,許多學者致力于研究超微粉碎處理對蛋白質理化性質和功能特性的影響。Zhao等[6]研究發現,姜粉經過超微粉碎后,其蛋白的溶解度明顯提高。Sun等[7]利用高能納米球磨機粉碎乳清蛋白,發現微細化乳清蛋白粉的乳化性得到顯著改善。Hayakawa等[8]認為超微粉碎對大豆分離蛋白疏水性并無顯著影響,但當酪蛋白粒度減小到10 μm以下時,其表面疏水性顯著增加。關二旗[9]研究認為,超微粉碎對小麥粉面筋指數和沉淀值均有顯著改善作用。張慧等[10]研究表明,超微粉碎后小麥面筋蛋白的白度值、起泡性、乳化性、持水性和持油性均隨粒度的減小而提高。但是,目前關于超微粉碎對小麥面筋蛋白結構及其功能性質的影響鮮見報道。本研究以小麥面筋蛋白為原料,采用超微粉碎手段對其進行處理,借助激光粒度儀、紅外光譜、紫外可見分光光度計等檢測設備,以及常規化學分析方法,研究超微粉碎前后小麥面筋蛋白粉體粒度、巰基含量、二級結構和功能性質的變化規律,初步探討超微粉碎處理導致小麥面筋蛋白功能性質變化的機理,以期為小麥蛋白資源的開發利用提供參考。
1 材料與方法
1.1 材料與試劑
小麥面筋蛋白(粗蛋白質質量分數84%):河南蓮花味精股份有限公司;福林酚試劑:Sigma公司;2-硝基苯甲酸:Aladdin;三羥甲基氨基甲烷(Tris)、尿素、酒石酸鉀鈉:洛陽市化學試劑廠;乙二胺四乙酸:洛陽昊華化學試劑有限公司。
1.2 主要儀器與設備
Mastersizer 2000激光粒度儀:英國馬爾文儀器有限公司;UV-2000紫外可見分光光度計:尤尼柯(上海)儀器有限公司;5810R臺式高速大容量離心機(冷凍型):德國Eppendorf儀器有限公司;WQF-510傅里葉變換紅外光譜儀:天津天光有限公司。
1.3 試驗方法
1.3.1 超微粉體制備
設定氣流壓力為(0.80±0.5)MPa,氣流溫度為-10~10 ℃,調整氣流粉碎機變頻電機轉速3 000~15 000 r/min及粉碎次數,制備不同粒度的小麥面筋蛋白超微粉體樣品。
1.3.2 粒度測定
采用激光粒度分析儀檢測小麥面筋蛋白超微粉體的粒徑及粒度分布情況。D50表示在粒徑累積分布曲線上,50%的樣品顆粒直徑小于或等于此值。
1.3.3 巰基含量測定
參照Hu等[11]的方法,略改動:15 mg 樣品溶于5.0 mL溶解液[Tris-Gly(甘氨酸)-Urea(8 mol/L) 溶解液用于測定總巰基含量,Tris-Gly溶解液用于測定暴露巰基含量]中。然后加入0.05 mL DTNB溶液(4 mg/mL,Tris-Gly溶解液配制)。懸浮液置于25 ℃條件下1 h,偶爾振蕩。然后12 000 r/min離心10 min。測定上清液在412 nm處的吸光度,試劑溶解液作為空白。以13 600(mol·L-1·cm)-1消光系數計算巰基含量。
1.3.4 小麥面筋蛋白二級結構分析
參照Dominique等[12]的方法:將樣品預先置于盛有硅膠粒的干燥器中,放置至樣品濕基含水量為0%(105 ℃恒重法測定)。然后稱取2 mg樣品與200 mg KBr研磨均勻,壓片,測定FTIR。掃描范圍4 000~400 cm-1,分辨率4 cm-1,掃描次數32。譜圖分析采用Peakfit 4.12軟件分析,在酰胺I帶1 600~1 700 cm-1范圍內兩點基線校正,去卷積,二階導數,Gaussian 曲線擬合,參照Kim等[13]的方法計算α-螺旋、β-折疊、β-轉角和無規卷曲所占比例。
1.3.5 溶解度測定
超微粉碎小麥面筋蛋白粉體溶解度的測定參照Yalcin等[14]的方法,稍作改動:稱取0.3 g樣品溶于30 mL蒸餾水中,攪拌10 min,然后采用0.5 mol/L HCl或0.5 mol/L NaOH調節溶液pH為pH 2.0、4.0、5.0、6.0、8.0、10.0,室溫下攪拌1 h后,20 ℃、10 000 r/min條件下離心20 min;取適量上清液適當稀釋,使吸光度值為0.2~0.8,參照Lowry法測定上清液蛋白質含量,以牛血清白蛋白為標準蛋白繪制標準曲線。溶解度表示為上清液中蛋白含量占總蛋白含量的百分比。
1.3.6 起泡性測定
參照Yu等[15]的方法:取2%樣品溶液(0.01 mol/L pH 7.0磷酸緩沖液配制)20 mL,10 000 r/min條件下均質2 min,迅速轉移到100 mL量筒中測定起泡性。其中,起泡能力為均質后蛋白質懸浮液增加的體積百分比,泡沫穩定性為靜置30 min后泡沫保留的百分比。
1.3.7 乳化性測定
參照Qiu等[16]的方法,稍作改動:0.1%樣品溶液21 mL(0.5 mol/L HCl 調節溶液pH為4.0),先均質20 s,然后加7 mL花生油,室溫下10 000 r/min均質1 min,分別在均質后0、10 min后從溶液底部吸取0.05 mL溶液,加5 mL 0.1%的SDS溶液,500 nm處測吸光度,以SDS溶液為空白。乳化活性指數EAI/m2/g=2×(2.303A0)×N×10-4/φLC
式中:N為稀釋倍數;φ為體系中油相所占的分數(本研究中的油相占25%);C為蛋白質的質量濃度/g/mL;L為比色池光徑(1 cm)。
乳化穩定性ES=A0×ΔT/(A0-A10)
式中:A0為0 min的吸光值;A10為10 min時的吸光值;ΔT為時間差/min。
1.3.8 數據處理
采用SPSS16.0軟件對數據進行分析處理;采用鄧肯氏新復極差法進行多重比較,檢驗水平為P<0.05;采用Origin8.0 軟件處理作圖。
2 結果與分析
2.1 超微粉碎小麥面筋蛋白粒度分析
采用氣流粉碎機對小麥面筋蛋白進行干法粉碎,通過調整變頻電機轉速和控制粉碎次數,依次得到6種小麥面筋蛋白超微粉碎樣品,其粒度測定結果列于表1。在變頻電機轉速為6 000 r/min的條件下進行一次粉碎,小麥面筋蛋白粉體顆粒粒徑D50為17.91 μm,達到超微粉體的粒徑范圍要求(10~25 μm),且比表面積增加了3.4倍。隨著變頻電機轉速的提高和粉碎次數的增加,小麥面筋蛋白的粒徑不斷減小,比表面積不斷增大。當變頻電機轉速達到15 000 r/min時,對小麥面筋蛋白進行6次粉碎,其粒徑D50減小至3.60 μm,比表面積為3.17 m2/g,比表面積較對照樣品A增加了19.8倍。
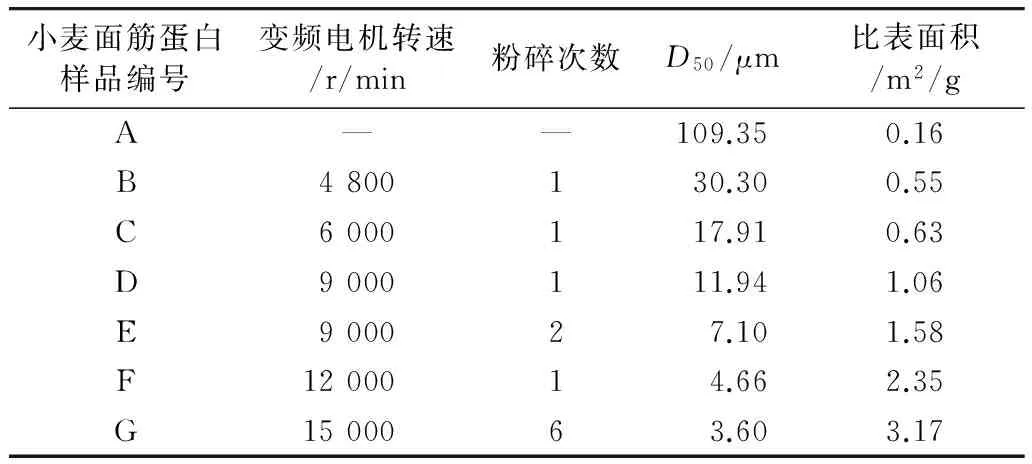
表1 超微粉碎小麥面筋蛋白粒度分布
2.2 超微粉碎處理對小麥面筋蛋白巰基含量的影響
從圖1可知,經過超微粉碎處理,隨著粉體粒度的減小,小麥面筋蛋白中總巰基含量逐漸降低。當粉體粒度D50減小到3.60 μm時,總巰基含量降低至3.66 μmol/g。與對照樣品A相比,超微粉碎后小麥面筋蛋白的暴露巰基含量均有所增加,但不同粒度的小麥面筋蛋白超微粉體的暴露巰基含量則呈現出先增后減的變化規律。當粉體粒度D50減小到11.94 μm時,暴露巰基含量達到最大值,為1.77 μmol/g。上述分析結果表明,小麥面筋蛋白經過超微粉碎處理后,隨著粉體粒度的減小,埋藏(或包裹)于分子內部的巰基將會暴露出來,但在有氧環境條件下,蛋白質中暴露的巰基會被氧化形成蛋白交聯[17]。因此,經過超微粉碎處理,小麥面筋蛋白中部分埋藏(或包裹)的巰基暴露出來,但在與空氣中氧的接觸過程中,暴露的巰基又被氧化形成二硫鍵,導致不同粒度的小麥面筋蛋白超微粉體隨著粒度的減小,其暴露巰基數量呈先增后減的變化規律[18]。
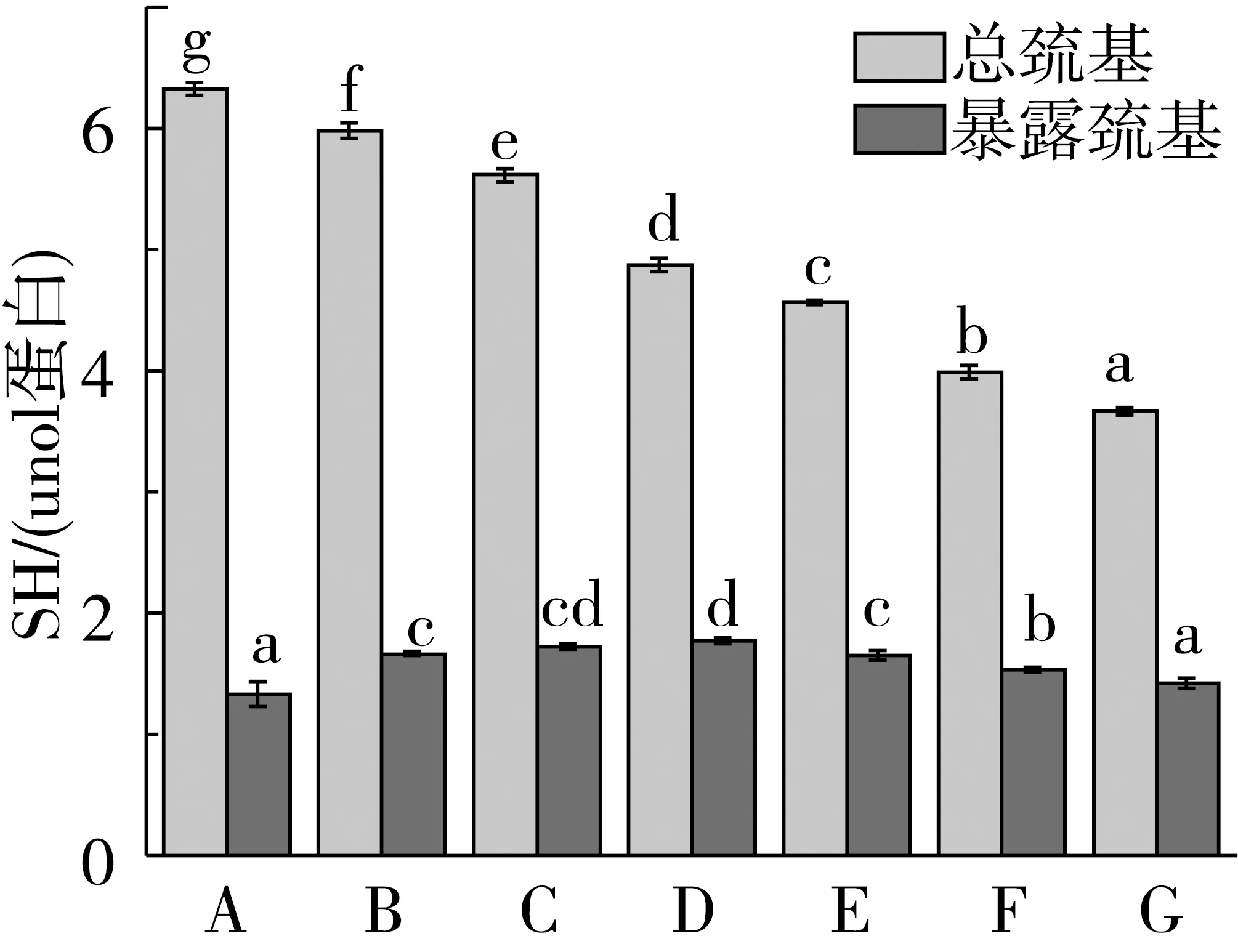
注:小寫字母表示差異顯著P<0.05,余同。圖1 超微粉碎小麥面筋蛋白巰基含量變化
2.3 超微粉碎處理對小麥面筋蛋白二級結構的影響
超微粉碎小麥面筋蛋白二級結構的變化分析結果列于表2。分析結果顯示,經過超微粉碎處理后,小麥面筋蛋白二級結構發生了不同程度的變化。與對照樣品A相比,超微粉碎后小麥面筋蛋白的β-折疊、無規卷曲結構顯著增加,α-螺旋和β-轉角結構顯著減小(P<0.05)。經過超微粉碎后處理后,小麥面筋蛋白的α-螺旋與β-折疊的比值減小,表明小麥面筋蛋白分子的柔性增加[19]。有研究表明,超微粉碎處理過程中,粉體顆粒受到碰撞、剪切、摩擦等機械力的作用后可能誘發化學反應,產生機械力化學效應,導致顆粒結構及其表面物理化學性質發生顯著變化[20]。因此,小麥面筋蛋白粉體經過超微粉碎處理后,其二級結構發生了顯著變化。
2.4 超微粉碎處理對小麥面筋蛋白溶解度的影響
從圖2可以看出,超微粉碎處理對小麥面筋蛋白的溶解度影響顯著(P<0.05)。研究結果顯示,當溶液pH值<5時,隨著小麥面筋蛋白粉體粒度的減小,其溶解度整體呈現明顯增加的趨勢,但變化無明顯的規律性,這可能與蛋白所帶電荷產生的靜電推斥作用和粉體受粒度變化而產生的顆粒間相互團聚作用的競爭有關[21];當溶液pH值≥5時,隨著小麥面筋蛋白粉體粒度的減小,比表面積增加,其溶解度顯著增加,但隨著粉體粒度進一步減小,面筋蛋白粉體顆粒之間因發生-SH/-SS-交換而聚合,形成不溶的高分子聚合物,導致其溶解度顯著下降[22]。
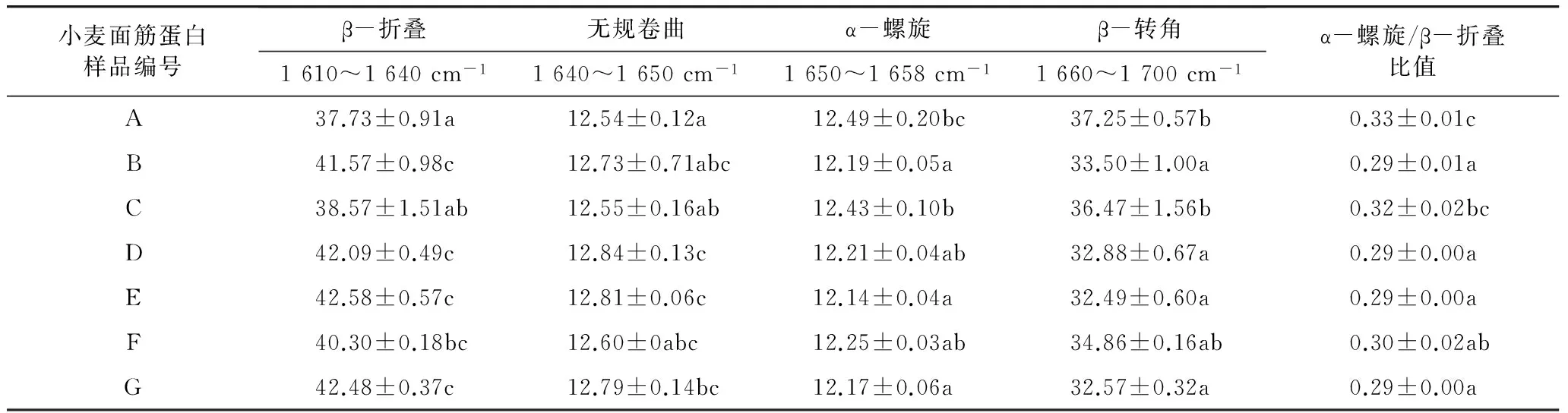
表2 超微粉碎處理前后小麥面筋蛋白二級結構變化
注:小寫字母表示5%水平上的差異顯著性。
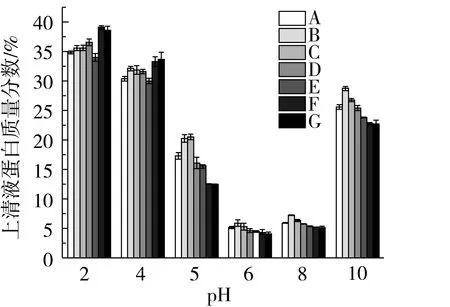
圖2 超微粉碎小麥面筋蛋白溶解度變化
2.5 超微粉碎處理對小麥面筋蛋白起泡性的影響
小麥面筋蛋白經超微粉碎處理后,起泡性發生了明顯的變化。從圖3分析結果可以看出,超微粉碎后小麥面筋蛋白的起泡能力和泡沫穩定性均得到顯著改善,起泡能力由對照樣品A的136%增加到196%(E);對照樣品A的泡沫穩定性為34%,經超微粉碎后最大可達54%(E)。但是,隨著小麥面筋蛋白粉體粒度的進一步減小,E、F和G之間的起泡能力和泡沫穩定性均無顯著變化(P<0.05)。

圖3 超微粉碎小麥面筋蛋白起泡性變化
2.6 超微粉碎處理對小麥面筋蛋白乳化性的影響
蛋白質的乳化性受自身溶解度、表面疏水性、二硫鍵和游離巰基及表面電荷分布等因素的影響[23]。Yalcin等[14]的研究表明,在中性pH條件下,小麥面筋蛋白的乳化活性和乳化穩定性均較低。因此,本研究在pH 4.0條件下,分析超微粉碎對小麥面筋蛋白乳化特性的影響規律。圖4列出了在pH 4.0下超微粉碎小麥面筋蛋白的乳化活性和乳化穩定性變化情況。隨著粉體粒度的減小,A、B、C三者之間的乳化活性和乳化穩定性并無顯著變化;但隨著粉體粒度的進一步減小,小麥面筋蛋白的乳化活性和乳化穩定性均顯著提高(P<0.05)。G的乳化活性最高,與對照樣品A相比,增加了6%;乳化穩定性則由對照樣品A的12.7%增加到樣品F的13.8%。
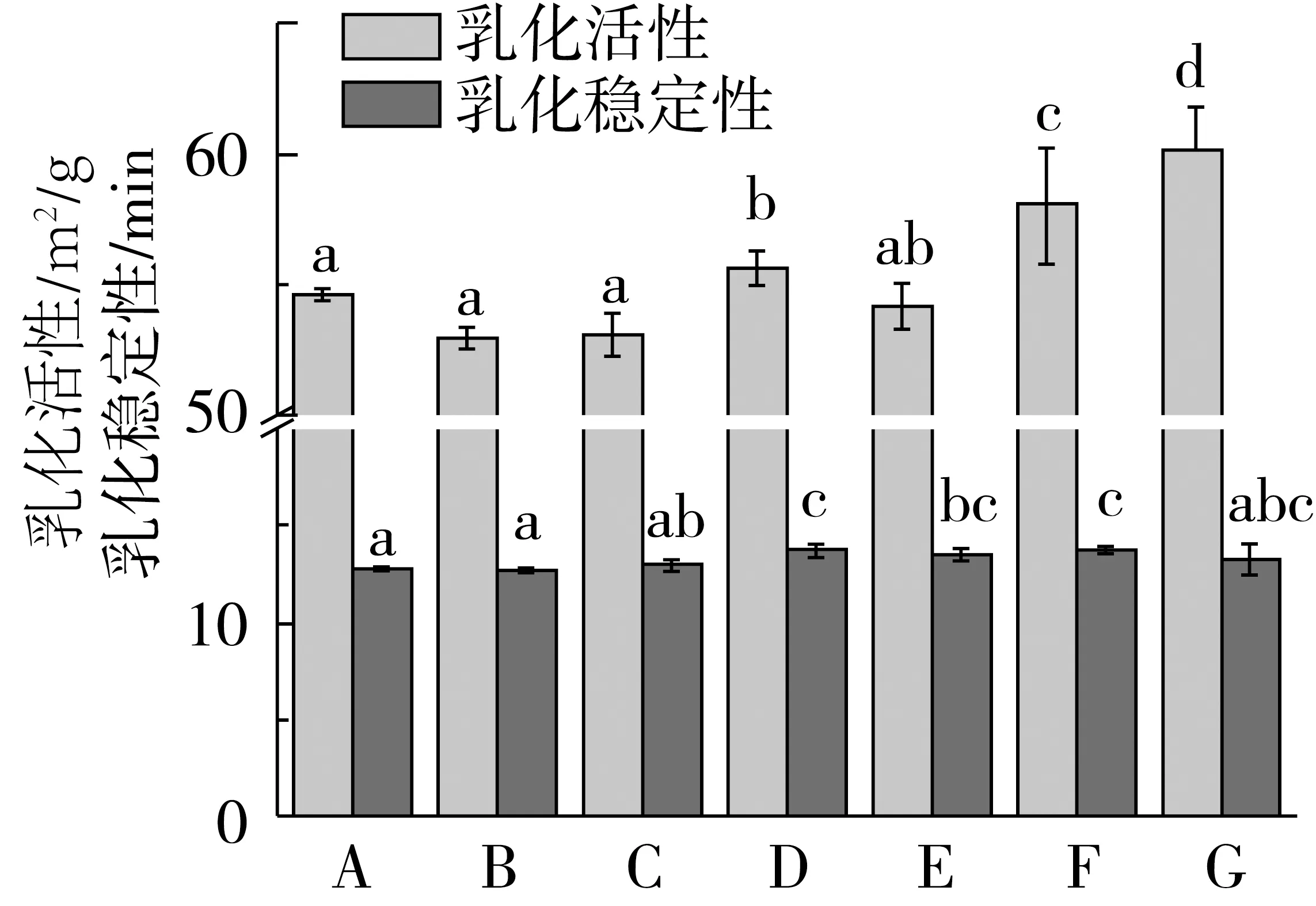
圖4 超微粉碎小麥面筋蛋白乳化性變化
3 討論
在超微粉碎過程中,粉碎腔內強大的氣流使小麥面筋蛋白顆粒、腔壁之間發生劇烈碰撞、摩擦,導致小麥面筋蛋白二級結構發生改變。蛋白質二級結構的變化直接影響到維持蛋白質高級結構的氫鍵、二硫鍵、疏水鍵等作用力[2]。FTIR分析結果顯示,超微粉碎后,小麥面筋蛋白的α-螺旋和β-轉角結構減小,相應地轉化為β-折疊或無規卷曲結構,分子柔性增加。因此,小麥面筋蛋白分子之間形成二硫鍵的可能性增加[24],這與超微粉碎后小麥面筋蛋白巰基含量隨粒度變化的分析結果吻合,即超微粉碎后小麥面筋蛋白的總游離巰基含量隨粒度的減小顯著地遞減。超微粉碎處理暴露了埋藏(或包裹)在蛋白分子內部的巰基,使大量巰基暴露于有氧環境中,從而使大量氧氣與小麥面筋蛋白暴露的巰基在氣流粉碎腔內充分接觸。當2個半胱氨酸殘基接近并適當定向時,分子氧可將巰基氧化形成二硫鍵,導致小麥面筋蛋白總巰基含量的降低,二硫鍵的形成有助于穩定蛋白質的折疊結構[25]。
游離巰基基團和二硫鍵是植物蛋白中重要的功能基團,其含量變化可反映蛋白的變性程度,對蛋白的功能性質有重要影響[26]。超微粉碎后,小麥面筋蛋白的溶解度得到一定改善,這是由于超微粉碎可以顯著增加其表面積,暴露出更多的極性基團,增加其與水的結合點[27]。但是,隨著粒度的進一步減小,小麥面筋蛋白通過-SH/-SS-相互轉化發生聚合,形成不溶的面筋蛋白大聚體,從而導致溶解度下降。蛋白質的溶解度對其乳化性、起泡性等功能特性具有重要影響。小麥面筋蛋白經過超微粉碎處理,隨其粒度的減小,有助于改善氣-水/油-水界面的相互作用,提高其溶解性,進而改善小麥面筋蛋白的起泡性和乳化性[28]。
4 結論
超微粉碎處理可以顯著提高小麥面筋蛋白分子的柔性,暴露出更多的埋藏(或包裹)于小麥面筋蛋白內的巰基,在有氧環境中促使暴露的巰基部分氧化成分子內或分子間二硫鍵,進而影響到小麥面筋蛋白的溶解度、起泡性和乳化性等功能特性的變化。當小麥面筋蛋白粉體粒度(D50)達到5 μm左右時,可顯著改善其乳化性、起泡性。因此,工業生產中可以通過采用超微粉碎處理的方法來改善小麥面筋蛋白的溶解度、乳化性和起泡性等功能特性,提高其工業應用價值。
[1]Liao L, Liu T X, Zhao M M, et al. Functional, nutritional and conformational changes from deamidation of wheat gluten with succinic and citric acid [J]. Food Chemistry, 2010, 123: 123-130
[2]Gennadios A, Weller C L. Edible films and coatings from wheat and corn proteins[J]. Food Technology, 1990, 44, 63-67
[3]Gontard N, Guilbert S, Cuq J L. Edible wheat gluten films: influence of the main process variables on film properties using response surface methodology[J]. Journal of Food Science,1992, 57, 190-195
[4]Zhu K X, Huang S, Peng W, et al. Effect of ultrafine grinding on hydration and antioxidant properties of wheat bran dietary fiber[J]. Food Research International. 2010,43(4): 943-948
[5]Carl M, Ramstad P E. The effect of ball-milling upon certain properties of proteins[J]. Biochemistry and Biophysics, 1953, 46(2): 376-384
[6]Zhao X Y , Yang Z B, Gai G S, et al. Effect of superfine grinding on properties of ginger powder[J]. Journal of Food Engineering, 2009, 91(2):217-222
[7]Sun C C, Wu T, Liu R, et al. Effects of superfine grinding and microparticulation on the surface hydrophobicity of whey protein concentrate and its relation to emulsions stability[J]. Food Hydrocolloids, 2015,51:512-518
[8]Hayakawa I,Yamada Y,Fujio Y. Microparticulation by jet mill grinding of protein powders and effects on hydrophobicity[J]. Journal of Food Science, 2006, 58(5):1026-1029
[9]關二旗. 超微粉碎對面粉理化特性影響的研究[D]. 鄭州:河南工業大學,2008 Guan Erqi. Study on the physicochemical properties of superfine grinding flour[D]. Zhengzhou: Henan University of Technology, 2008
[10]張慧,卞科,萬小樂. 超微粉碎對谷朊粉理化特性及功能特性的影響[J]. 食品科學,2010,31(1):127-131 Zhang Hui, Bian Ke, Wan Xiaole. Effect of ultrafine comminution on physico-chemical and functional properties of vital wheat gluten[J]. Food Science, 2010,31(1):127-131
[11]Hu H, Wu J H, Eunice C Y, et al. Effects of ultrasound on structural and physical properties of soy protein isolate(SPI) dispersions[J]. Food Hydrocolloids, 2013, 30: 647-655
[12]Dominique M R. Peter S B. Effects of temperature and water content on the secondary structure of wheat gluten studied by FTIR spectroscopy[J]. Biomacromolecules, 2006, (7): 469-475
[13]Kim S, Yang H J, Kwon D Y. Changes of glycinin conformation due to pH, heat and salt determined by differential scanning calorimetry and circular dichroism[J]. International Journal of Food Science & Technology,2004,39(4): 385-393
[14]Yalcin E, Sakiyan O, Sumnu G, et al. Functional properties of microwave-treated wheat gluten[J].European Food Research and Technology, 2008, 227: 1411-1417
[15]Yu L, Yang W Q, Sun J, et al. Preparation, characterisation and physicochemical properties of the phosphate modified peanut protein obtained fromArachinConarachinL[J]. Food Chemistry. 2015, 170:169-179
[16]Qiu C Y, Sun W Z, Zhao Q Z, et al. Emulsifying and surface properties of citric acid deamidated wheat gliadin[J]. Journal of Cereal Science, 2013, 58: 68-75
[17]Bao Y L, Per E. Relationship between oxygen concentration, shear force and protein oxidation in modified atmosphere packaged pork[J]. Meat Science, 2015,110:174-179
[18]Kaufman S, Hoseney R, Fennema O. Dough rheology-a review of structural models and the role of disulfide interchange reactions[J]. Cereal Foods World, 1986, 31:820-824
[19]廖蘭. 濕熱有機酸脫酰胺改性小麥面筋蛋白及作用機理的研究[D]. 廣州:華南理工大學,2011 Liao Lan. Study on the deamidation of wheat gluten by organic acids upon hydrothermal treatment and reaction mechanism[D]. Guangzhou: South China University of Technology, 2011
[20]郝保紅,姚斌,朱建斌,等. 粉碎過程中機械化學效應的形成發展與研究范疇[J]. 北京石油化工學院學報,1999,1(7):21-25 Hao Baohong, Yao Bin, Zhu Jianbin, et al. The formation, development and studying field of mecho-chemical effect in the grinding course[J]. Journal of Beijing Institute of Petro-Chemical Technology, 1999, 1(7):21-25
[21]Fennema O R.食品化學[M]. 王璋,許時嬰,江波,等譯. 第三版. 北京:中國輕工業出版社,2003:306-309 Fennema O R. Food Chemistry[M]. Wang Zhang, Xu Shiying, Jiang Bo, et translate. The third edition. Beijing: China Light Industry Press, 2003:306-309
[22]Wang J S, Wei Z Y, Li L, et al. Characteristics of enzymatic hydrolysis of thermal-treated wheat gluten[J]. Journal of Cereal Science, 2009, 50: 205-209
[23]尹壽偉,唐傳核,溫其標,等. 微射流處理對蕓豆分離蛋白構象和功能特性的影響[J]. 華南理工大學學報,2009,37(10):112-116 Yin Shouwei, Tang chuanhe, Wen Qibiao, et al. Effect of micro-fluidization treatment on conformationaland functional properties of kidney bean (Phaseolusvulgarisl) protein Isolates[J]. Journal of South China University of Technology, 2009, 37(10):112-116
[24]Luo Y, Li M, Zhu K X, et al.Heat-induced interaction between egg white protein and wheat gluten[J]. Food Chemistry, 2016, 197:699-708
[25]Srinivasan D. 食品化學[M]. 江波,楊瑞金,鐘芳,等譯. 第四版. 北京:中國輕工業出版社,2013:218-219 Srinivasan D. Food Chemistry[M]. Jiang Bo, Yang Ruijin, Zhong Fang, et translate. The fourth tdition. Beijing: China Light Industry Press, 2013:218-219
[26]涂宗財,張雪春,劉成梅,等. 超高壓微射流對花生蛋白結構的影響[J]. 農業工程學報,2008,24(8):306-308 Tu Zongcai, Zhang Xuechun, Liu Chengmei, et al. Effect of ultra-high pressure microfluidization on the structure of peanut protein[J]. Transactions of the CSAE, 2008, 24(8):306-308
[27]Zhu F M, Du B, Li R F, et al. Effect of micronization technology on physicochemical and antioxidant properties of dietary fiber from buckwheat hulls[J]. Journal of Food Engineering, 2014 (3):30-34
[28]Aluko R E, Olawunmi A. Mofolasayo, Beverley M W. Emulsifying and foaming properties of commercial Yellow Pea (PisumsativumL.) seed flours[J]. Journal of Agricultural and Food Chemistry, 2009, 57(20): 9793-9800.
Effects of Superfine Grinding Treatment on the Properties of Wheat Gluten
Guo Wuhan Guan Erqi Bian Ke
(College of Food Science and Technology, Henan University of Technology, Zhengzhou 450001)
The objective of this study is to investigate the effects of superfine grinding treatment on the structure and functional properties of gluten protein, to provide a theoretical basis for exploiting the application field of wheat gluten. Wheat gluten as raw material was comminuted into 6 different meshes by a airflow pulverization instrument, and the effects of superfine grinding treatment on gluten protein sulfhydryl content, secondary structure, solubility, foaming, emulsifying were researched using fourier transform infrared spectroscopy, uv-visible spectrophotometer, as well as conventional chemical analysis method. Results showed that, after superfine grinding treatment, wheat gluten powder particle size (D50) was decreased from 109.35 μm to 3.60 μm. With decreasing particle size of wheat gluten powder, total sulfhydryl content decreased significantly, and exposed sulfhydryl content increased firstly and then decreased. FTIR analysis showed that after superfine grinding treatment, β-sheet structure, random coil increased significantly, and flexibility of gluten improved. Protein functional properties analysis showed that the powder particle size decreases, the solubility of gluten significant changed, foaming and emulsifying properties were significantly improved, after superfine grinding treatment. Among them, the foaming ability, foam stability, emulsifying activity and emulsion stability increased by 50%, 20%, 6%, 1.1%, respectively. Therefore, superfine grinding treatment has a significant influence on the structure and function of wheat gluten. When the wheat gluten size was decreased to about 5 μm, its sulfhydryl content, solubility changed significantly, and protein flexibility, emulsifying and foaming properties improved significantly.
wheat gluten, superfine grinding, sulfydryl, secondary structural, functional properties
河南工業大學基本科研業務專項(2014YWQQ01),國家現代農業(小麥)產業技術體系建設專項(CARS-03),糧食公益性行業科研專項經費項目(201313005)
2015-10-20
郭武漢,男,1988年出生,碩士,谷物加工技術與理論
卞科,男,1960年出生,教授,谷物化學及農產品貯藏與加工工程
TS210.1
A
1003-0174(2017)05-0013-06

