右美托咪定對抑制單肺通氣再灌注炎性反應的影響分析
鐘惠 尹亞蘭 李英 祝國瓊 陳遠旭 黃飛
右美托咪定對抑制單肺通氣再灌注炎性反應的影響分析
鐘惠1尹亞蘭2李英1祝國瓊1陳遠旭1黃飛1
目的 探討右美托咪定對抑制單肺通氣(OLV)再灌注的炎性反應的影響。方法 選擇70例擇期行單肺機械通氣的手術患者作為研究對象,隨機分為2組(n=35):觀察組與對照組。觀察組在麻醉開始誘導前10 min,靜脈持續泵入負荷劑量右美托咪定1μg/kg,之后以0.5μg(kg·h)的速度泵注至手術結束。誘導采用咪達唑侖 、舒芬太尼、丙泊酚、順式阿曲庫銨靜脈注射。對照組給予靜脈滴注等容量 0.9%氯化鈉注射液,其余麻醉誘導與維持同觀察組。比較手術期間各時間點各指標的變化。結果 兩組患者手術結束時的MDA、TNF-a、IL-6、濃度均明顯高于麻醉誘導前,血清 SOD 活性低于麻醉誘導前,差異均有統計學意義(均P<0.05);觀察組手術結束時的 TNF-a 、IL-6、MDA 濃度均明顯低于對照組,血清 SOD 活性高于對照組,差異均有統計學意義(均P<0.05)。結論 右美托咪定可有效抑制OLV通氣再灌注的炎性反應,減輕 OLV時肺臟的缺血再灌注損傷,對肺臟可能具有積極保護作用。
右美托咪定;單肺通氣;再灌注損傷;炎性反應
近年來,單肺通氣(OLV)技術廣泛應用于胸外科手術,此方法有助于操作者術中獲得理想的手術視野提高手術成功率。由于OLV時肺萎縮 (復張)、血管內皮損傷、肺內通氣/血流比例失調,氧分子對肺組織產生氧化應激損傷,炎癥因子釋放、炎癥細胞激活,引發急性肺損傷、急性呼吸窘迫綜合征甚至多器官功能障礙綜合征等癥狀出現[1-2]。而麻醉藥物可抑制缺氧性肺血管收縮(HPV),改善肺組織內通氣/血流比例平衡紊亂[3]。本文主要探討右美托咪啶對單肺通氣患者肺缺血- 再灌注的影響。
資料與方法
一、一般資料
本研究經醫院倫理委員討論通過,術前向患者及家屬進行知情告知。自2014年2月至2016年7月擇期行單肺通氣的手術70例納入研究對象,排除有嚴重心腦血管、內分泌及免疫系統疾病患者。在本次手術之前均未用過抗生素、未接受化療,肺功能各項指標均正常,其中男39例,女31例,年齡37-65歲,平均年齡為(53. 6±7.3) 歲,ASA 分級:Ⅰ級 30例,Ⅱ級40例。隨機分為2組(n=35):觀察組與對照組。兩組一般資料比較差異無統計學意義(P>0.05)。
二、麻醉方法
入室后連接靜脈通道,常規監測無創血壓 (NIBP)、氧飽和度 (SpO2)、心電圖(ECG)。觀察組在麻醉開始誘導前10 min,靜脈持續泵入負荷劑量右美托咪定1μg/kg,之后以0.5μg/(kg·h)的速度輸注至手術結束,對照組輸注等容量0.9%氯化鈉注射液(NS)。兩組麻醉誘導方式相同:咪達唑侖0.04mg/kg 、舒芬太尼0.5ug/kg、丙泊酚2mg/kg、順式阿曲庫銨0.2mg/kg 依次靜脈注射。置入雙腔氣管導管,纖支鏡定位后接麻醉機控制通氣。隨即橈動脈、中心靜脈穿刺置管行有創血壓監測。兩組術中均采用靜吸復合維持麻醉,吸入七氟烷1%-2%,泵注丙泊酚 2-4mg/(kg·h)、瑞芬太尼 0.05-0.15u g/(kg·min),順式阿曲庫銨 3-4ug/(kg·min)。連接腦電雙頻指數(BIS),維持 BIS值在45-55。設定呼吸參數:雙肺通氣吸入氧濃度100%、潮氣量10mL/kg,頻率為10-12次/min,呼吸比為 1:2。單肺通氣(OLV)后呼吸頻率較雙肺通氣增加20%,術中根據血氣分析調整呼吸參數。
三、觀察指標
記錄各組手術部位、單肺通氣時間、手術時間 。采集各組患者麻醉誘導前 (T0),單肺通氣后30min(T1)、 60 min(T2)和術畢(T3)外周靜脈血。檢測患者不同時間點超氧化物歧化酶(SOD)水平、血清丙二醛(MDA)濃度、白細胞介素6(IL-6)及腫瘤壞死因子α(TNF-a)的濃度。
四、統計學方法
結 果
一、各組年齡、體重指數(BMI)等一般資料及手術部位、單肺通氣時間(OLV)、手術時間比較差異均無統計學意義,均P>0.05,(見表1)。
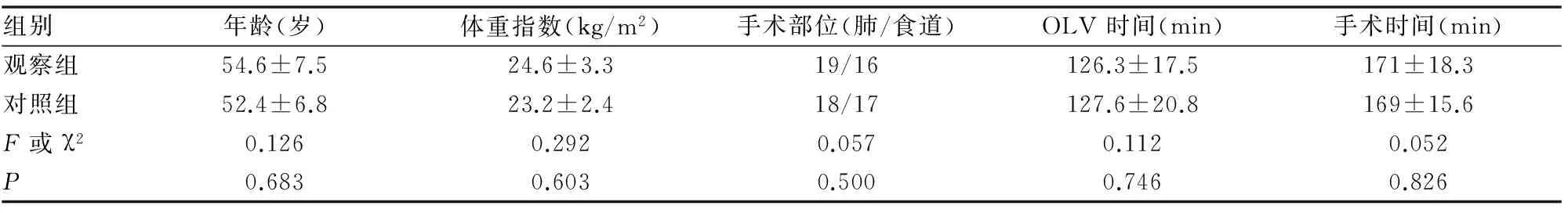
表1 兩組一般情況及OLV時間、手術時間比較
注:P值均>0.05,無顯著性差異。
二、兩組手術指標
組內比較:T2、T3時兩組患者MDA 濃度較T0及T1升高、血清 SOD 活性低于T0及T1時,差異明顯(P<0.05);T1、T2、T3兩組患者TNF-a、 IL-6濃度較T0升高(P<0.05)。組間比較:T2、T3時觀察組SOD 活性高于對照組,MDA、TNF-α、IL-6濃度低于對照組(P<0.05或P<0.01),且T1同時點比較 TNF-α、IL-6的濃度差異顯著,P<0.01。(見表2)。
討 論
胸科手術多采用單肺通氣(OLV)技術,非通氣側肺萎陷,致術中通氣血流比例失調,肺內分流增多,肺泡-動脈血氧分壓差增加,動脈血氧分壓降低。萎陷側肺組織部分肺上皮細胞線粒體損傷,變性,ATP合成受限,鈣穩態失衡,氧化應激產物積聚,易發生急性肺損傷。導致OLV過程中發生急性肺損傷(ALI)的重要機制包括急性氧化應激反應及低氧血癥[4]。
OLV進行胸科手術時,非通氣側肺在術中處于萎陷狀態,手術結束時需進行膨肺。在肺萎陷時,肺組織缺血缺氧,黃嘌呤大量堆積,ATP減少,氧自由基清除系統功能下降;膨肺再灌注,萎陷肺組織恢復正常氧供時,氧分子大量進入肺組織,在黃嘌呤轉化生成尿酸時釋放的大量氧自由基并堆積,導致肺發生過氧化反應,血栓素、白三烯C4等花生四烯酸代謝產物增加并參與炎癥反應,促成肺缺血再灌注損失(lung ischemia-reperfusion injury,LIRI)的發生[5-6]。有動物實驗表明,鹽酸右美托咪定(DEX)通過降低Toll樣受體(TLR)-4mRNA、核因子(NF)-KB mRNA的表達,調控TLR/NF-KB信號通路的轉導減少炎癥介質的的合成、釋放[7-8]。OLV時缺氧性肺血管收縮(HPV)是肺循環維持PaO2、防止低氧血癥的代償反應。HPV 與鉀離子通道關系密切,DEX能抑制 KATP功能[9]。FIGURA等[10]研究也證實阻斷KATP對白細胞聚集及缺血-再灌注損傷有抑制作用。DEX能減少NF-KB的激活及抑制術中IL-6、TNF-α釋放[11]。DEX通過抑制KATP的Kir6.0亞單位,促使Ca2+內流,加強肺血管平滑肌收縮,促進HPV的發生,減少分流,延長肺內分流達峰時間,實現對肺組織缺血-再灌注損傷的保護作用[9]。在OLV時肺上皮受到機械刺激后產生大量炎癥因子,炎癥因子的釋放介導了對肺上皮細胞的損傷。DEX抗氧化應激的作用,對肺上皮細胞具有保護作用,能減輕肺臟缺血再灌注損傷[12]。DEX作為高選擇性α2腎上腺素能受體激動劑,能降低交感神經活性,從而降低機體的應激反應。同時DEX的抗炎作用可抗細胞凋亡、增強巨噬細胞作用,對中性粒細胞的趨化吞噬作用、超氧陰離子的產生無明顯影響,可通過保持自然殺傷細胞的活性,降低TNF-a和IL-6的水平抑制內毒素炎癥反應[13-14]。
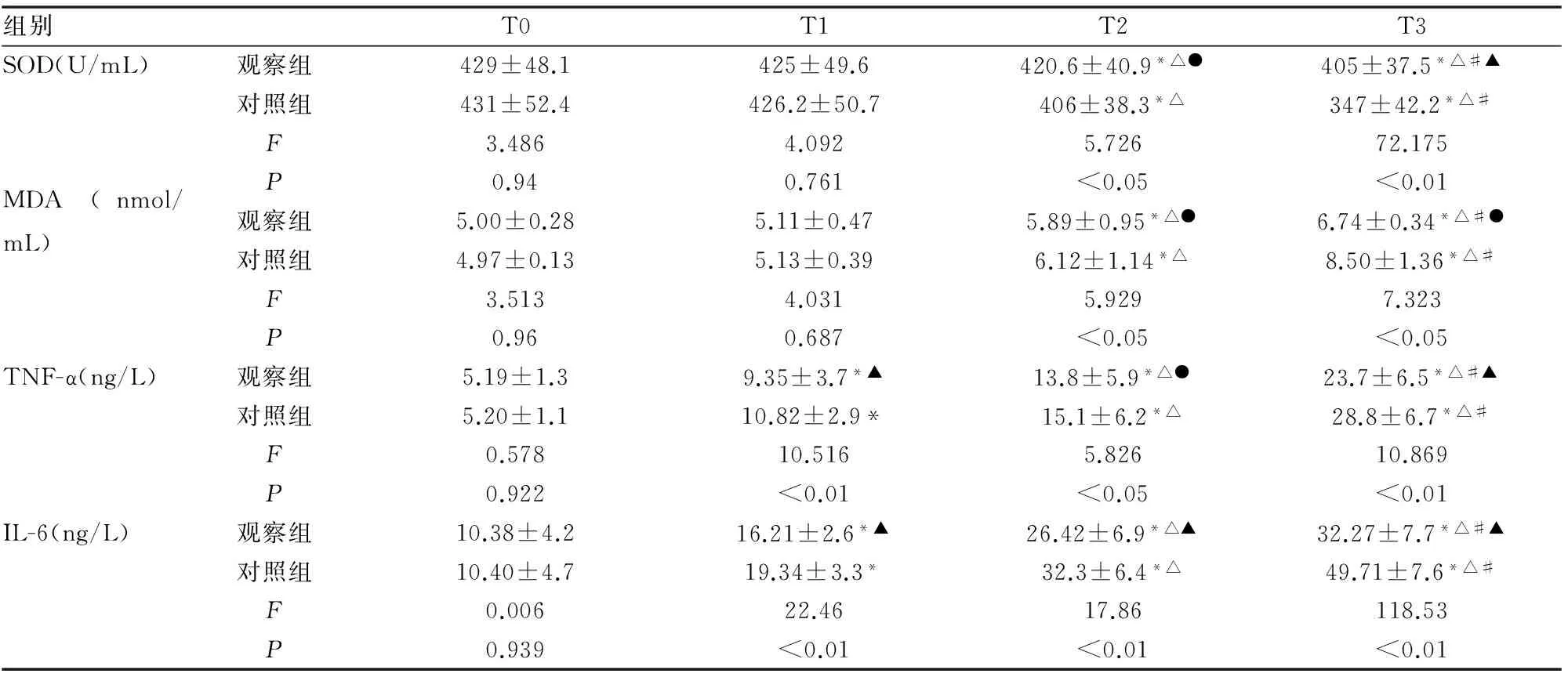
表2 兩組不同時點SOD、MDA 濃度、TNF-a和IL-6濃度的比較
注:組內※與T0比較,△與T1比較,#與T2比較P均<0.05;組間比較●P<0.05,▲P<0.01。
IL-6、IL-8、TNF-α等因子的血清水平可反映肺組織的炎性反應程度[15-16]。本研究結果顯示,手術結束時觀察組患者TNF-a、IL-6 濃度低于對照組,考慮與DEX對單肺通氣時肺組織炎癥的抑制作用有關。本研究的所有患者在OLV 60min及手術結束時SOD 活性低于T0時,MDA 濃度高于T0時,考慮患者在OLV過程中存在氧化應激損傷。觀察組OLV 60min及手術結束時SOD 活性高于對照組,MDA低于對照組,考慮與DEX減輕缺血-再灌注損傷、降低氧化應激程度及肺保護等作用有關。本研究由于臨床試驗的局限性和樣本量有限,以及HPV產生機制較復雜,DEX在臨床上確切的保護機制需要做更進一步的基礎實驗。
綜上所述,通過本實驗發現DEX可有效抑制OLV通氣再灌注的炎性反應,減輕 OLV時肺臟的缺血再灌注損傷,對肺臟可能具有積極保護作用。
[1] 藍嵐.單肺通氣時間對肺損傷的影響[D]. 南方醫科大學,2012.
[2] Robertson JA,Sauer D,Gold JA,et al.The role of cyclooxygenase-2 in mechanical ventilation-induced lung injury[J].Am J Respir Cell Mol Biol,2012,47(3):387-394.
[3] 王明宇,侴偉平.單肺通氣時不同潮氣量變化對呼吸力學及血氣的影響研究[J].臨床肺科雜志,2013,18(1):147-148.
[4] 王秋蘭,田友芳,姚猛飛,等.右美托咪定聯合地塞米松對單肺通氣手術患者的肺保護作用[J].重慶醫學,2015,44(34):4832-4834.
[5] Gu J,Sun P,Zhao H,et al.Dexmedetomidine provides renoprotection against ischemia-reperfusion injury in mice[J].Crit Care,2011,15(3):R153.
[6] Haddad JJ,Olver RE,Land SC.Antioxidant/pro-oxidant equilibrium regulates HIF-1alpha and NF-kappa B redox sensitivity. Evidence for inhibition by glutathione oxidation in alveolar epithelial cells[J].J Biol Chem,2000,275(28):21130-21139.
[7] 蔣鵬,黃祥君,趙明,等.鹽酸右美托咪定對缺血-再灌注損傷大鼠心肌 Toll 樣受體 4/核因子-κB 信號通路的作用[J]. 臨床麻醉學雜志,2014,30(3):294-296.
[8] Wu Y,Liu Y,Huang H,et al.Dexmedetomidine inhibits inflammatory reaction in lung tissues of septic rats by suppressing TLR4/NF-κB pathway[J].Mediators Inflamm,2013,2013:562154.
[9] Kawano T,Yamazaki F,Chi H,et al.Dexmedetomidine directly inhibits vascular ATP-sensitive potassium channels[J].Life Sci,2012,90(7):272-277.
[10] Figura M,Chilton L,Liacini A,et al.Blockade of KATP channels reduces endothelial hyperpolarization and leukocyte recruitment upon reperfusion after hypoxia[J].Am J Transplant,2009,9(4):687-696.
[11] 張麗麗,張野,李云,等.右美托咪定對食管癌根治術患者單肺通氣時肺內分流及動脈氧分壓的影響[J].安徽醫科大學學報,2014,49(9):1291-1294.
[12] Yagmurdur H,Ozcan N,Dokumaci F,et al.Dexmedetomidine reduces the ischemia-reperfusion injury markers during upper extremity surgery with tourniquet[J].J Hand Surg Am,2008,33(6):941-947.
[13] Sanders RD,Maze M.Alpha2-adrenoceptor agonists[J].Curr Opin Investig Drugs,2007,8(1):25-33.
[14] Yang CL,Tsai PS,Huang CJ.Effects of dexmedetomidine on regulating pulmonary inflammation in a rat model of ventilator-induced lung injury[J].Acta Anaesthesiol Taiwan,2008,46(4):151-159.
[15] Patel BV,Wilson MR,O’Dea KP,et al.TNF-induced death signaling triggers alveolar epithelial dysfunction in acute lung injury[J].J Immunol,2013,190(8):4274-4282.
[16] Sharma AK,Mulloy DP,Le LT,et al.NADPH oxidase mediates synergistic effects of IL-17 and TNF-α on CXCL1 expression by epithelial cells after lung ischemia-reperfusion[J].Am J Physiol Lung Cell Mol Physiol,2014,306(1):L69-L79.
Influence analysis of dexmedetomidine on refraining single lung ventilation reperfusion inflammatory reaction
ZHONG Hui, YIN Ya-lan, LI Ying, ZHU Guo-qiong, CHEN Yuan-xu, HUANG Fei
Department of Anesthesiology, the Seventh People’s Hospital of Chengdu, CHengdu, Sichuan 610041, China
Objective To discuss the influence of dexmedetomidine on refraining single lung ventilation reperfusion (OLV) inflammatory reaction. Methods 70 cases undergoing elective one lung mechanical ventilation were taken as the research objects, and they were randomly divided into 2 groups (n=35). In the observation group, 10 minutes before induction of anesthesia, dexmedetomidine was continuously pumped into vein with the loading dose of 1.0 μg/kg, and then the speed was adjusted to 0.5 μg/(kg·h) to the end of surgery. The induction of anesthesia was successively injected into vein with midazolam, sufentanil, propofol and cisatracurium. The control group were treated with intravenous injection of equal volume of 0.9% sodium chloride injection. The other methods of induction of anesthesia and maintenance were the same as the observation group. The change of the indexes at each time point during the operation was compared. Results The concentration of MDA, TNF-a and IL-6 in the two groups were significantly higher than before the induction of anesthesia, and the activity of serum SOD was lower than before the induction of anesthesia (allP<0.05). At the end of the surgery, the concentration of MDA, TNF-a and IL-6 in the observation group was significantly lower than that in the control group, and the activity of serum SOD was higher than in the control group (allP<0.05). Conclusion The dexmedetomidine can effectively restrain the inflammatory reaction from OLV ventilation reperfusion and reduce lung ischemia-reperfusion injury when OLV, which may have a positive protective effect on lung.
dexmedetomidine; one lung ventilation; re-perfusion injury; inflammatory reaction
10.3969/j.issn.1009-6663.2017.08.033
1. 610041 四川 成都,成都市第七人民醫院麻醉科 2. 610023 四川 攀枝花,攀鋼總醫院麻醉科
2016-12-14]

