乙型肝炎肝硬化患者發生食管胃靜脈曲張破裂出血的危險因素分析
王宛明
乙型肝炎肝硬化患者發生食管胃靜脈曲張破裂出血的危險因素分析
王宛明
目的探索乙型肝炎肝硬化患者發生食管胃靜脈曲張破裂出血的危險因素。方法選取2014年10月—2016年6月因乙型肝炎肝硬化并發食管胃靜脈曲張來我院進行治療的患者165例,根據就診當天是否發生破裂出血分為出血組和非出血組,分析該類患者破裂出血的危險因素。結果單因素分析結果顯示:2組患者在年齡、性別和WBC計數方面的差異無統計學意義(P>0.05),出血組患者HGB、PT明顯高于非出血組,而PLT明顯低于非出血組,差異有統計學意義(P<0.05);出血組患者中肝功能Child-Pugh評分C級患者、重度食管胃靜脈曲張患者及中重度腹水患者明顯多于未出血組,2組患者在肝功能Child-Pugh評分、食管胃靜脈曲張和腹水嚴重程度上的差異有統計學意義(P<0.05)。多因素分析結果顯示:肝功能Child-Pugh評分、PLT、腹水、門靜脈內徑和感染是發生破裂出血的危險因素,其中腹水嚴重程度是最主要的獨立危險因素。結論肝功能Child-Pugh分級較低、PLT較低、腹水較嚴重、門靜脈內徑較大和出現感染是乙型肝炎肝硬化患者發生食管胃靜脈曲張破裂出血的危險因素,臨床上須盡早進行對癥治療,預防破裂出血的發生。
乙型肝炎肝硬化;食管胃靜脈曲張;破裂出血;危險因素
慢性肝病最終會發展為肝硬化,而肝硬化會導致很多并發癥的出現,如食管胃靜脈曲張、門靜脈高壓、肝性腦病等[1]。其中食管胃靜脈曲張破裂出血的發生率和病死率均較高,是消化科常見的急重癥。有研究指出,首次發生食管胃靜脈曲張破裂出血的致死率大約為25%~50%,并且再次出血風險可達58%[2-4]。我國是世界上乙型肝炎患者人數最多的國家,所以乙型肝炎感染導致的肝硬化患者人數最多,此類患者中出現食管胃靜脈曲張破裂出血的風險較高[5]。因此對乙型肝炎肝硬化患者發生食管胃靜脈曲張破裂出血的危險因素進行分析,可盡早的進行相應的預防和干預,從而降低因食管胃靜脈曲張破裂出血而發生危險的可能性[6]。本研究即主要探索分析乙型肝炎肝硬化患者并發食管胃靜脈曲張破裂出血的危險因素,現報告如下。
1 對象與方法
1.1 對象 選取2014年10月—2016年6月因乙型肝炎肝硬化并發食管胃靜脈曲張來濮陽市人民醫院進行治療的患者165例,根據就診當天是否發生破裂出血分為出血組和非出血組,分析導致食管胃靜脈破裂出血的危險因素。所有患者的診斷標準均符合《肝硬化門靜脈高壓食管胃靜脈曲張出血的防治指南》[7]。納入標準:患者既往有乙型肝炎病史,臨床癥狀常伴有嘔血、黑便、心悸、頭暈、暈厥、皮膚濕冷、血壓下降等,行CT或MRI檢查確定為食管胃靜脈曲張,出血組為最終胃鏡檢查確定有靜脈曲張破裂出血的患者。排除標準:①伴有嚴重的心血管疾病或其他器質性疾病患者;②患免疫系統嚴重疾病、認知功能喪失患者;③有精神病史、神經系統疾病患者等。由于2組中均有個別患者的相關記錄不清或缺失,最終錄得出血組74例,非出血組82例。
1.2 方法 詳細記錄患者的一般資料,包括年齡、體質量和確診乙型肝炎的時間,以及患者就診時的主要臨床癥狀、生化檢查和心電圖檢查結果等。并在患者就診1周、2周、1個月和3個月后進行隨訪,記錄患者嘔血、黑便、頭暈、心悸等臨床癥狀及生化指標。
在清晨空腹狀態下,抽取患者靜脈血,使用羅氏自動生化分析儀對患者進行血清白蛋白檢測和血常規檢查;同時在獲得患者或家屬知情同意后,行腹腔穿刺術,測定腹腔積液白蛋白的含量;使用美國進口的GE彩色多普勒測量患者的脾臟大小和門靜脈內徑(partal vein diameter, PVD)。其中血清-腹腔積液白蛋白梯度(serum-peritoneal effusion albumin gradient, SAAG)=血清白蛋白-腹腔積液白蛋白[8]。食管胃靜脈曲張出血后的感染癥狀包括發熱、菌血癥等。
使用Child-Pugh分級標準對患者是否有肝性腦病、腹腔積液狀況、血清TBIL水平、血清白蛋白水平和PT等5個指標進行記分累加,來評估患者的肝功能狀況。
1.3 統計學處理 本研究數據均采用SPSS 21.0統計軟件進行分析處理,計量資料呈正態分布或近似正態分布,用±s表示。計量資料之間比較采用獨立樣本t檢驗,計數資料比較用χ2檢驗。采用多因素Logistic回歸分析破裂出血的危險因素。P<0.05表示差異有統計學意義。
2 結 果
2.1 2組患者的一般資料和輔助檢查結果比較 2組患者的年齡和性別差異無統計學意義(P>0.05);2組患者在肝功能Child-Pugh評分、食管胃靜脈曲張和腹水嚴重程度上的差異具有統計學意義(P均<0.05),出血組中肝功能Child-Pugh評分C級患者、重度食管胃靜脈曲張患者及中重度腹水患者比例均高于未出血組。詳見表1。
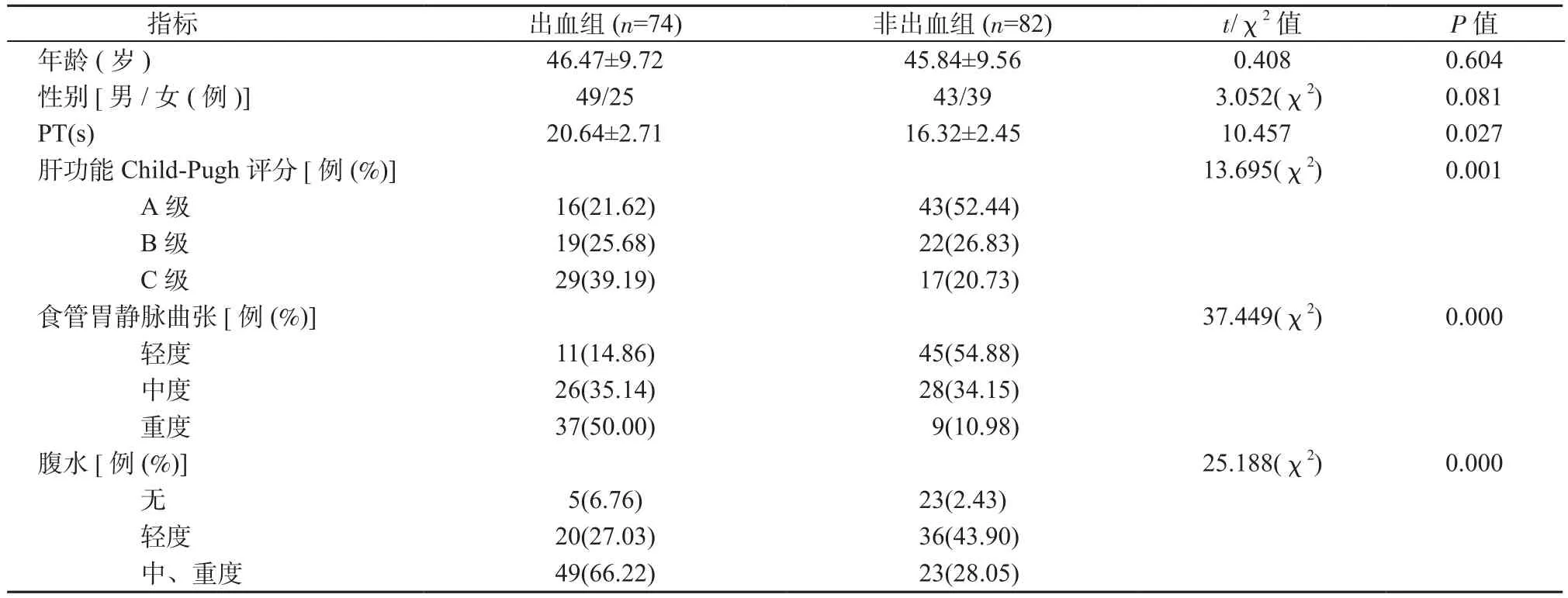
表1 2組患者的一般資料和輔助檢查結果比較Table 1 Comparison of general data and secondary examination results between 2 groups
2.2 2組患者的SAAG、PVD和PLT/S-D比較 出血組患者的SAAG和PVD顯著高于非出血組,PLT與脾長徑比值(PLT/spleen diameter, PLT/S-D)顯著低于非出血組,差異有統計學意義(P<0.05)。詳見表2。
2.3 乙型肝炎肝硬化伴有食管胃靜脈曲張破裂出血患者的多因素Logistic分析 以患者是否出血為因變量,HGB、PLT、PT、SAAG、PVD、PLT/S-D、肝功能Child-Pugh評分、食管胃靜脈曲張程度、腹水程度、感染等可能與出血相關的因素為自變量進行多因素非條件Logistic回歸分析,變量賦值情況見表3。采用Forward法建立模型,確定α=0.20,將HGB、PLT、PT、SAAG、PVD、PLT/S-D直接納入模型,肝功能Child-Pugh評分、食管胃靜脈曲張程度、腹水程度、感染均以啞變量的形式納入模型,參照組為自變量第1個值。
多因素分析結果顯示:肝功能Child-Pugh評分、PLT、腹水程度、食管胃靜脈曲張程度、門靜脈內徑和感染是發生破裂出血的危險因素,其中腹水程度是最主要的獨立危險因素,結果見表4。
表2 2組患者的SAAG、PVD和PLT/S-D測量值比較(±s)Table 2 Comparison of SAAG, PVD and PLT/S-D measurements between 2 groups(±s)

表2 2組患者的SAAG、PVD和PLT/S-D測量值比較(±s)Table 2 Comparison of SAAG, PVD and PLT/S-D measurements between 2 groups(±s)
組別 例數 SAAG(g/L) PVD(mm) PLT/S-D(×109個/mm)出血組 74 23.46±3.46 16.32±2.57 0.53±0.25非出血組 82 18.94±2.85 11.46±1.82 1.26±0.43 t值 8.938 13.731 12.782 P值 0.023 0.036 0.011
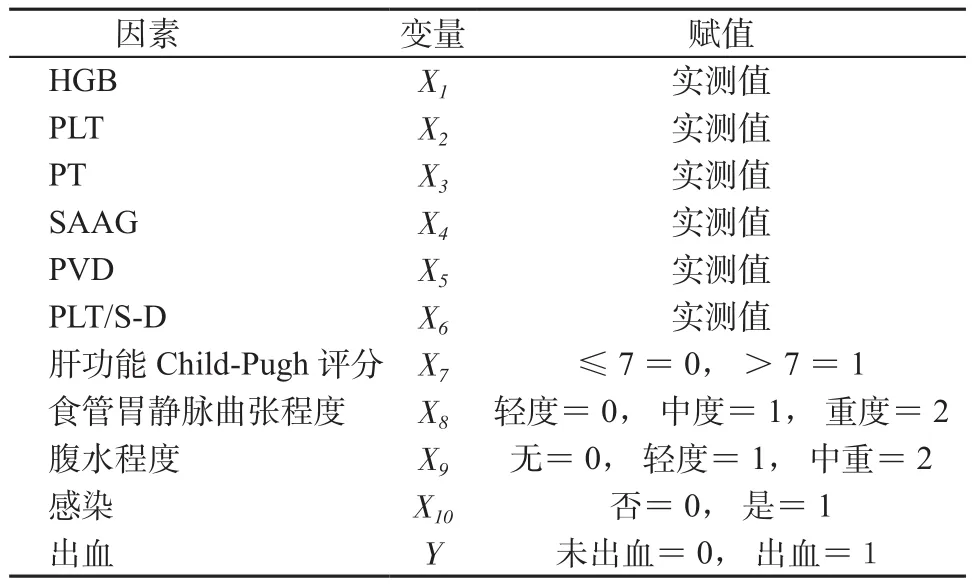
表3 出血相關因素及賦值Table 3 Bleeding related factors and assignments
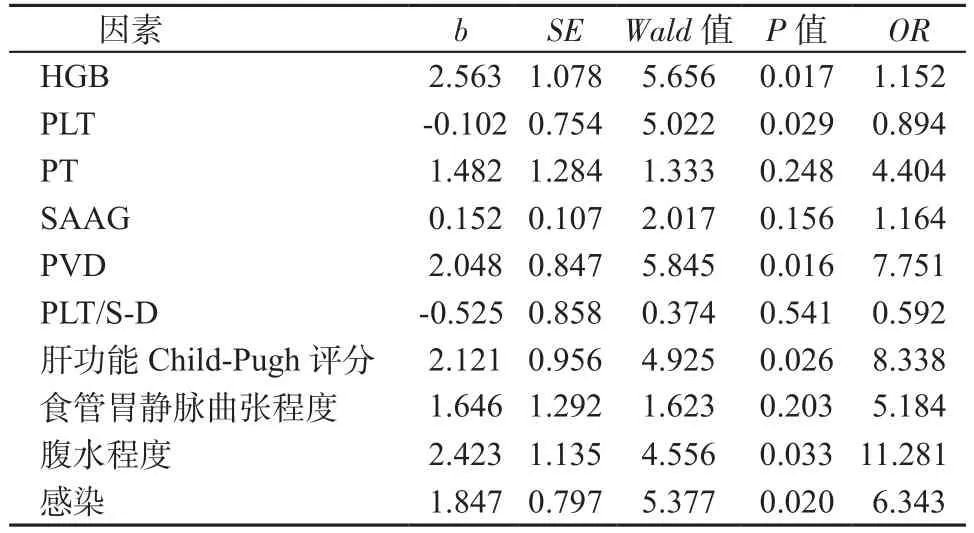
表4 出血組危險因素的多因素Logistic回歸分析Table 4 Multivariate Logistic regression analysis of risk factors in bleeding group
3 討 論
肝硬化患者合并上消化道出血大多數是由于食管胃靜脈曲張破裂造成的,起病較急,出血量大,很容易阻塞呼吸道,造成誤吸,從而導致失血性休克、肝性腦病及感染的發生[9]。食管胃靜脈曲張破裂主要原因是肝內血液循環不暢,門靜脈壓力過高。此時,食管胃曲張靜脈在內鏡狀態下呈現出靜脈直徑較大、嚴重曲張的狀態[10]。內鏡檢查可以很好的預測患者食管胃靜脈曲張破裂出血的風險。但該檢查操作較為復雜,且還有部分患者因各種原因不愿進行內鏡檢查,臨床上仍需其他更方便的檢查來評價患者的病情[11]。因此,本研究即主要探索肝硬化合并食管胃靜脈曲張患者靜脈破裂出血的危險因素。
本研究發現2組患者的HGB、PLT、PT、肝功能Child-Pugh評分、食管胃靜脈曲張和腹水嚴重程度等指標差異顯著。與非出血組相比,出血組的HGB降低,PLT和PT均增加,肝功能評分較低,腹水嚴重,說明出血組的肝功能狀況更差,出血會造成血生化指標的較大變化。另外出血組的SAAG和PVD顯著高于非出血組,PLT/S-D顯著低于非出血組,說明出血組患者的血清白蛋白顯著降低,門靜脈壓力增高明顯,脾臟出現充血變大。通過統計分析發現,患者肝功能的Child-Pugh分級、PLT、腹水、PVD和感染是發生食管胃靜脈曲張破裂出血的危險因素,說明這些指標因素能夠很好的預測肝硬化合并食管胃靜脈曲張患者發生破裂出血的風險。在臨床上應該重點關注此類患者的相關指標變化,根據患者出現的危險因素,立即采取相應的干預措施,最大程度的避免不良事件的發生。這不僅能夠有效提高患者的救治效果,還能減輕家屬和醫院的醫療負擔,具有較高的臨床價值[12]。
另外,本研究中樣本量較小,主要關注乙型肝炎肝硬化患者并發食管胃靜脈曲張破裂出血的危險因素分析,并且觀察時間較短,缺少隨訪追蹤等。在今后的研究中我們將進一步擴大樣本量,完善研究方法和流程,從多角度對乙型肝炎肝硬化患者并發食管胃靜脈曲張破裂出血的危險因素分析進行觀察和評估,為實際臨床工作提供借鑒和參考。
[1] 楊少奇,劉云霞,閃明海,等. 肝硬化食管胃靜脈曲張破裂出血危險因素分析[J]. 中華消化內鏡雜志,2013,30(2):71-74.
[2] 陳輝,何創業,韓國宏. 肝硬化門靜脈血栓預防和治療進展[J].中華消化雜志,2014,34(1):7-10.
[3] Suhocki PV, Lung Ren MP, Kapoor B, et al. Transjugular intrahepatic portosystemic shunt complications: prevention and management[J]. Semin Intervent Radiol, 2015, 32(2):123-132.
[4] 陳雷,朱繼業. 門靜脈高壓癥食管胃底曲張靜脈破裂出血的緊急手術處理[J]. 肝膽外科雜志,2006,14(5):325-327.
[5] 李路豪,黨曉衛,許培欽. 術中門靜脈壓力測定對門靜脈高壓癥手術方式選擇的意義[J]. 中國普通外科雜志,2014,23(7):972-975.
[6] Orloff MJ, Hye RJ, Wheeler HO, et al. Randomized trials of endoscopic therapy and transjugular intrahepatic portosystemic shunt versus portacaval shunt for emergency and elective treatment of bleeding gastric varices in cirrhosis[J]. Surgery, 2015, 157(6):1028-1045.
[7] 中華醫學會肝病學分會,中華醫學會消化病學分會,中華醫學會內鏡學分會. 肝硬化門靜脈高壓食管胃靜脈曲張出血的防治指南[J]. 臨床肝膽病雜志,2016,32(2):203-219.
[8] 劉桂勤,華靜,沈加林. CT門靜脈血管成像預測肝硬化門靜脈高壓食管胃靜脈曲張破裂出血價值[J]. 中華實用診斷與治療雜志,2015,29(4):396-398.
[9] 李立彬. 肝硬化合并食管胃靜脈曲張破裂出血患者相關危險因素分析[J]. 陜西醫學雜志, 2014,43(4):474-475.
[10] Hobolth L, Bendtsen F, Hansen EF, et al. Effects of carvedilol and propranolol on circulatory regulation and oxygenation in cirrhosis: a randomisedstudy[J]. Dig Liver Dis, 2014, 46(3):251-256.
[11] 熊高飛,江堤,劉玉杰,等. 肝硬化并發上消化道出血的相關因素分析[J]. 中國醫藥導刊,2014,16(2):332-333.
[12] 程慧楨,王鳳霞,崔海彬,等. 肝硬化門靜脈高壓食管胃靜脈曲張出血的防治[J]. 中國臨床醫生,2013,41(8):7-8.
(2017-02-16收稿 2017-05-27修回)
(本文編輯 趙雅琳)
Risk factors of esophageal variceal bleeding in patients with hepatitis B cirrhosis
WANG Wan-ming*
Department of Gastroenterology, The People′s Hospital of Puyang, 457000, China *Corresponding author, E-mail: kvxu_388@163.com
ObjectiveTo explore the risk factors of esophageal and gastric varices bleeding in patients with hepatitis B cirrhosis.MethodsA total of 165 patients with hepatitis B cirrhosis esophageal varices in our hospital from October 2014 to June 2016 were included in this study. According to the presence of bleeding at the visit day, patients were divided into bleeding group and non-bleeding group. The risk factor of rupture bleeding was analyzed.ResultsOne-way analysis of variance showed that there were no significant differences in the age, gender and white blood cells between the 2 groups (P> 0.05). HGB and PT levels in the bleeding group were obviously higher than those in non-bleeding group, while PLT level was significantly lower (P<0.05). Patients with liver function Child-Pugh C level, with severe stomach esophagus varicosity, and with moderately severe ascites in the bleeding group were significantly more than those in non-bleeding group, with significant differences in Child-Pugh score, esophageal and gastric varices, and ascites (P<0.05). Multi-factor analysis showed that liver function Child-Pugh score, platelet count, ascites, portal vein diameter and infection were risk factors for bleeding. Among them ascites was the most important independent risk factor.ConclusionsLow Child-Pugh classification of liver function, low platelet count, severe ascites, large portal vein diameter and infection are high risk factors of rupture hemorrhage in patients with hepatitis B cirrhosis, esophageal and gastric varices. Clinical treatment should be given as soon as possible to prevent rupture bleeding.
hepatitis B cirrhosis; esophageal gastric varices; rupture bleeding; risk factors
R575.2;R571.3
A
1007-8134(2017)03-0164-04
10.3969/j.issn.1007-8134.2017.03.010
457000,濮陽市人民醫院消化科(王宛明)
王宛明,E-mail: kvxu_388@163.com

