不同部位鰈魚皮酸溶性膠原蛋白的提取及其特性
蔡路昀,馬 帥,曹愛玲,李秀霞,張宇昊,趙國華,趙元暉,林 洪,勵建榮,*
(1.西南大學食品科學學院,重慶 400715;2.渤海大學食品科學與工程學院,生鮮農產品貯藏加工及安全控制技術國家地方聯合工程研究中心,遼寧省食品安全重點實驗室,遼寧 錦州 121013;3.蕭山出入境檢驗檢疫局,浙江 杭州 311208;4.中國海洋大學食品科學與工程學院,山東 青島 266100)
不同部位鰈魚皮酸溶性膠原蛋白的提取及其特性
蔡路昀1,2,馬 帥2,曹愛玲3,李秀霞2,張宇昊1,趙國華1,趙元暉4,林 洪4,勵建榮2,*
(1.西南大學食品科學學院,重慶 400715;2.渤海大學食品科學與工程學院,生鮮農產品貯藏加工及安全控制技術國家地方聯合工程研究中心,遼寧省食品安全重點實驗室,遼寧 錦州 121013;3.蕭山出入境檢驗檢疫局,浙江 杭州 311208;4.中國海洋大學食品科學與工程學院,山東 青島 266100)
以新鮮的鰈魚黑皮和白皮為研究對象,從其中提取酸溶性膠原蛋白(acid-soluble collagens,ASC),并對其理化性質和乳化活性及乳化穩定性進行比較研究,為鰈魚皮的開發利用提供一定的理論依據。通過傅里葉變換紅外光譜(Fourier transform infrared spectroscopy,FTIR)技術和掃描電子顯微鏡(scanning electron microscopy,SEM)初步研究了黑皮和白皮ASC的結構特征;同時對其溶解性、流變學特性、等電點、乳化活性指數(emulsifying activity index,EAI)及乳化穩定性指數(emulsifying stability index,ESI)進行了研究。FTIR掃描結果表明,黑皮和白皮ASC都存在酰胺A、酰胺B、酰胺Ⅰ、酰胺Ⅱ、酰胺Ⅲ,均保持了膠原蛋白三維螺旋結構的完整性;SEM觀察結果表明,黑皮和白皮ASC均呈現多空的網絡結構,且分布比較均勻,說明酸法提取膠原蛋白的過程基本上保留了膠原纖維原有的空間網狀結構。EAI及ESI結果表明,黑皮ASC的EAI明顯低于白皮ASC(P<0.05),分別為(2.60±0.53)、(7.30±0.41) m2/g,而黑皮ASC的ESI明顯高于白皮ASC(P<0.05),分別為(49.12±5.18)、(27.56±4.91) min。以上結果顯示,從黑皮和白皮中提取的ASC的理化性質和功能特性存在一定的差異。
鰈魚;魚皮;酸溶性膠原蛋白;提取;理化特性
蔡路昀, 馬帥, 曹愛玲, 等. 不同部位鰈魚皮酸溶性膠原蛋白的提取及其特性[J]. 食品科學, 2017, 38(11): 52-58. DOI:10.7506/spkx1002-6630-201711009. http://www.spkx.net.cn
CAI Luyun, MA Shuai, CAO Ailing, et al. Extraction and characterization of collagens from different skins of flounder (Pleuronichthys cornutus)[J]. Food Science, 2017, 38(11): 52-58. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711009. http://www.spkx.net.cn
鰈魚(Pleuronichthys coconuts)又稱比目魚(Pleuronectiformes),屬鲆鰈類,是一種深海魚,主要產于溫帶及寒帶海域,是我國北方海域的主要經濟魚種之一,也是我國海水魚養殖種類中重要的組成部分[1]。因其肉質細膩鮮美、口感鮮嫩、營養豐富等特點,一直被作為高檔魚種深受消費者的青睞[2]。然而,在鰈魚加工過程中,由于缺乏相應的精深加工技術,會產生大量的魚皮等加工副產物,約占魚體質量的50%~70%左右,這些加工副產物往往被直接丟棄或低價賣給魚粉加工廠,不僅造成了嚴重的環境污染和資源浪費,而且有效利用率較低。因此利用鰈魚皮生產魚膠原蛋白不僅可以有效地避免環境污染和資源浪費的問題,還可以開發出高附加值的產品,這就為魚類膠原蛋白產品提供了更廣闊的市場前景和發展空間,促進了鰈魚產業的健康可持續發展。
膠原蛋白(collagen)是動物體內分布最廣、含量最豐富的一種糖蛋白,由3 條α-肽鏈相互纏繞而形成的螺旋結構的纖維狀蛋白[3],目前,膠原蛋白在諸多行業中都有廣泛的應用[4-5]。然而,近年來牛海綿狀腦病、傳染性海綿狀腦病及口蹄病的爆發引起了人們對陸源膠原蛋白及其衍生產品安全性的擔憂[6]。新的、安全的膠原蛋白資源開發利用是當前要解決的首要問題。近年來,魚膠原蛋白因其來源廣、低抗原性、低過敏性和使用安全等特點深受研究者的廣泛關注。魚膠原蛋白逐漸替代了傳統的膠原蛋白,為魚類加工副產物的高值化利用提供了一條新的途徑,具有重要的經濟價值和理論意義。
近年來,對魚類加工副產物的開發利用已成為研究熱點之一,而目前國內關于鰈魚皮膠原蛋白的研究鮮有報道。本實驗以新鮮的鰈魚黑皮和白皮為研究對象,采用酸法從其中提取膠原蛋白,得到黑皮和白皮酸溶性膠原蛋白(acid-soluble collagens,ASC),探討其黑皮和白皮ASC的理化性質及功能特性是否存在顯著的差異,以期為后續鰈魚皮酸溶性膠原蛋白的深入研究提供了一定的參考,為鰈魚皮綜合利用及高值化產品的開發提供理論和科研依據。
1 材料與方法
1.1 材料與試劑
新鮮鰈魚,由大連天寶綠色食品股份有限公司提供,規格一致,每條魚質量為(1 500±50) g。
NaOH、正丁醇、冰乙酸、NaCl、十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)、溴化鉀(均為分析純) 錦州國藥器化玻有限公司;考馬斯亮藍R-250(優級純) 美國BioBasic公司。
1.2 儀器與設備
PL602-L電子天平 梅特勒-托利多儀器(上海)有限公司;Milli-Q超純水系統 美國Millipore公司;Biofuge stratos臺式高速冷凍離心機 美國Thermo公司;Free Zone2.5真空冷凍干燥機 美國Labconco公司;Scimitar2000傅里葉變換紅外光譜(Fourier transform infrared spectroscopy,FTIR)儀 美國Agilent公司;S-4800場發射掃描電子顯微鏡(scanning electron microscopy,SEM) 日本日立公司;QWWJ-200全無油靜音空壓機 上海曲晨機電技術有限公司;DHR-1流變儀 美國TA公司;DDSJ-308A電導率儀 上海精密科學儀器有限公司;T25 Digital Ultra-Turrak均質機德國IKA公司;DF-101S集熱式恒溫加熱磁力攪拌器鄭州長城科工貿有限公司。
1.3 方法
1.3.1 鰈魚黑皮和白皮的制備
將新鮮的鰈魚采用擊暈處死→在冰上分別取下黑皮和白皮,剔除魚皮上殘留的碎肉和魚鱗等雜質→用超純水沖洗干凈→用剪刀剪成0.5 cm×0.5 cm大小,在-20 ℃條件下貯藏、備用。
1.3.2 鰈魚黑皮和白皮的預處理
取一定量的魚皮,先用超純水沖洗3 次,除去魚皮上殘留的雜質。4 ℃條件下,以料液比1∶10(m/V)加入0.1 mol/L的NaOH溶液攪拌浸泡24 h(NaOH溶液每6 h更換一次),除去魚皮中非膠原蛋白和色素,然后用冰水沖洗魚皮至中性,充分瀝干后,以料液比1∶30(m/V)加入體積分數10%正丁醇溶液攪拌浸泡24 h(正丁醇溶液每6 h更換一次),以除去脂肪,然后用冰水沖洗魚皮至中性,充分瀝干,備用。
1.3.3 鰈魚黑皮和白皮ASC的提取
分別取經過預處理的鰈魚黑皮和白皮,以料液比1∶30(m/V)加入0.5 mol/L的冰乙酸溶液,在4 ℃低速攪拌24 h,4 ℃條件下10 000 r/min離心15 min,取上清液;將未提取徹底的魚皮再次用等量的0.5 mol/L冰乙酸溶液提取。用冰乙酸溶液提取3 次后,混合上清液,加入一定量NaCl溶液攪拌,至最終鹽濃度為0.9 mol/L。靜置過夜,4 ℃條件下5 000 r/min離心20 min后棄上清液。將沉淀溶于0.5 mol/L冰乙酸溶液,8 000 r/min離心20 min除去不溶性雜質。經3 次鹽析后,將沉淀先用0.1 mol/L的冰乙酸溶液透析過夜,每6 h換一次透析液,再用超純水進行透析,每6 h換一次超純水。直到透析液中不存在銀離子時,停止透析。最后對透析過的膠原蛋白溶液進行冷凍干燥,分別得到黑皮和白皮ASC。
1.3.4 黑皮和白皮ASC的FTIR分析
參考Chen Junde等[7]的方法稍作修改,分別取適量干燥的黑皮和白皮ASC樣品與一定量的KBr于瑪瑙研缽中研磨均勻,裝樣,手動壓片,取出樣品迅速小心放入樣品室,用Scimitar2000 FTIR儀在4 000~500 cm-1范圍內進行檢測,分辨率為0.5 cm-1。
1.3.5 黑皮和白皮ASC的SEM觀察
參考Tamilmozhi等[8]的方法,分別將黑皮和白皮ASC樣品用體積分數2.5%戊二醛溶液固定24 h,取出后采用0.2 mol/L的磷酸鹽緩沖液(pH 6.8)漂洗3 次,每次10 min,然后分別用50%、60%、70%、80%、90%、100%乙醇梯度洗脫,每次10 min,結束后采用冷凍干燥機真空干燥,然后離子濺射鍍金,最后在3.0 kV電壓下放大1 000 倍觀察膠原蛋白的表面結構狀態。
1.3.6 黑皮和白皮ASC的溶解性測定
參考Zeng Shaokui等[9]的方法稍作修改,分別取適量干燥的黑皮和白皮ASC樣品,用0.5 mol/L冰乙酸溶液配成質量濃度為3.00 mg/mL的ASC溶液,4 ℃溶解24 h,離心(8 000 r/min,6 min,4 ℃),取上清液測定膠原蛋白含量。按式(1)計算相對溶解度。

1.3.6.1 pH值對ASC溶解性的影響
分別取8 mL黑皮和白皮ASC溶液(質量濃度為3 mg/mL,溶于0.5 mol/L冰乙酸溶液)分別放入10 mL離心管中,用6 mol/L NaOH或6 mol/L HCl溶液調pH 1~10,溶液用超純水(已調到與溶液pH值一致)定容至10 mL,充分混勻后在4 ℃條件下10 000 r/min離心30 min,計算上清液蛋白質的含量(雙縮脲法)。考馬斯亮藍G-250測定上清液中蛋白質含量,用牛血清白蛋白作標準曲線,按式(2)計算ASC的相對溶解度(R),以pH值為橫坐標,相對溶解度為縱坐標作溶解性曲線[10]。

式中:ρpH為不同pH值條件下蛋白質的含量/(mg/mL);ρpHmax為pH值變化時蛋白質的最大溶解量/(mg/mL)。1.3.6.2 NaCl質量濃度對ASC溶解度的影響
分別取5 mL黑皮和白皮ASC溶液(質量濃度為5 mg/mL,溶于0.5 mol/L冰乙酸溶液)放入10 mL離心管中,與5 mL NaCl溶液(溶于0.5 mol/L冰乙酸溶液中,質量濃度分別為0、1、2、3、4、5、6 g/100 mL)充分混合,混合液在4 ℃條件下靜置30 min后在4℃、10 000 r/min離心30 min,上清液中蛋白質含量的測定方法同1.3.6.1節,按式(3)計算ASC的相對溶解度。以NaCl質量濃度為橫坐標,相對溶解度(R)為縱坐標作溶解性曲線。

式中:ρNaCl為不同NaCl質量濃度條件下蛋白質的含量/(mg/mL);ρNaClmax為NaCl質量濃度變化時蛋白質的最大溶解量/(mg/mL)。
1.3.7 黑皮和白皮ASC溶液的流變學特性
參考閆鳴艷[11]、張強[12]等的方法稍作修改,取適量干燥的黑皮和白皮ASC溶于0.5 mol/L冰乙酸溶液中,配制成質量分數為0.3%的膠原蛋白溶液。在20 ℃條件下,采用DHR-1流變儀測定膠原蛋白溶液的流變學曲線。測定條件:40 mm;2°椎板;在振蕩模式下,采用頻率掃描的數據獲取模式,剪切頻率掃描范圍為0.1~10.0 Hz;變量掃描為線性模式,采集33 個變量點,控制變量為形變率(30%)。研究膠原蛋白溶液的儲能模量G’(彈性模量)、損耗模量G”(黏性模量)隨著剪切頻率的變化規律。
1.3.8 黑皮和白皮ASC的等電點測定
稱取適量干燥的黑皮和白皮ASC樣品用超純水配成5 mg/mL溶液,用0.01 mol/L鹽酸和0.01 mol/L NaOH調節溶液pH值,同時用DDSJ-308A電導率儀測定樣品在不同pH值下的電導率值,根據蛋白質在等電點時電導率值最低的原理確定溶液的等電點[13]。
1.3.9 黑皮和白皮ASC的乳化活性和乳化穩定性測定
參考Pearce等[14]的方法稍作修改,采用濁度法測定黑皮和白皮ASC的乳化活性指數(emulsifying activity index,EAI)和乳化穩定性指數(emulsifying stability index,ESI)。將3.0 mL大豆色拉油和9.0 mL(10 mg/mL)黑皮和白皮ASC溶液放入直徑為2.5 cm的塑料離心管中用勻漿機高速勻漿1 min,立即從距離心管底0.5 cm的地方取勻漿液100 μL(剩下的勻漿備用),加入到5 mL 0.1% SDS溶液中,振蕩混勻后用紫外分光光度計在500 nm波長處測定吸光度記作A0,勻漿后10 min再次在相同位置取勻漿液100 μL,加入到5 mL 0.1% SDS溶液中,振蕩混勻后測定吸光度記作A10,用0.1% SDS溶液作空白對照。黑皮和白皮ASC樣品的EAI與ESI按公式(4)、(5)計算。
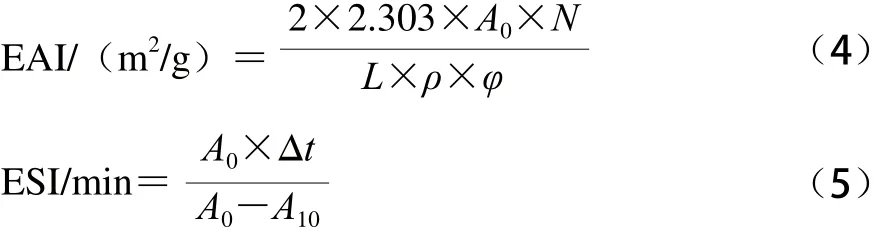
式中:A0為0 min的吸光度;A10為乳化液10 min后測定的吸光度;L為比色皿光徑0.01 m;N為稀釋倍數50;ρ為乳化前膠原蛋白質量濃度/(g/m3);φ是乳化液中油的體積分數(0.25);Δt為10 min。
1.4 數據處理
每個實驗均重復3 次,采用Excel 2003軟件及Origin 8.5軟件進行數據統計分析與作圖;采用SPSS Statistics 19.0軟件分析差異顯著性。
2 結果與分析
2.1 黑皮和白皮ASC的FTIR分析

表1 鰈魚黑皮和白皮ASC出峰位置及FTIR圖譜解析Table 1 Peak positions and FTIR analysis of acid-soluble collagens from black and white skin of flounder
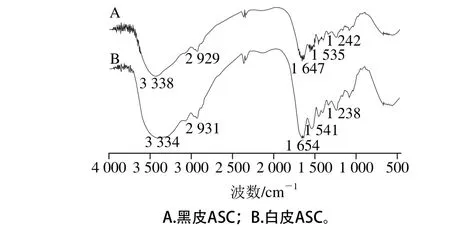
圖1 鰈魚黑皮和白皮ASC的FTIR圖Fig. 1 Infrared spectra of acid-soluble collagens from black and white skin of flounder
由表1和圖1可知,黑皮和白皮ASC的FTIR圖基本一致,由此說明黑皮和白皮ASC的結構很相似。酰胺A與N—H基團的伸縮振動有關,其中在紅外光譜中N—H基團伸縮振動所產生的酰胺A的吸收峰往往在3 400~3 440 cm-1,然而,當含有N—H基團的分子肽段參與氫鍵的形成時,N—H的伸縮振動會向低頻率移動,使N—H的伸縮振動產生的吸收峰減低到3 300 cm-1左右[15]。由表1和圖1可知,黑皮和白皮ASC酰胺A的吸收峰分別位于3 338、3 334 cm-1處,均符合酰胺A的特征吸收,由此說明黑皮和白皮ASC分子中均存在氫鍵。而由于蛋白質分子的亞甲基基團會發生不對稱的伸縮振動,使得酰胺B的吸收峰出現在3 080 cm-1附近[16],從表1和圖1可知,黑皮和白皮ASC酰胺B的吸收峰分別在2 929、2 931 cm-1。在蛋白質分子中,氨基酸之間存在著大量的肽鍵,且因C=O鍵的伸縮振動導致了酰胺Ⅰ帶的特征吸收峰位于1 600~1 700 cm-1之間[17],酰胺Ⅰ帶為蛋白質二級結構變化的敏感區,常被用于蛋白質二級結構的分析。通過FTIR分析可知,黑皮和白皮ASC酰胺Ⅰ帶的特征吸收峰分別在1 647、1 654 cm-1處,該結果均符合酰胺Ⅰ帶的出峰位置。從已有的膠原蛋白分子中可知,膠原蛋白酰胺Ⅱ帶的吸收峰往往處在1 500~1 600 cm-1范圍內[18]。由圖1可知,黑皮和白皮ASC分別在1 535、1 541 cm-1處有明顯的吸收峰,由此說明該吸收區為酰胺Ⅱ帶。和酰胺Ⅰ帶一樣,酰胺Ⅱ帶也是由α-螺旋、β-折疊、轉角和無規卷曲疊加共同作用所產生的吸收帶。一般來說,酰胺Ⅲ帶的存在可以說明膠原蛋白的三維螺旋結構能否保持完整,且其吸收峰往往在1 200~1 300 cm-1處[19]。由表1和圖1可知,黑皮和白皮ASC分別在1 242、1 238 cm-1處有明顯的吸收峰,這表明鰈魚黑皮和白皮ASC均存在酰胺Ⅲ帶,說明酸法提取膠原蛋白保持了膠原蛋白三維螺旋結構的完整性。
2.2 黑皮和白皮ASC的SEM圖像
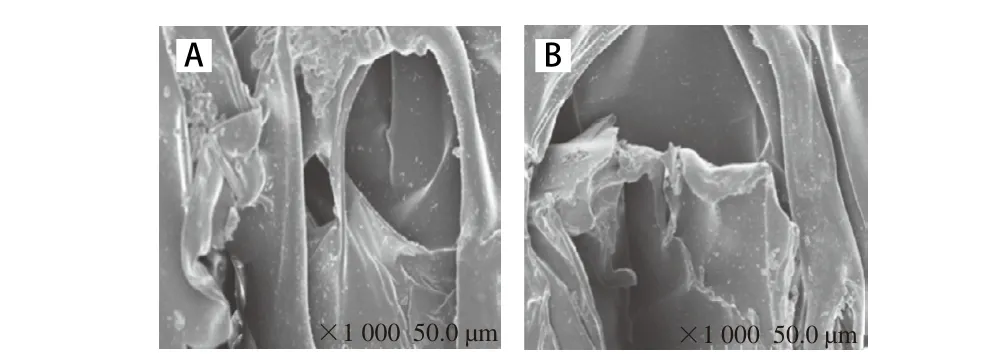
圖2 黑皮(A)和白皮(B)ASC的SEM圖像Fig. 2 Scanning electron micrographs of black (A) and white (B) skin acid-soluble collagens
Zuber等[20]研究表明,膠原蛋白的微觀結構是其作為生物醫學材料的重要參數。黑皮和白皮ASC在放大1 000 倍時的SEM圖如圖2所示,從肉眼來看,黑皮和白皮ASC樣品均呈白色、質地柔軟、類似海綿狀狀態;經SEM放大1 000 倍后發現這兩種膠原蛋白樣品均呈現多空的網絡結構、表面粗糙、有褶皺現象且分布比較均勻,說明酸法提取膠原蛋白的過程基本上保留了膠原纖維原有的空間網狀結構,比較適合作為生物醫學材料的基料[21]。
2.3 黑皮和白皮ASC的流變學特性
膠原蛋白溶液的黏彈性可用振蕩模式進行測定,也就是說對膠原蛋白分子施加一個搖擺力矩,使其在此搖擺力矩下發生運動。分子鏈的運動會隨著搖擺力矩頻率的變化而發生相應的改變,根據此特點可以測定膠原蛋白溶液的黏彈性能。G’為儲能模量或彈性模量,反映了膠原蛋白分子隨著外力的變化而發生形變的能力;G”為損耗模量或黏性模量,反映了膠原蛋白分子在外力作用發生改變時分子鏈內或分子間拉伸導致的能量損耗。黑皮和白皮ASC溶液的流變學曲線如圖3所示,黑皮和白皮ASC溶液的流變學曲線隨著剪切頻率的改變出現了相同的變化趨勢,說明剪切頻率的變化可以影響膠原蛋白溶液的流變特性[22],而黑皮和白皮ASC溶液的流變學曲線呈現了不同程度的變化,說明不同膠原蛋白溶液的流變特性存在著一定的差異[23]。由圖3A可知,隨著剪切頻率的增大,黑皮和白皮ASC溶液的彈性模量G’均呈現增大的趨勢,當剪切頻率在0.0~5.5 Hz之間時,黑皮ASC溶液的彈性模量G’均高于白皮ASC,隨后兩者溶液的彈性模量G’相差不大。隨著剪切頻率的增大,白皮ASC溶液彈性模量G’的變化斜率較大,說明其在給定的剪切頻率的范圍內,具有較高的凝膠穩定性[24]。由圖3可知,當剪切頻率較低時,黑皮和白皮ASC溶液主要表現出黏性為主的特征,隨著剪切頻率的增大,黑皮和白皮ASC溶液主要表現出彈性為主的特征。
圖3 鰈魚皮膠原蛋白溶液的流變學特性Fig. 3 Rheological characteristics of collagen solutions of flounder skin
2.4 黑皮和白皮ASC的EAI和ESI
EAI指蛋白質能將油和水結合在一起,形成乳狀液的能力;是蛋白質的一種重要功能性質,也是食品加工中重要的質量控制指標。ESI是指油水乳狀液保持穩定的能力,可以決定乳化劑在食品中的適用性。黑皮和白皮ASC的EAI和ESI的測定結果如圖4所示,黑皮和白皮ASC的EAI分別為(2.60±0.53)、(7.30±0.41) m2/g;ESI分別為(49.12±5.18)、(27.56±4.91) min。由圖4可知,白皮ASC的EAI明顯高于黑皮ASC(P<0.05),這可能是由于白皮ASC的分子質量高于黑皮ASC所致。乳化是一種液體以極微小的液滴均勻地分散在互不相溶的另一種液體中形成的具有相當穩定性的多相分散體系的過程[25]。膠原蛋白在其乳液聚合過程中可以作單體,同時也可以作乳化劑,而乳化劑對乳液聚合性能有著重要的影響[26]。
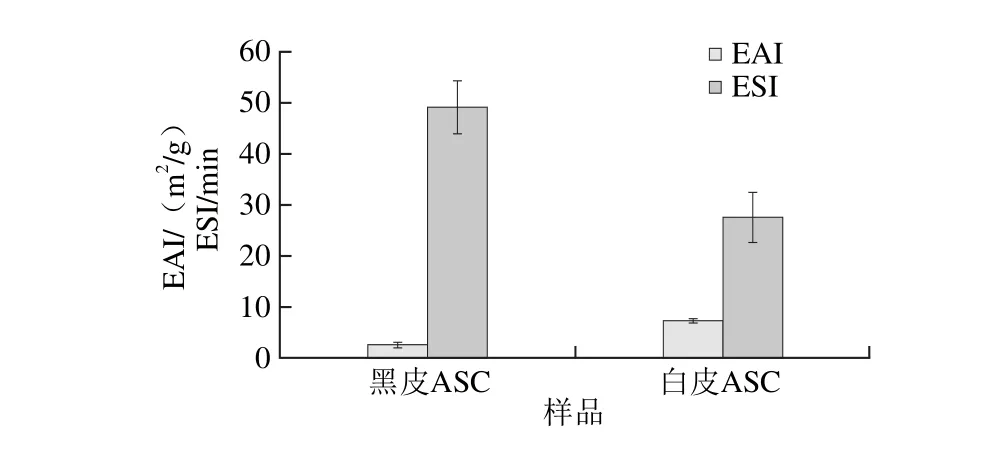
圖4 黑皮和白皮ASC乳化活性和乳化穩定性的比較Fig. 4 Comparison of emulsifying activity index and emulsion stability index of black and white skin acid-soluble collagens
2.5 黑皮和白皮ASC的等電點
等電點是當蛋白質溶液的pH值達到某一特定值時,蛋白質極性基團解離的正負離子數相等,蛋白質分子不帶凈電荷,靜電荷為零時溶液的pH值。等電點特性是蛋白質極其重要的性質,對蛋白質的分離、純化和分析等都具有重要的實用價值[27],也是蛋白質的一個重要參數,與其側鏈酸性和堿性氨基酸的殘基比例相關,也與蛋白質的結構有關,而與其環境的pH值無關。黑皮和白皮ASC溶液在不同pH值條件下的電導率值如圖5所示,從鰈魚不同部位提取的ASC的等電點是不同的。黑皮ASC溶液的電導率值隨著pH值的增大呈先下降再上升又下降最后上升的趨勢,且當pH值為7.5時,黑皮ASC溶液的電導率值最小為(104.00±12.03) μS/cm;白皮ASC溶液的電導率值隨著pH值的增大呈先下降后上升的趨勢,當pH值為6.5時,白皮ASC溶液的電導率值最小為(117.00±11.29) μS/cm;因此,黑皮和白皮ASC溶液的等電點分別為7.5、6.5,兩者的等電點均在中性范圍內,說明酸法提取的膠原蛋白側鏈氨基酸殘基沒有被破壞[28]。
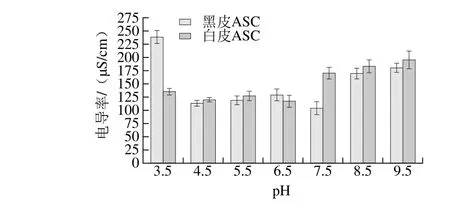
圖5 不同pH值條件下黑皮和白皮ASC的電導率Fig. 5 Electrical conductivity of black and white skin acid-soluble collagens at different pH conditions
2.6 pH值和NaCl質量濃度變化對黑皮和白皮ASC溶解性的影響
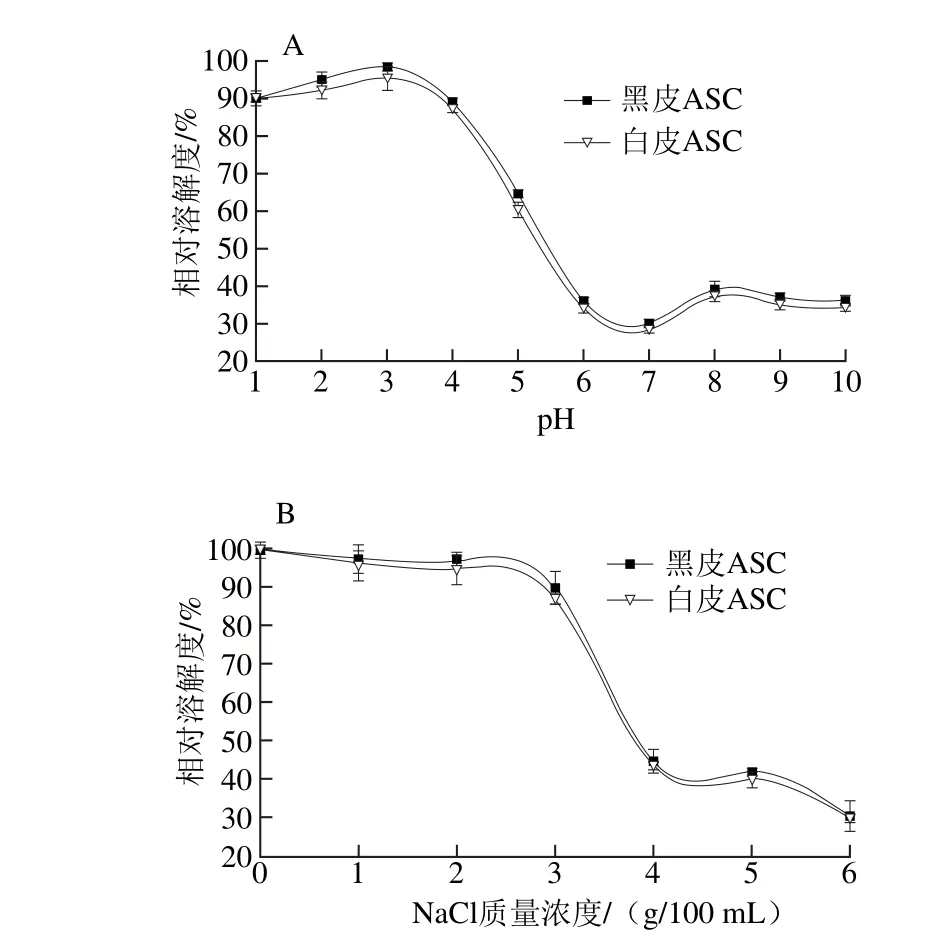
圖6 pH值(A)和NaCl質量濃度(B)對黑皮和白皮ASC相對溶解度的影響Fig. 6 Impacts of pH (A) and NaCl concentration (B) on relative solubility of black and white skin acid-soluble collagens
膠原蛋白溶液的溶解性隨pH值的變化與其等電點密切相關,在等電點附近,膠原蛋白溶液的靜電荷為0,相鄰蛋白質分子間不存在靜電斥力而出現結聚沉淀。不同pH值條件下鰈魚黑皮和白皮ASC的相對溶解度如圖6A所示。隨著pH值的升高,黑皮和白皮ASC的相對溶解度均呈先升高后下降再升高的趨勢,但整體上黑皮ASC的相對溶解度高于白皮ASC的相對溶解度。在酸性條件下,黑皮和白皮ASC的相對溶解度較大,在pH值為3時,黑皮和白皮ASC的相對溶解度均達到了最大值(98.29±1.04)%和(95.27±3.20)%。在兩者的相對溶解度達到最大值后,隨著pH值的升高,兩者的相對溶解度迅速下降,在pH值為7左右時,兩者的溶解度均達到了最小值,之后兩者的相對溶解度均略有回升的趨勢。據此,膠原蛋白溶液的相對溶解度在其等電點時最低;在偏離等電點的酸、堿性條件下,膠原蛋白溶液就會帶有一定量的靜電荷,呈現復雜的正離子或負離子狀態,電荷互相排斥,阻止了單分子結聚成沉淀物,分子的分散性較好,從而使得膠原蛋白溶液的相對溶解度較大[29-30]。
不同NaCl質量濃度條件下鰈魚黑皮和白皮ASC的相對溶解度如圖6B所示。黑皮和白皮ASC的相對溶解度均隨著NaCl質量濃度的增大而呈下降的趨勢,且整體上黑皮ASC的相對溶解度比白皮ASC下降得緩慢;當NaCl質量濃度小于3 g/100 mL時,黑皮和白皮ASC均保持較高的相對溶解度,且比較穩定,這可能是膠原蛋白溶液在較低的NaCl質量濃度時,膠原蛋白分子與Na+相結合,最終使蛋白質的結構趨于穩定且具有較好的分散性,從而使得膠原蛋白溶液在較低NaCl質量濃度時具有較高的相對溶解度。當NaCl質量濃度大于3 g/100 mL時。黑皮和白皮ASC的相對溶解度均明顯下降,但黑皮ASC的相對溶解度下降的速率低于白皮ASC的相對溶解度,這可能是膠原蛋白溶液在較高的NaCl質量濃度時,高濃度的鹽離子可與周圍的水分子結合而形成水化膜,進而使蛋白質脫水發生鹽析現象而析出沉淀,導致其相對溶解度降低[31]。
3 結 論
本實驗以新鮮鰈魚黑皮和白皮為研究對象,采用酸法從其中提取膠原蛋白,得到黑皮和白皮ASC,并研究了黑皮和白皮ASC的理化性質及功能特性的差異性,對后續鰈魚皮酸溶性膠原蛋白的深入研究有一定的借鑒意義。
FTIR掃描結果發現,鰈魚黑皮和白皮ASC都存在酰胺A、酰胺B、酰胺Ⅰ、酰胺Ⅱ、酰胺Ⅲ,證明其都保留有三螺旋結構,說明酸法提取膠原蛋白保持了膠原蛋白三維螺旋結構的完整性;黑皮和白皮ASC的SEM結果顯示,黑皮和白皮ASC均呈現多空的網絡結構,且分布比較均勻,說明酸法提取膠原蛋白的過程基本上保留了膠原纖維原有的空間網狀結構;EAI及ESI研究表明,黑皮ASC的EAI明顯低于白皮ASC的EAI(P<0.05),分別為(2.60±0.53)、(7.30±0.41) m2/g,而黑皮ASC的ESI明顯高于白皮ASC的ESI(P<0.05),分別為(49.12±5.18)、(27.56±4.91) min,這可能是由于白皮ASC的分子質量高于黑皮ASC所致。
綜上所述,黑皮和白皮ASC的理化性質和功能特性略有差異,可以根據這兩種膠原蛋白不同的理化性質和功能特性應用在不同領域,可為鰈魚皮綜合利用以及高值化產品的開發提供一定的理論和科研依據。
參考文獻:
[1] JOKINEN H, WENNHAGE H, LAPPALAINEN A, et al. Decline of flounder (Platichthys fl esus (L.)) at the margin of the species’distribution range[J]. Journal of Sea Research, 2015, 105: 1-9. DOI:10.1016/j.seares.2015.08.001.
[2] NISSLING A, THORSEN A, da SILVA F F G. Fecundity regulation in relation to habitat utilisation of two sympatric flounder (Platichtys fl esus) populations in the brackish water Baltic Sea[J]. Journal of Sea Research, 2015, 95: 188-195. DOI:10.1016/j.seares.2014.06.003.
[3] WU X, CAI L, CAO A, et al. Comparative study on acid-soluble and pepsin-soluble collagens from skin and swim bladder of grass carp (Ctenopharyngodon idella)[J]. Journal of the Science of Food and Agriculture, 2016, 96(3): 815-821. DOI:10.1002/jsfa.7154.
[4] KIM S H, PARK H S, LEE O J, et al. Fabrication of duck’s feet collagen-silk hybrid biomaterial for tissue engineering[J]. International Journal of Biological Macromolecules, 2016, 85: 442-450. DOI:10.1016/j.ijbiomac.2015.12.086.
[5] NEEL E A A, BOZEC L, KNOWLES J C, et al. Collagen-emerging collagen based therapies hit the patient[J]. Advanced Drug Delivery Reviews, 2013, 65(4): 429-456. DOI:10.1016/j.addr.2012.08.010. [6] ZHANG Y, LIU W, LI G, et al. Isolation and partial characterization of pepsin-soluble collagen from the skin of grass carp (Ctenopharyngodon idella)[J]. Food Chemistry, 2007, 103(3): 906-912. DOI:10.1016/ j.foodchem.2006.09.053.
[7] CHEN Junde, LI Long, YI Ruizao, et al. Extraction and characterization of acid-soluble collagen from scales and skin of tilapia (Oreochromis niloticus)[J]. LWT-Food Science and Technology, 2016, 66: 453-459. DOI:10.1016/j.lwt.2015.10.070.
[8] TAMILMOZHI S, VEERURAJ A, ARUMUGAM M. Isolation and characterization of acid and pepsin-solubilized collagen from the skin of sailfish (Istiophorus platypterus)[J]. Food Research International, 2013, 54(2): 1499-1505. DOI:10.1016/j.foodres.2013.10.002.
[9] ZENG Shaokui, YIN Juanjuan, YANG Shuqi, et al. Structure and characteristics of acid and pepsin-solubilized collagens from the skin of cobia (Rachycentron canadum)[J]. Food Chemistry, 2012, 135(3): 1975-1984. DOI:10.1016/j.foodchem.2012.06.086.
[10] KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W, et al. Characterisation of acid-soluble collagen from skin and bone of bigeye snapper (Priacanthus tayenus)[J]. Food Chemistry, 2005, 89(3): 363-372. DOI:10.1016/j.foodchem.2004.02.042.
[11] 閆明艷. 狹鱈魚皮膠原蛋白結構和物理特性的研究[D]. 青島: 中國海洋大學, 2009: 54. DOI:10.7666/d.y1503712.
[12] 張強, 王倩倩, 陸劍鋒, 等. 不同方法提取鰱魚皮膠原蛋白的理化特性比較[J]. 現代食品科技, 2014, 30(5): 104-110. DOI:10.13982/ j.mfst.1673-9078.2014.05.025.
[13] 郭榮榮. 甜蕎蛋白質組分功能特性評價及對火腿腸質構特性的影響研究[D]. 武漢: 華中農業大學, 2007: 24. DOI:10.7666/ d.y1198079.
[14] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723. DOI:10.1021/jf60217a041.
[15] LI H, LIU B L, GAO L Z, et al. Studies on bullfrog skin collagen[J]. Food Chemistry, 2004, 84(1): 65-69. DOI:10.1016/S0308-8146(03)00167-5.
[16] MUYONGA J H, COLE C G B, DUODU K G. Characterisation of acid soluble collagen from skins of young and adult Nile perch (Lates niloticus)[J]. Food Chemistry, 2004, 85(1): 81-89. DOI:10.1016/ j.foodchem.2003.06.006.
[17] ZHU B, DONG X, ZHOU D, et al. Physicochemical properties and radical scavenging capacities of pepsin-solubilized collagen from sea cucumber Stichopus japonicus[J]. Food Hydrocolloids, 2012, 28(1): 182-188. DOI:10.1016/j.foodhyd.2011.12.010.
[18] AHMAD M, BENJAKUL S. Extraction and characterisation of pepsin-solubilised collagen from the skin of unicorn leatherjacket (Aluterus monocerous)[J]. Food Chemistry, 2010, 120(3): 817-824. DOI:10.1016/j.foodchem.2009.11.019.
[19] LIU D, LIANG L, REGENSTEIN J M, et al. Extraction and characterisation of pepsin-solubilised collagen from fins, scales, skins, bones and swim bladders of bighead carp (Hypophthalmichthys nobilis)[J]. Food Chemistry, 2012, 133(4): 1441-1448. DOI:10.1016/ j.foodchem.2012.02.032.
[20] ZUBER M, ZIA F, ZIA K M, et al. Collagen based polyurethanes: a review of recent advances and perspective[J]. International Journal of Biological Macromolecules, 2015, 80: 366-374. DOI:10.1016/j.ijbiomac.2015.07.001.
[21] 朱文學, 邱園園, 肖楓, 等. 響應面法優化黃河鯉魚魚鱗酸溶性膠原蛋白提取工藝[J]. 食品科學, 2013, 34(20): 94-98. DOI:10.7506/ spkx1002-6630-201320018.
[22] STARKEY C P, GEESINK G H, van de VEN R, et al. The relationship between shear force, compression, collagen characteristics, desmin degradation and sarcomere length in lamb biceps femoris[J]. Meat Science, 2017, 126: 18-21. DOI:10.1016/j.meatsci.2016.12.006.
[23] ZHANG Q, WANG Q, L? S, et al. Comparison of collagen and gelatin extracted from the skins of Nile tilapia (Oreochromis niloticus) and channel catfish (Ictalurus punctatus)[J]. Food Bioscience, 2016, 13: 41-48. DOI:10.1016/j.fbio.2015.12.005.
[24] BINSI P K, SHAMASUNDAR B A, DILEEP A O, et al. Rheological and functional properties of gelatin from the skin of Bigeye snapper (Priacanthus hamrur) fish: influence of gelatin on the gel-forming ability of fish mince[J]. Food Hydrocolloids, 2009, 23(1): 132-145. DOI:10.1016/j.foodhyd.2007.12.004.
[25] JULIAN D, CLEMENTS M. Food emulsions: principles, practice, and techniques[M]. Washington: CRC Press, 2005: 12.
[26] YORGANCIOGLU A, BAYRAMOGLU E E. Production of cosmetic purpose collagen containing antimicrobial emulsion with certain essential oils[J]. Industrial Crops and Products, 2013, 44: 378-382. DOI:10.1016/j.indcrop.2012.11.013.
[27] LUO Y, TIAN Y, ZHU A, et al. pH-dependent electrochemical behavior of proteins with different isoelectric points on the nanostructured TiO2surface[J]. Journal of Electroanalytical Chemistry, 2010, 642(2): 109-114. DOI:10.1016/j.jelechem.2010.02.021.
[28] THUY L T M, OKAZAKI E, OSAKO K. Isolation and characterization of acid-soluble collagen from the scales of marine fishes from Japan and Vietnam[J]. Food Chemistry, 2014, 149: 264-270. DOI:10.1016/j.foodchem.2013.10.094.
[29] NALINANON S, BENJAKUL S, VISESSANGUAN W, et al. Use of pepsin for collagen extraction from the skin of bigeye snapper (Priacanthus tayenus)[J]. Food Chemistry, 2007, 104(2): 593-601. DOI:10.1016/j.foodchem.2006.12.035.
[30] WOO J W, YU S J, CHO S M, et al. Extraction optimization and properties of collagen from yellowfin tuna (Thunnus albacares) dorsal skin[J]. Food Hydrocolloids, 2008, 22(5): 879-887. DOI:10.1016/ j.foodhyd.2007.04.015.
[31] PAL G K, NIDHEESH T, SURESH P V. Comparative study on characteristics and in vitro fibril formation ability of acid and pepsin soluble collagen from the skin of catla (Catla catla) and rohu (Labeo rohita)[J]. Food Research International, 2015, 76: 804-812. DOI:10.1016/j.foodres.2015.07.018.
Extraction and Characterization of Collagens from Different Skins of Flounder (Pleuronichthys cornutus)
CAI Luyun1,2, MA Shuai2, CAO Ailing3, LI Xiuxia2, ZHANG Yuhao1, ZHAO Guohua1, ZHAO Yuanhui4, LIN Hong4, LI Jianrong2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Food Safety Key Laboratory of Liaoning Province, National and Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, College of Food Science and Engineering, Bohai University, Jinzhou 121013, China; 3. Xiaoshan Entry-Exit Inspection and Quarantine Bureau, Hangzhou 311208, China; 4. College of Food Science and Engineering, Ocean University of China, Qingdao 266100, China)
In this study, acid-soluble collagens were extracted from black and white skins of fresh flounder, and their physicochemical characteristics, emulsifying activity and emulsion stability were compared and analyzed. The structural characteristics were studied by Fourier transform infrared spectroscopy (FTIR) and scanning electron microscopy (SEM). Additionally, solubility, rheological properties, isoelectric point, emulsifying activity index and emulsion stability were also investigated. FTIR analysis proved the existence of amide A, amide B, amide Ⅰ, amide Ⅱ, and amide Ⅲ, confirming that the triple helical chain conformation of the two collagens was completely maintained. The SEM results indicated that both collagens showed a porous, evenly distributed network structure, which proved that the original structure of collagen fibers was basically maintained during the extraction process. The emulsifying activity index (EAI) of the black skin collagen was significantly lower than that of the white skin collagen (P < 0.05), which were (2.60 ± 0.53) and (7.30 ± 0.41) m2/g, respectively, while the emulsion stability index (ESI) of the former was significantly higher than that of the latter (P < 0.05), which were (49.12 ± 5.18) and (27.56 ± 4.91) min, respectively. These results showed that certain differences exist in physicochemical characteristics and functional properties of acid-soluble collagens from different flounder skins.
10.7506/spkx1002-6630-201711009
TS254.9
A
1002-6630(2017)11-0052-07引文格式:
2016-05-19
國家自然科學基金青年科學基金項目(31401478);中國博士后基金面上項目(2015M570760);“十二五”國家科技支撐計劃項目(2012BAD29B06);遼寧省自然科學基金項目(20170540006);重慶市博士后特別資助項目(Xm2015021);渤海大學研究生創新基金項目(071502224-48)
蔡路昀(1981—),男,副教授,博士,研究方向為水產品貯藏加工和功能性食品。E-mail:clyun2007@163.com
*通信作者:勵建榮(1964—),男,教授,博士,研究方向為水產品和果蔬貯藏加工及質量安全控制。E-mail:li34008@126.com
Key words: Pleuronichthys cornutus; fish skin; acid-soluble collagen; extraction; physicochemical characterization

