乳酸菌吸附作用清除食品中有毒重金屬研究進展
馬歡歡,白鳳翎*,勵建榮
(渤海大學食品科學與工程學院,遼寧省食品安全重點實驗室,生鮮農產品貯藏加工及安全控制技術國家地方聯合工程研究中心,遼寧 錦州 121013)
乳酸菌吸附作用清除食品中有毒重金屬研究進展
馬歡歡,白鳳翎*,勵建榮
(渤海大學食品科學與工程學院,遼寧省食品安全重點實驗室,生鮮農產品貯藏加工及安全控制技術國家地方聯合工程研究中心,遼寧 錦州 121013)
重金屬污染是引起人們關注的食品安全熱點問題之一。本文在分析食品中汞、砷、鎘和鉛等重金屬的污染來源、存在形態及對人類產生的危害和清除污染食品中重金屬方法的基礎上,重點歸納了利用乳酸菌清除食品中重金屬的菌株種類、清除作用機制及其在食品領域中應用研究的最新進展,為利用乳酸菌生物制劑清除食品中重金屬的研究與應用提供借鑒與參考。
乳酸菌;生物吸附;清除;重金屬
馬歡歡, 白鳳翎, 勵建榮. 乳酸菌吸附作用清除食品中有毒重金屬研究進展[J]. 食品科學, 2017, 38(11): 301-307. DOI:10.7506/spkx1002-6630-201711047. http://www.spkx.net.cn
MA Huanhuan, BAI Fengling, LI Jianrong. Removal of heavy metals from foods by lactic acid bacteria biosorption: a review[J]. Food Science, 2017, 38(11): 301-307. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711047. http://www.spkx.net.cn
近年來,重金屬污染引起的食品安全問題已成為人們廣泛關注的熱點,食品中重金屬主要來源于工業“三廢”、交通運輸和生活垃圾等污染[1],受污染食品主要包括糧食、果蔬和水產品等。據環保部門估算,我國每年因重金屬污染的糧食高達1 200萬 t,造成的直接經濟損失超過200億元[2]。
清除食品中重金屬的方法包括物理法、化學法和生物法。物理法通過清洗、浸泡或蒸煮等方式可有效清除糧食、牛乳等食品中重金屬,但因重金屬離子與水產品和肉類食品中大分子物質結合緊密,故應用物理法的清除顯現出不足。化學法通過化學物質與重金屬螯合方式清除食品中重金屬,但存在化學物質殘留的安全問題。生物法利用動植物和微生物以生物吸附和修復方式與重金屬結合從而清除食品中重金屬。比較而言,生物法具有高效、無毒、環保的特點,逐漸成為食品安全領域研究的熱點。在具有清除重金屬活性的原核生物中,乳酸菌可通過菌體表面吸附和體內蓄積作用有效清除食品中有毒重金屬,有大量關于清除重金屬活性乳酸菌的篩選、清除機制和應用方面的研究,乳酸菌作為潛在的重金屬生物清除劑具有較高的研究與應用價值。
本文以汞、砷、鎘、鉛為研究對象,闡述了食品中重金屬的污染來源、存在形態及對人類的危害,重點分析和歸納了自然環境中篩選具有清除重金屬活性乳酸菌的種類、作用機制及在糧食、果蔬及水產等食品中的應用研究,旨在為研發高效、綠色、環保食品中重金屬清除生物制劑提供借鑒與參考。
1 食品中重金屬
重金屬是指相對密度大于5.0的金屬元素,通過污染食品對人體產生危害的重金屬主要包括汞、鎘、鉛和類金屬砷。
1.1 食品中重金屬的污染來源
食品中重金屬元素主要來源于天然釋放和人為污染。天然釋放包括地熱活動、巖石風化和火山噴發等,人為污染主要包括工業“三廢”、交通運輸、生活垃圾。受污染水、土壤和大氣等自然環境中的有毒重金屬通過植物的表面吸附和滲透作用以及食物鏈的生物蓄積作用污染食品[3]。食品中的汞主要來源于火山、地熱和巖石風化等天然釋放,含汞農藥和肥料的使用,污水灌溉和工業廢料中的釋放,污染土壤、水和空氣等環境的汞直接或通過食物鏈進入各種農產品中。食品中的砷主要來源于砷礦冶煉、工業“三廢”的污染和含砷農藥的使用,受污染的土壤、水和大氣通過吸附和滲透作用將砷轉移到農產品中。此外,在食品加工過程中砷也可通過直接或間接方式污染食品。食品中的鎘主要來源于采礦廢水、電鍍和電池的工業污水,施用含有鎘元素的肥料和含有鎘污染的工業廢氣經雨淋和自然沉降等方式進入土壤。土壤的鎘通過植被根部吸收作用進入植物性食品,也可經過食物鏈生物富集方式進入動物性食品。鉛的污染主要來源自然環境污染和食品加工環節,自然環境中的鉛來源于金屬冶煉、汽車尾氣、工業“三廢”和含鉛農藥,食品加工中的鉛主要來自源于包裝材料和食品容器。
1.2 食品中重金屬存在形態
食品中重金屬以無機態、有機態和絡合態3 種形式存在。無機態包括游離態和化合態,有機態是有機金屬化合物的形式,絡合態是與食品中蛋白質、核酸、糖類等大分子形成的大分子有機物,也可是與核苷酸、氨基酸和卟啉等小分子有機物絡合而成的產物。
1.2.1 汞
食品中存在汞(Hg)化合物和烷基汞兩種形態,以甲基汞等烷基汞為主[4-5]。Harris等[6]研究表明,動物肌肉中主要以甲基汞-半胱氨酸結合體的形式存在。Park等[7]調查發現,金槍魚罐頭、馬哈魚和鱈魚體內主要以甲基汞形態存在,總汞含量分別為0.001~2.581、0.012~2.529 mg/kg和0.021~0.507 mg/kg,甲基汞含量占總汞含量的50%以上。程柳等[8]采用乙基化衍生-氣相色譜-原子熒光光譜法研究發現,小浪底魚庫魚體中甲基汞的含量為10.77~265.23 mg/kg,至少超出我國國家標準20 倍[9]。
1.2.2 砷
食品中砷(As)呈現多種存在形態,主要包括一甲基砷酸(mono-methylarsonic acid,MMA)、二甲基砷酸(dimethylarsinic acid,DMA)、三甲基砷(trimethylarsine,TMA)、三甲基砷氧化物(trimethylarsine oxide,TMAO)、亞砷酸鹽(As(Ⅲ))、砷酸鹽(As(Ⅴ))、四甲基砷離子(tetramethylarsonium ion,TETRA)、砷甜菜堿(arsenobetaine,AsB)、砷膽堿(arsenocholine,AsC)和砷糖(arsenic sugar,AsS)等[10-11]。Martin等[12]研究發現,海藻中砷的存在形態主要以AsB和無機砷兩種形態存在。植物食品中主要以As(Ⅲ)、As(Ⅴ)、MMA、DMA和AsB 5 種形式存在。動物食品中主要以AsB、DMA和As(Ⅴ)3 種形態存在[13]。Brisbin等[14]研究表明,龍蝦中存在AsB、AsC、As(V)、As(Ⅲ)、DMA和MMA 6 種不同形態。李祎等[15]研究發現砷在魷魚絲、蝦皮、魷魚干、章魚干和鱈魚脆皮等海鮮干制品中主要以AsB、As(Ⅲ)、As(Ⅴ)、MMA和DMA等形態存在。
1.2.3 鎘
食品中鎘(Cd)的存在形態主要是與蛋白質、脂類和多糖等形成螯合配體。Isaure[16]、Kaneta[17]等研究表明植物中的鎘與硫蛋白、含氧/氮配體和含硫配體相結合形成螯合物,與硫蛋白的結合量為12 mg/g。Sasaki等[18]采用掃描電子顯微鏡和X射線光譜研究發現,在新鮮魚醬油中的鎘與蛋白質相結合形成螯合物,以螯合配體形態存在。
1.2.4 鉛
鉛(Pb)在食品中主要以無機態和有機態存在,植物性食品中以硝酸鉛、草酸鉛、氯化鉛和砷酸鉛等多種無機態存在,如水果表面存在的砷酸鉛[19]。動物性食品中存在無機態和有機態兩種形式,例如中國傳統皮蛋中以無機態的氧化鉛存在,而在加拿大哈利法克斯魚體中,檢測出的是有機態四烷基鉛。Chang Lanfang等[20]使用反相高效液相色譜-電感耦合等離子體-質譜聯用(reversed phase high-performance liquid chromatographyinductively coupled plasma-mass spectrometry,RP-HPLCICP-MS)技術研究發現,旗魚的肌肉中鉛以Pb2+、四乙基鉛和四甲基鉛3 種形態存在。
1.3 食品中重金屬的危害
食品重金屬通過消化道進入機體,在體內蓄積后主要對人體的神經系統、免疫系統、心血管系統、生殖系統和骨骼系統等具有毒性作用,同時還有致癌、致畸、致突變“三致”的危害[21]。食品中重金屬以汞毒性最大,其次是鎘、鉛和砷。
食品中有機汞的毒性遠大于無機汞,甲基汞的毒性主要是由于與含硫醇基如半胱氨酸、谷胱甘肽、半胱氨酸白蛋白等相結合,導致人體中樞神經系統損傷[22]。砷元素的毒性極低,但砷化合物均有劇毒,其中以As3+的化合物毒性最強。砷的毒性主要表現在與機體細胞酶系統結合,導致酶失活。砷通過食物進入機體,在肝、腎、骨骼和肌肉等組織器官中蓄積,引起慢性砷中毒。砷還具有致癌和致畸作用,能引起皮膚癌和誘發畸胎[23]。鎘通過食物進入人體后,與低分子硫蛋白結合形成金屬硫蛋白蓄積在肝腎等器官中,對巰基酶活性具有較強的抑制作用,主要損害肝腎、骨骼和消化系統。同時,鎘化合物對動物和人具有一定的“三致”作用。鉛進入人體后可與含氮、氧、硫基團有機物相結合形成大分子復合物,還可與線粒體及線粒體膜、細胞膜上的蛋白質相結合,抑制ATP酶合成,影響能量的形成[24]。對機體的肝、腎、腦組織等產生毒作用,并干擾免疫系統的功能。
2 食品中重金屬的清除方法
2.1 物理法
物理法應用低頻超聲波、冷熱水交換和吸附等技術,并輔助以拋光去表皮、清洗和漂洗等處理手段清除谷物和牛乳中的重金屬。家庭烹飪方法如蒸、煮、煎、炸等也可清除食品的一些重金屬[25]。Porova等[26]研究低頻超聲波(20 kHz)處理可有效地清除牛乳中殘留的鉛、砷、汞,且對牛乳的品質沒有顯著影響。Mihuca等[27]利用冷水和熱水(6∶1)反復交替清洗大米,可有效清除大米中的亞砷酸鹽。Carey等[28]利用水和米比例為12∶1進行蒸煮,能夠清除大米中57%的砷,而應用過濾式咖啡壺煮米飯,能夠清除60%~70%的砷。由于食品種類不同,水產和肉類等食品對重金屬離子的結合能力不同,物理法的清除能力有限。
2.2 化學法
化學法應用樹脂、單寧、檸檬酸鈉和草酸鈉等試劑通過有機離子捕獲、等離子交換、形成絡合物、螯合作用和微量沉淀等方法除去食品中的重金屬[29-30]。Hajeb等[31]應用半胱氨酸、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、NaCl和HCl復合液清除鯖魚片中汞,結果表明pH 3.75、1.25%半胱氨酸、275 mg/L EDTA和0.5% NaCl復合處理18 min,能有效除去魚片中91%的汞。Sele等[32]應用脫臭的蒸汽凈化水產品中的砷,凈化后的沙鰻和鯡魚油中砷的總含量分別降低了10%和23%。Azelee等[33]采用檸檬酸鈉、草酸鈉和醋酸鈉3 種螯合劑處理翡翠貽貝中砷、鉛和鎘等重金屬,結果表明醋酸鈉的去除率分別為:砷59.50%、鉛88.57%、鎘68.01%;草酸鈉的去除率分別為:砷46.89%、鉛85.46%、鎘60.41%;檸檬酸鈉的清除率分別為:砷38.13%、鉛68.90%、鎘70.49%。Sasaki等[18]利用螯合樹脂與單寧結合法能夠有效地降低魚油中16 倍的鎘。王成等[34]利用碳羥基磷灰石(carbon hydroxyapatite,CHAP)脫除海鮮汁中的重金屬Cd2+,通過優化的工藝參數:32.5 g/L CHAP、pH 5.4、50.0 ℃對海鮮汁中Cd2+清除率高達93.1%。但一些有毒化學試劑的使用可能會在食品中形成殘留危害人類健康。
2.3 生物法
生物法主要是通過植物及其提取物、真菌和細菌等微生物的吸附或蓄積作用清除食品中的重金屬,其中包括茶葉、咖啡、殼聚糖、絲狀真菌和乳酸菌等。Ouédraogo等[35]研究表明,茶葉使生鯊魚肉和鯖魚中汞的含量降低50%~60%,生金槍魚肉降低35%;咖啡使生鯖魚中汞的含量降低50%,金槍魚和生鯊魚降低10%~30%;加入160 mg咖啡后熟金槍魚中汞的含量降低5%~25%。Ibrahim等[36]報道Lactobacillus rhamnosus LC-705對混合后鎘和鉛具有吸附作用,研究表明乳酸菌通過吸附蛋白或細胞表面離子的吸附作用,成為潛在的重金屬生物吸附劑。生物法具有安全、無殘留、無污染的優勢,適用于肉類、水產等食品。
3 乳酸菌降解食品中重金屬的研究進展
對食品中重金屬具有清除作用的微生物主要包括真菌和細菌兩大類,真菌主要包括青霉、曲霉、木霉、酵母和木耳等,細菌包括假單胞菌屬、葡萄球菌屬、芽孢桿菌屬、腸桿菌科和乳酸菌等[37-40]。乳酸菌是一類能夠發酵糖類形成乳酸的革蘭氏陽性細菌的統稱,廣泛存在于傳統發酵食品、動物腸道、飼料等中,大量研究表明乳酸菌具有清除食品中重金屬的作用。
表1是不同來源乳酸菌和一些標準菌株清除不同重金屬的作用及效果,從中可以看出,來源于發酵食品、水產養殖環境的淤泥、動物腸道等生態環境的乳酸菌包括:Weissella、Lactobacillus、Streptococcus、Pediococcus、Enterococcus和Bifidobacterium等屬。對稻米、果蔬、牛乳、魚腸道、緩沖液中重金屬污染物具有較好的清除作用,不同菌株對不同重金屬的清除率存在一定差異,Weissella viridescens MYU 205和Lactobacillus sakei MYU 10對汞清除率分別為80%和99.1%。Lactobacillus bulgaricus和Streptococcus thermophilus兩種乳酸菌復合后對砷的清除效果顯著增強,清除率達到97.8%。Enterococcus faecium EF031和E. faecium M74對水中鎘的清除效果較好,清除率達到53.5%~98.1%。E. faecium EF031和E. faecium M74對鉛清除作用較強,清除率達42.9%~98.9%。Lactobacillus reuteri Pb71-1對MRS培養基中鉛的清除率為59%,效果較好。
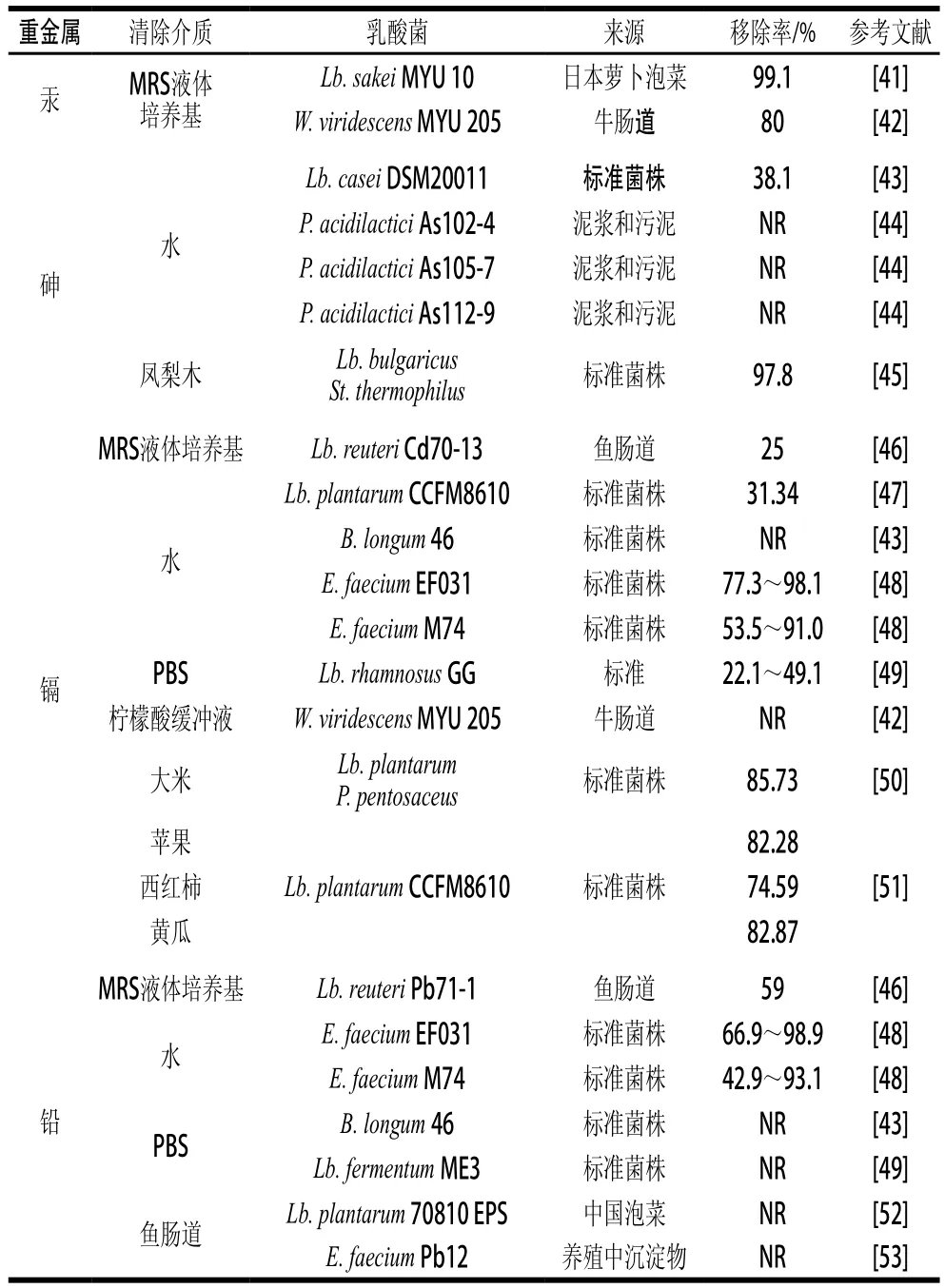
表1 清除重金屬的乳酸菌種類及作用效果Table 1 Lactic acid bacterial species able to remove heavy metals
3.1 乳酸菌清除食品中重金屬的作用機制
乳酸菌主要依靠細胞表面吸附作用將未經代謝的游離重金屬離子通過正負電荷結合到細胞壁表面,細胞壁主要由肽聚糖、磷壁酸和中性多糖等組成,磷壁酸和多糖形成的網狀結構有利于黏著和吸附重金屬[54]。乳酸菌細胞表面的蛋白質擁有大量帶負電荷的官能團,能夠有效結合金屬陽離子。乳酸菌代謝產生的乳酸所形成的酸性環境對重金屬絡合物具有增溶作用,乳酸菌代謝形成的多糖、多肽和核酸等大分子物質表面帶有COO-、HPO4-和OH-等基團,可與金屬離子發生靜電吸附作用[55-56]。Avall-J??skel?inen等[54]研究發現Lactobacillus brevis細胞表面的S-Layer蛋白具有結合Cd2+的能力。
3.2 乳酸菌清除食品中重金屬的作用效果
3.2.1 汞
Lactobacillus和Weissella等通過細胞表面吸附方式對食品中汞具有清除作用。Kinoshita等[41]從日本泡菜和韓國泡菜、牛和豬腸道、清酒和乳酪等中分離篩選獲得11 株乳酸菌,對MRS培養基中汞的吸附效果分析,結果表明,Lb. sakei MYU 10和W. viridescens MYU 205可有效清除MRS培養基中0.852 ?g/mL和0.459 ?g/mL的汞(Ⅱ),平均每個細胞吸附0.198 pg和0.052 pg汞。Kinoshita等[42]后續應用已知菌株W. viridescens MYU 205對MRS培養基中汞清除作用研究,結果表明W. viridescens MYU 205對汞的親和力較高,可有效清除80%的Hg2+。
3.2.2 砷
清除砷的乳酸菌菌屬主要包括Lactobacillus、Streptococcus和Pediococcus,主要對細菌細胞表面帶有負電荷的有機分子胺基化,胺基化的細胞表面帶正電荷,可通過靜電吸附作用清除帶負電荷的砷化合物。Halttunen等[43]采用被胺基化的菌株Lactobacillus acidophilus NCFM、Lactobacillus casei DSM20011和Lactobacillus crispatus DSM20584等吸附水中帶負電荷的As(V),研究發現Lb. casei DSM20011在pH 7.0、22 ℃條件下孵育5 min可移除38.1%的1.0 mg/L As(Ⅴ)。Bhakta等[44]從越南和日本被廢水污染的運河、印度污水處理廠的泥漿和污泥中共分離103 株乳酸菌,篩選出對水中砷的清除效果較好的菌株Pediococcus acidilactici As102-4、P. acidilactici As105-7和P. acidilactici As112-9,分別能清除0.006、0.13、0.76 ?g/(h?mg)(以細胞鮮質量計)。Chang等[45]應用來自日本生物資源中心的標準菌株Lb. bulgaricus和S. thermophilus復合能有效清除鳳梨木中97.8%的砷。
3.2.3 鎘
乳酸菌對水、糧食、水果和蔬菜等食品中的鎘具有清除作用,主要包括Weissella、Lactobacillus、Pediococcus、Enterococcus和Bifidobacterium等屬。Bhakta等[46]從魚腸道中篩選出具有良好黏著力菌株Lb. reuteri Cd70-13,對MRS培養基中的鎘清除率為25%。Zhai Qixiao等[47]利用菌株Lactobacillus plantarum CCFM8610可有效清除初質量濃度5 mg/L鎘-水溶液中31.34%的鎘。Halttunen等[43]研究發現菌株Bif i dobacterium longum 46能夠清除水中54.7 mg/g(以干質量計)的鎘。Topcu等[48]研究表明菌株E. faecium EF031和E. faecium M74能有效清除水中鎘,清除范圍分別為77.3%~98.1%和53.5%~91.0%。Halttunen等[49]研究發現菌株Lactobacillus rhamnosus GG通過細胞表面靜電吸附作用清除PBS中22.1%~49.1%的鎘。Kinoshita等[42]從牛腸道環境中分離獲得菌株W. viridescens MYU 205能有效降低pH 6.0檸檬酸緩沖液中10.46 μg鎘(Ⅱ)Cd(NO3)2,平均每個細胞吸附5.25 fg鎘(Ⅱ)。Fu Yaping等[50]應用Lb. plantarum和Pediococcus pentosaceus按2∶1混合后,以3%接種量,在40.8 ℃條件下發酵23.4 h可有效除去大米中85.73%的鎘。Zhai Qixiao等[51]應用Lb. plantarum CCFM8610對水果和蔬菜汁中鎘清除效果研究,結果表明Lb. plantarum CCFM8610處理后對蘋果、西紅柿和黃瓜汁鎘的清除率分別為82.28%、74.59%和82.87%。
3.2.4 鉛
Lactobacillus、Enterococcus和Bifidobacterium等乳酸菌對MRS培養基、水、PBS和魚腸道中鉛均有清除作用。Bhakta等[46]從魚腸道中分離篩選出菌株Lb. reuteri Pb71-1,對MRS培養基中鉛的清除效果較好,清除率達59%。Topcu等[48]應用菌株E. faecium M74和E. faecium EF031對水介質中鉛去除率范圍分別為42.9%~93.1%和66.9%~98.9%。Halttunen等[43]利用菌株B. longum 46可清除PBS中175.7 mg/g的鉛。Halttunen等[49]研究發現菌株B. longum 46和Lactobacillus fermentum ME3通過靜電作用在細胞表面吸附大量的鉛顆粒,對PBS中鉛的吸附能力分別為0.33 mmol/g和0.45 mmol/g。Feng Meiqin等[52]從中國傳統泡菜中分離出菌株Lb. plantarum 70810 EPS,其在pH 5.0、30 ℃條件下6 h對魚腸道鉛的吸附效率高達160.62 mg/g,通過掃描電子顯微鏡觀察Lb. plantarum 70810 EPS細胞表面吸附了大量鉛(Ⅱ)粒子,傅里葉變換紅外光譜分析表明參與吸附的官能團有—OH、—NH、—CH2、C=O、C—N和COO—等。Bhakta等[53]從沿海水產養殖環境的沉淀物中分離篩選出具有抗重金屬的乳酸菌E. faecium Pb12,它對鉛的最大耐性質量濃度為8 000 mg/L,通過細胞的表面吸附作用能夠有效清除魚腸道內0.046 mg/(h?g)鉛。
4 結 語
近些年來,由于環境污染的加劇,空氣、水和土壤中有毒重金屬通過食物鏈的生物富集作用進入糧食、果蔬、水產等農產品中,導致食品中重金屬殘留的安全問題,不僅造成巨大的經濟損失,而且給消費者帶來食品安全風險。利用微生物技術清除食品中重金屬殘留具有成本低、無殘留、安全高效等特點。目前,已從傳統發酵食品、水產養殖和動物腸道等生態環境中篩選出Weissella、Lactobacillus、Streptococcus、Pediococcus、Enterococcus和Bifidobacterium等乳酸菌類群,其通過細胞表面吸附作用對食品中汞、砷、鎘和鉛等重金屬具有良好的吸附和清除作用,大量研究表明,作為公認安全(generally recognized as safe,GRAS)級生物制劑,乳酸菌在清除食品重金屬殘留方面具有突出的作用。然而,現階段乳酸菌清除食品中重金屬研究正處于起步階段,主要開展的活性乳酸菌的篩選、作用機制的探究,對食品中的應用還處于實驗室和小規模水平。乳酸菌來源廣泛且種類繁多,清除作用機制復雜而多樣,因此,仍要進一步挖掘清除作用強且適用性廣的乳酸菌菌株,深入探究乳酸菌清除食品中重金屬的作用機制,從實驗室小規模研究逐漸拓展到規模化實際生產中的應用。
[1] 歐忠平, 潘教麥. 食品中的重金屬污染及其檢測技術[J]. 中國儀器儀表, 2008(2): 68-70. DOI:10.3969/j.issn.1005-2852.2008.02.016.
[2] 毛雪飛. 國內外糧食產品重金屬污染監測對比與分析[J]. 農產品質量與安全, 2014(6): 7-11. DOI:10.3969/j.issn.1674-8255.2014.06.002.
[3] TONGESAYI T, FEDICK P, LECHNER L, et al. Daily bioaccessible levels of selected rssential but toxic heavy metals from the consumption of non-dietary food sources[J]. Food and Chemical Toxicology, 2013, 62(12): 142-147. DOI:10.1016/j.fct.2013.08.052.
[4] FERREIRA S L C, LEMOS V A, SILVA L O B, et al. Analytical strategies of sample preparation for determination of mercury in food matrices: a review[J]. Microchemical Journal, 2015, 121: 227-236. DOI:10.1016/j.microc.2015.02.012.
[5] 曹程明, 冷桃花, 解楠, 等. 貝類水產品中汞的形態分析[J]. 食品科學, 2013, 34(22): 193-197. DOI:10.7506/spkx1002-6630-201322039.
[6] HARRIS H H, PICKERING I J, GEORGE G N. The chemical form of mercury in fish[J]. Science, 2003, 301: 1203. DOI:10.1126/ science.1085941.
[7] PARK J S, JUNG S Y, SON Y J, et al. Total mercury, methylmercury and ethylmercury in marine fish and marine fishery products sold in Seoul, Korea[J]. Food Additives and Contaminants. Part B. Surveillance, 2011, 4(4): 268-274. DOI:10.1080/19393210.2011.638087.
[8] 程柳, 毛宇翔, 王梅, 等. 小浪底水庫水體中重金屬含量的測定和健康風險評價[J]. 安全與環境學報, 2015(1): 319-324. DOI:10.13637/ j.issn.1009-6094.2015.01.067.
[9] 田洪蕓, 任雪梅, 馮煒, 等. GB 2762—2012《食品安全國家標準食品中污染物限量》的解讀[J]. 中國科技博覽, 2013(25): 295-296. DOI:10.3969/j.issn.1008-4819.2013.03.001.
[10] CHOI H, PARK S K, KIM D S, et al. Determination of 6 arsenic species present in seaweed by solvent extraction, clean-up, and LCICP/MS[J]. Food Science and Biotechnology, 2011, 20(1): 39-44. DOI:10.1007/s10068-011-0006-9.
[11] MAEIANNE M, MARIE U S, MARGRETE M H, et al. Arsenic in the human food chain, biotransformation and toxicology- review focusing on seafood arsenic[J]. Journal of Trace Elements in Medicine and Biology, 2015, 31: 249-259. DOI:10.1016/j.jtemb.2015.01.010.
[12] MARTIN R, JOHN L, NICOLA L, et al. Arsenic in seaweed-forms, concentration and dietary exposure[J]. Food and Chemical Toxicology, 2007, 45(7): 1263-1267. DOI:10.1016/j.fct.2007.01.007.
[13] 齊慧, 賈瑞琳, 陳銘學. 食品中砷形態分析研究進展[J]. 中國農學通報, 2012, 28(36): 277-281. DOI:10.3969/j.issn.1000-6850.2012.36.049. [14] BRISBIN J A, CLAYTON B, CARUSO J A. A gradient anion exchange chromatographic method for the speciation of arsenic in lobster tissue extracts[J]. Talanta, 2002, 58(1): 133-145. DOI:10.1016/ S0039-9140(02)00262-X.
[15] 李祎, 陳苗苗, 譚婷婷, 等. 常見海鮮干制品類即食食品中砷形態的測定[J]. 食品科技, 2014, 39(6): 303-307. DOI:10.13684/j.cnki. spkj.2014.06.065.
[16] ISAURE M P, FAYARD B, SARRET G, et al. Localization and chemical forms of cadmium in plant samples by combining analytical electron microscopy and X-ray spectromicroscopy[J]. Spectrochimica Acta Part B: Atomic Spectroscopy, 2006, 61(12): 1242-1252. DOI:10.1016/j.sab.2006.10.009.
[17] KANETA M, HIKICHI H, ENDO S, et al. Chemical form of cadmium (and other heavy metals) in rice and wheat plants[J]. Environmental Health Perspectives, 1986, 65(1): 33-37. DOI:10.1289/ehp.866533.
[18] SASAKI T, ARAKI R, MICHIHATA T, et al. Removal of cadmium from fish sauce using chelate resin[J]. Food Chemistry, 2015, 173: 375-381. DOI:10.1016/j.foodchem.2014.08.134.
[19] 陳維, 周耀明, 張倩倩, 等. 萃取技術和聯用技術在鉛的形態分析中的應用[J]. 常熟理工學院學報, 2005, 19(2): 45-51. DOI:10.3969/ j.issn.1008-2794.2005.02.011.
[20] CHANG Lanfang, JIANG S J, SAHAYAM A C. Speciation analysis of mercury and lead in fish samples using liquid chromatographyinductively coupled plasma mass spectrometry[J]. Journal of Chromatography A, 2007, 1176(1/2): 143-148. DOI:10.1016/ j.chroma.2007.10.072.
[21] 張敏. 淺談食品中重金屬的來源和危害[J]. 廣東化工, 2015, 42(23): 131; 141. DOI:10.3969/j.issn.1007-1865.2015.23.059.
[22] 劉英, 李全樂. 汞及其化合物的神經毒性及機制研究進展[J].河南預防醫學雜志, 2006, 17(1): 46-47. DOI:10.3969/j. issn.1006-8414.2006.01.022.
[23] JENNRICH P. The influence of arsenic, lead, and mercury on the development of cardiovascular diseases[J]. ISRN Hypertension, 2013(12): 699-710. DOI:10.5402/2013/234034.
[24] 王健梅. 鉛對人體的危害[J]. 現代冶金, 1999(6): 115-117.
[25] NAITO S, MATSUMOTO E, SHINDOH K, et al. Effects of polishing, cooking, and storing on total arsenic and arsenic species concentrations in rice cultivated in Japan[J]. Food Chemistry, 2015, 168: 294-301. DOI:10.1016/j.foodchem.2014.07.060.
[26] POROVA N, BOTYINNIKOVA V, KRASULYA O, et al. Effect of ultrasonic treatment on heavy metal decontamination in milk[J]. Ultrasonics Sonochemistry, 2014, 21(6): 2107-2111. DOI:10.1016/ j.ultsonch.2014.03.029.
[27] MIHUCA V G, TAT?R E, VIR?G I, et al. Arsenic removal from rice by washing and cooking with water[J]. Food Chemistry, 2007, 105(4): 1718-1725. DOI:10.1016/j.foodchem.2007.04.057.
[28] CAREY M, XIAO J J, FARIAS J G, et al. Rethinking rice preparation for highly efficient removal of inorganic arsenic using percolating cooking water[J]. PLoS ONE, 2015, 10(7): 1-12. DOI:10.1371/journal. pone.0131608.
[29] SASAKI T, MICHIHATA T, KATSUYAMA Y, et al. Effective removal of cadmium from fish sauce using tannin[J]. Journal of Agricultural and Food Chemistry, 2013, 61(6): 1184-1188. DOI:10.1021/jf304520v.
[30] SCHNEIDERMAN R. Modern standardization: case studies at the crossroads of technology, economics, and politics[M]. Weinheim: Wiley-IEEE Standards Association, 2015: 232. DOI:10.1002/9781119043492.
[31] HAJEB P, JINAP S. Reduction of mercury from mackerel fillet using combined solution of cysteine, EDTA, and sodium chloride[J]. Journal of Agricultural and Food Chemistry, 2012, 60(23): 6069-6076. DOI:10.1021/jf300582j.
[32] SELE V, AMLUND H, BERNTESSEN M H G, et al. Detection of arsenic-containing hydrocarbons in a range of commercial fish oils by GC-ICPMS analysis[J]. Analytical and Bioanalytical Chemistry, 2013, 405(15): 5179-5190. DOI:10.1007/s00216-013-6925-y.
[33] AZELEE I W, ISMAIL R, WAN A W A B, et al. Catalyzed trisodium citrate as a medium for heavy metals treatment in green-lipped mussels (Perna viridis)[J]. Modern Research in Catalysis, 2013, 2(2): 50-56. DOI:10.4236/mrc.2013.22A008.
[34] 王成, 皎皎, 趙艷芳, 等. 魷魚酶解鮮味汁Cd2+脫除工藝研究[J]. 食品工業科技, 2014, 35(2): 251-254. DOI:10.13386/ j.issn1002-0306.2014.02.049.
[35] OU?DRAOGO O, AMYOT M. Effects of various cooking methods and food components on bioaccessibility of mercury from fish[J]. Environmental Research, 2011, 111(8): 1064-1069. DOI:10.1016/ j.envres.2011.09.018.
[36] IBRAHIM F, HALTTUNEN T, TAHVONEN R, et al. Probiotic bacteria as potential detoxification tools: assessing their heavy metal binding isotherms[J]. Canadian Journal of Microbiology, 2006, 52(9): 877-885. DOI:10.1139/w06-043.
[37] LI M, TIAN X, LIU R Z, et al. Combined application of rice straw and fungus Penicillium chrysogenum to remediate heavy-metalcontaminated soil[J]. Soil and Sediment Contamination, 2013, 23(3): 328-338. DOI:10.1080/15320.383.2014.827623.
[38] BABU A G, SHIM J, BANG K S, et al. Trichoderma virens PDR-28: a heavy metal-tolerant and plant growth-promoting fungus for remediation and bioenergy crop production on mine tailing soil[J]. Journal of Environmental Management, 2014, 132(10): 129-134. DOI:10.1016/j.jenvman.2013.10.009.
[39] HUANG H W, CAO L X, WAN Y X, et al. Biosorption behavior and mechanism of heavy metals by the fruiting body of jelly fungus (Auricularia polytricha) from aqueous solutions[J]. Applied Microbiology and Biotechnology, 2012, 96(3): 829-840. DOI:10.1007/ s00253-011-3846-6.
[40] CHATURVEDI A D, PAL D, PENTA S, et al. Ecotoxic heavy metals transformation by bacteria and fungi in aquatic ecosystem[J]. World Journal of Microbiology and Biotechnology, 2015, 31(10): 1595-1603. DOI:10.1007/s11274-015-1911-5.
[41] KINOSHITA H, SOHMA Y, OHTAKE F, et al. Biosorption of heavy metals by lactic acid bacteria and identification of mercury binding protein[J]. Research in Microbiology, 2013, 164(7): 701-709. DOI:10.1016/j.resmic.2013.04.004.
[42] KINOSHITA H, OHTAKE F, ARIGA Y, et al. A comparison and characterization of biosorption by Weissella viridescens MYU 205 of periodic group 12 metal ions[J]. Animal Science Journal, 2016, 87(2): 271-276. DOI:10.1111/asj.12425.
[43] HALTTUNEN T, FINELL M, SALMINEN S. Arsenic removal by native and chemically modified lactic acid bacteria[J]. International Journal of Food Microbiology, 2007, 120(12): 173-178. DOI:10.1016/ j.ijfoodmicro.2007.06.002.
[44] BHAKTA J N, MUNEKAGE Y, OHNISHI K, et al. Isolation and characterization of cadmium-and arsenic-absorbing bacteria for bioremediation[J]. Water Air & Soil Pollution, 2014, 225(10): 1-10. DOI:10.1007/s11270-014-2151-2.
[45] CHANG Y C, CHOI D B, KIKUCHI S. Enhanced extraction of heavy metals in the two-step process with the mixed culture of Lactobacillus bulgaricus and Streptococcus thermophilus[J]. Bioresource Technology, 2012, 103(1): 477-480. DOI:10.1016/ j.biortech.2011.09.059.
[46] BHAKTA J N, MUNEKAGE Y, OHNISHI K, et al. Isolation and identification of cadmium and lead-resistant lactic acid bacteria for application as metal removing probiotic[J]. International Journal of Environmental Science and Technology, 2012, 9(3): 433-440. DOI:10.1007/s13762-012-0049-3.
[47] ZHAI Qixiao, YIN Ruijie, YU Leilei, et al. Screening of lactic acid bacteria with potential protective effects against cadmium toxicity[J]. Food Control, 2015, 54(10): 23-30. DOI:10.1016/ j.foodcont.2015.01.037.
[48] TOPCU A, BULAT T. Removal of cadmium and lead from aqueous solution by Enterococcus faecium strains[J]. Journal of Food Science, 2010, 75(1): 13-17. DOI:10.1111/j.1750-3841.2009.01429.x.
[49] HALTTUNEN T, COLLADO M C, El NEZAMI H, et al. Combining strains of lactic acid bacteria may reduce their toxin and heavy metal removal efficiency from aqueous solution[J]. Letters in Applied Microbiology, 2008, 46(2): 160-165. DOI:10.1111/j.1472-765X.2007.02276.x.
[50] FU Yaping, LIAO Luyan, LIU Yang, et al. Optimization of fermentation process of removal of cadmium in rice powder using lactic acid bacteria[J]. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(6): 319-326. DOI:10.3969/ j.issn.1002-6819.2015.06.044.
[51] ZHAI Qixiao, TIAN Fengwei, WANG Gang, et al. The cadmium binding characteristics of a lactic acid bacterium in aqueous solutions and its application for removal of cadmium from fruit and vegetable juices[J]. RSC Advances, 2016, 6(8): 5990-5998. DOI:10.1039/ C5RA24843D.
[52] FENG Meiqin, CHEN Xiaohong, LI Chengcheng, et al. Isolation and identification of an exopolysaccharide producing lactic acid bacterium strain from Chinese paocai and biosorption of Pb (Ⅱ) by its exopolysaccharide[J]. Journal of Food Science, 2012, 77(6): 111-117. DOI:10.1111/j.1750-3841.2012.02734.x.
[53] BHAKTA J N, OHNISHI K, MUNEKAGE Y, et al. Characterization of lactic acid bacteria-based probiotics as potential heavy metal sorbents[J]. Journal of Applied Microbiology, 2012, 112(6): 1193-1206. DOI:10.1111/j.1365-2672.2012.05284.x.
[54] AVALL-J??SKEL?INEN S, LINDHOLM A, PALVA A. Surface display of the receptor-binding region of the Lactobacillus brevis S-layer protein in Lactococcus lactis provides nonadhesive lactococci with the ability to adhere to intestinal epithelial cells[J]. Applied and Environmental Microbiology, 2003, 69(4): 2230-2236. DOI:10.1128/ AEM.69.4.2230-2236.2003.
[55] SOLIOZ M, MERMOD M, ABICHT H K, et al. Responses of lactic acid bacteria to heavy metal stress[M]// TSAKALIDOU E, PAPADIMITRIOU K. Stress Responses of Lactic Acid Bacteria. New York: Springer, 2011: 163-195. DOI:10.1007/978-0-387-92771-8-9.
[56] PULSAWAT W, LEKSAWASDI N, ROGERS P L, et al. Anions effects on biosorption of Mn(Ⅱ) by extracellular polymeric substance (EPS) from Rhizobium etli[J]. Biotechnology Letters, 2003, 25(15): 1267-1270. DOI:10.1023/A:1025083116343.
Removal of Heavy Metals from Foods by Lactic Acid Bacteria Biosorption: A Review
MA Huanhuan, BAI Fengling*, LI Jianrong
(National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, Food Safety Key Laboratory of Liaoning Province, College of Food Science and Engineering, Bohai University, Jinzhou 121013, China)
Heavy metal pollution is one of the hot topics in food safety, which has become a problem of increasing concern. The sources of heavy metal pollutants such as mercury, arsenic, cadmium and lead in foods and their chemical forms and harms to human beings, as well as removal methods are discussed in this article. Meanwhile, we review recent progress in the discovery of lactic acid bacterial species able to remove heavy metals from foods and the underlying mechanism as well as their applications in the food field, which will provide references and guidance for the removal of heavy metals from foods using lactic acid bacteria biosorption.
lactic acid bacteria; biosorption; removal; heavy metals
10.7506/spkx1002-6630-201711047
TS201.3
A
1002-6630(2017)11-0301-07引文格式:
2016-05-20
遼寧省科技廳攻關項目(2015103020)
馬歡歡(1991—),女,碩士研究生,研究方向為食品安全與質量控制。E-mail:mahuanhuan14@163.com
*通信作者:白鳳翎(1964—),男,教授,博士,研究方向為食品安全與質量控制和食品微生物學。E-mail:baifling@163.com

