貝伐單抗在中低位直腸癌新輔助治療中的有效性及安全性觀察
江時建,朱代華
(1.福建醫科大學附屬閩東醫院腫瘤外科,福建 福安 355000;2.重慶醫科大學附屬第二醫院胃腸外科,重慶 400010)
近年來,結直腸癌不僅發病率逐年增高,而且呈現出年輕化的趨勢[1-2],以氟脲嘧啶為基礎的新輔助放化療提高了中低位局部進展期直腸癌的根治性手術切除率及保肛率,但其病理完全緩解(pathological complete remission,pCR)率及降期率仍然較低。貝伐單抗抑制腫瘤血管生成的同時還可以使已形成的腫瘤血管正常化,降低腫瘤組織血管的通透性增加化療藥物在腫瘤組織中的濃度,起到與化療協同的作用。NO16966,ATIST,AVF2017,E3200等多個多中心研究均證實了貝伐單抗在治療晚期結直腸癌中的作用。另外,抗血管生成作用可能增加腫瘤對放療的敏感性,加速腫瘤細胞的壞死與凋亡[3-5],本研究收集相關病例,探討貝伐單抗在低位直腸癌新輔助治療中的有效性及安全性。
1 資料與方法
1.1 一般資料
收集重慶醫科大學附屬第二醫院胃腸肛腸外科自2010-11—2016-07間中低位局部進展期直腸癌行貝伐單抗聯合以FOLFOX方案新輔助放化療患者為觀察組,選同一時期行FOLFOX方案新輔助放化療患者為對照組。入選標準:(1)根據美國癌癥協會(AJCC)的第7版TNM分期標準,術前分期為II期及III期中低位直腸腺癌;(2)開腹手術;(3)自愿簽署術前新輔助放化療知情同意書。排除標準:(1)年齡>65歲;(2)完全性腸梗阻;(3)原發灶巨大潰瘍;(4)藥物無法控制的嚴重高血壓;(5)有活動性出血或出血傾向及具有先天性出血素質或獲得性凝血病;(6)有心腦血管栓塞及動靜脈血栓病史者;(7)肝腎功能不全者;(8)過度肥胖,體重指數(BMI)>30,嚴重營養不良(BMI)<15者;(9)1型或2型糖尿病血糖控制不滿意(空腹血糖>10 mmol/L);(10)過敏體質或對多種藥物(2種以上)有過敏史者。
搜集到符合上述條件患者共56例,其中觀察組共25例,其中男性患者17例,女性患者8例,最小年齡33歲,最大年齡65歲。觀察組共31例,其中男性患者21例,女性患者10例,最小年齡34歲,最大年齡65歲。觀察組術前臨床病理分期Ⅱ期患者有6例(T3N0M0 4例、T4N0M0 2例),Ⅲ期有19例(T2N1M0 1例、T3N1M0 7例、T3N2M0 2例、T4N1M0 5例、T4N2M0 4例)。對照組術前臨床分期II期有9例(T3N0M0 7例、T4N0M0 2例),Ⅲ期22例(T2N1M0 1例、T3N1M0 8例、T3N2M0 3例、T4N1M0 7例、T4N2M0 4例)。兩組在性別比、低位直腸癌比例、術前臨床分期等方面差異均無統計學意義(P>0.05)。見表1。

表1 一般資料情況
1.2 方法
1.2.1 新輔助放化療:觀察組患者采用貝伐單抗聯合FOLFOX方案,具體如下:貝伐單抗5 mg/kg,首次輸注時間不小于90 min。奧沙利鉑(130 mg/m2),替加氟(3.0 g/m2),亞葉酸鈣(200 mg/m2)計算出總量。其中將奧沙利鉑100 mg及替加氟注射液1.0 g在介入下經超選插管至直腸上動脈實施直腸腫瘤滋養動脈局部灌注化療(時間約5min) 。見圖1、圖2 。
新輔助放療方案:化療結束后約兩周行盆腔三維適形放療。采取長程分次放療,總劑量均為40 Gy,均分為20次,4周完成。另外,放療同時行口服卡培他濱(850 mg/m2),放化療期間注意觀察胃腸道毒副反應、檢測血常規、肝腎功能、血壓監測等。

圖1 腸系膜下動脈造影注:4F Yashiro 導管經右側腹股溝動脈插管致腸系膜下動脈行腸系膜下動脈造影

圖2 微插至直腸上動脈遠端注:2.7F微導管選擇性插至腸系膜動脈遠端。患者回病房后,輸注貝伐單抗及剩余劑量的化療藥物,對照組無貝伐單抗,余同上。
1.2.2 術前評估及術前準備:所有患者在放療結束后4周左右回院,行新輔助放化療療效評估,判斷腫瘤有無進展、新輔助放化療后分期,完善血常規、肝腎功能等術前檢查及準備。
1.2.3 手術治療:所有患者在排除手術禁忌,且行充分術前準備后由高級職稱醫師主刀,嚴格按照TME標準實施開腹手術,根據術中動脈血氣分析估算術中失血量。留置骶前引流管一根,主要觀察術后出血。
1.2.4 手術標本處理:術后病理標本均送我院病理科,均需按規范多處取材,常規甲醛固定,石蠟包埋,HE染色等處理,并且行免疫組化判定腫瘤組織的來源及分類。
1.2.5 術后觀察:主要觀察骶前引流管量,有無吻合口漏、術后患者的理論出院時間等。其中術后理論出院時間標準為:(1)患者經口進食能滿足自身能量需求,而不需靜脈營養支持治療;(2)無吻合口瘺、傷口及肺部感染等主要手術并發癥;(3)體溫正常3 d以上;(4)血常規、肝功、生化等實驗室檢查指標正常或存在異常而無需繼續住院治療;(5)患者無明顯不適。

2 結果
2.1 有效性結果
兩組患者經新輔助放化療后評估均無疾病進展病例,均達到直腸癌根治性切除,根治性切除率均達100%,無死亡病例。觀察組有4例達到完全病例緩解,對照組5例。完全病理緩解患者的病理標本病理檢查見腫瘤周圍組織不同程度纖維組織增生腫瘤、細胞變性、組織壞死,甚至空洞形成,見圖3與圖4,圖3是新輔助放化療治療前腸鏡檢查取活組織病理檢查結圖;圖4為該患者經貝伐單抗治療后手術后標本病理圖。完全病例緩解率、總降期率、低位直腸癌保肛率等具體情況見表2。

圖3 新輔助治療前的活組織病理檢查

圖4 含貝伐單抗新輔助治療后標本病

項目PCR率例數(例)百分比(%)總降期率例數(例)百分比(%)T降期率例數(例)百分比(%)N降期率例數(例)百分比(%)距肛緣≤7 cm保肛率例數(例)百分比(%)觀察組(n=25)416.01868.01040.01144.01872.0對照組(n=31) 516.1 2167.7 1341.91548.4 2167.7 P0.990.730.73
2.3 常見不良反應
采用美國國立癌癥研究院2009年頒布的4.0版通常見毒性標準(Nation Cancer Institute Common Toxicity Criteria 4.0,NCT-CTC 4.0),對新輔助放化療治療中出現的常見不良反應進行評估。兩組患者放化療期間主要不良反應為胃腸道及白細胞減少,未發生IV級不良反應,未出現消化道穿孔、輸液反應、動靜脈血栓及可逆性后腦部病綜合征,觀察組的高血壓發生率高于對照組(44%:10%,P=0.03),差異有統計學意義,其他常見放化療不良反應及圍手術期的主要并發癥差異無統計學意義(P>0.05)。見表3。
2.4 圍手術期安全性
兩組患者手術中、術后均未發生大出血,無圍手術期死亡的發生。觀察組術后出現1例吻合口瘺,對照組吻合口瘺2例,3例患者因癥狀及體征較輕,非手術治療后痊愈。兩組患者在手術時間、術中出血量、術后骶前引流量,術后理論出院時間等數據分析上均無統計學意義,見表4。

表3 常見不良反應 例
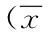
表4 兩組手術情況及圍手術期并發癥情況±s)
3 討論
直腸癌發病率居大腸癌首位,消化系統惡性腫瘤第二位。我國患者就診時腫瘤多處于進展期,嚴重威脅人類的健康。雖然隨著TME手術方式應用,吻合器械的改善及術前以氟尿嘧啶為基礎的輔助放化療一定程度上提高了低位直腸癌的保肛率[6-7]。
新輔助放化療治療在中低位進展期直腸癌的療效中得到肯定,然而病理完全緩解率及降期率仍不高。自貝伐單抗在治療轉移性結直腸癌取得了較好的治療效果后,其治療范圍擴展到實體腫瘤。Velenik等[8]人進行的一項貝伐單抗聯合卡培他濱的術前新輔助放化療中的病理完全緩解率為13.3%,T、N 和總的降期率為46.7%、65%和75%。Dipetrillo T等[9]人進行的一項25例患者行貝伐單抗聯合奧沙利鉑及氟尿嘧啶的術前新輔助放化療研究,其病理完全緩解率為20%。然而,STAR-01[10]、NSABP R-04[11]及ACCORD[12]研究顯示病理完全緩解率并未得到明顯的提高。
本研究主要通過對比分析貝伐單抗能否提高新輔助放化療的病理完全緩解率、病理降期率及低位直腸癌的保肛率,但本研究中有效性指標均未體現出統計學意義,這可能與術前行直腸上動脈栓塞后局部血流減少,影響了局部藥物濃度有關。且由于樣本量少,不能全面評價。此外,貝伐單抗的遠期作用,如局部復發率、術后遠處轉移率以及5年生存期尚在觀察統計中。
本研究中觀察到貝伐單抗組發生高血壓患者明顯高于對照組差異有統計學意義,然而未出現IV級高血壓,貝伐單抗導致高血壓具體機制尚不明確。貝伐單抗未增加常見不良反應的發生率及嚴重程度,未增加手術出血量、吻合口瘺等發生率,顯示出了其具有較高的安全性。
然而,本研究為小樣本研究,僅依據病理完全緩解率、病理降期率及低位直腸癌的保肛率可能難以全面評估貝伐單抗的近期療效,且缺乏對貝伐單抗的遠期療效的觀察,論證可能存在偏倚,尚需包括遠期療效評價標準、大樣本量、隨機對照的臨床研究進一步證實。
[1] FITZGERALD T L,LEA C S,BRINKLEY J,etal.Colorectal cancer outcome inequalities:association between population density,race,and socioeconomic status[J].Rural Remote Health,2014,14:2668.
[2] GIARDIELLO F M,ALLEN J I,AXILBUND J E,etal.Guidenlines on genetic evaluation and management of lynch syndrome:a consensus statement by the US multi-society task force on colorectal cancer[J].Gastroenterology,2014,147:502-506.
[3] SAUER R,FIETKAU R,WITTEKIND C,etal.Adjuvant vs.Neoadjuvant radiochemotherapy for locally advanced rectal cancer:the German trialCAO/ARO/AIO-94[J].Colorectal Dis,2003,5(5):406-415.
[4] SAUER R,BECKER H,HOHENBERGER W,etal.German Rectal Cancer Study Group,Preoperative versus postoperative chemoradiotherapy for rectal cancer[J].N Engl J Med,2004,351(17):1731-1740.
[5] HOFHEINZ R D,WENZ F,POST S,etal.Chemoradiotherapy with capecitabine versus fluorouracil for locally advanced rectal cancer:a randomised,multicentre,non-inferiority,phase 3 trial[J].Lancet Oncol,2012,13(6):579-588.
[6] LEE C G,HEIJN M,DI TOMASO E,etal.Anti-vascular endothelial growth factor treatment augments tumor radiation response under normoxic or hypoxic conditions[J].Cancer Res,2000,60(19):5565-5570.
[7] 楊建偉,林錦源,高煒,等.雷替曲塞/貝伐單抗聯合伊立替康或奧沙利鉑方案治療晚期結直腸癌的臨床觀察[J].2013,18(1):70-73.
[8] WILLETT C G,BOUCHER Y,DUDA D G,etal.Surrogate markers for antiangiogenic therapy and dose-limiting toxicities for bevacizumab with radiation and chemotherapy:continued experience of a phase I trial in rectal cancer patients[J].J Clin Oncol,2005,23(31):8136-8139.
[9] CRANE C H,ENG C,FEGI B W,etal.Phase II trial of neoadjuvant bevacizumab,capecitabine,and radiotherapy for locally advanced rectal cancer[J].Int J Radiat Oncol Biol Phys,2010,76(3):824-830.
[10] R?DEL C,LIERSCH T,BECKER H,etal.Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer:initial results of the German CAO/ARO/AIO-04 randomised phase 3 trial[J].Lancet Oncol,2012,13(7):679-687.
[11] ASCHELE C,CIONINI L,LONARDI S,etal.Primary tumor response to preoperative chemoradiation with or without oxaliplatin in locally advanced rectal cancer:pathologic results of the STAR-01 randomized phase III trial[J].Clin Oncol,2011,29(20):2773-2780.
[12] ROH M S,YOTHERS G A,O’CONNELL M J,etal.The impact of capecitabine and oxaliplatin in the preoperative multimodality treatment in patients with carcinoma of the rectum:NSABP R-04 [J].Clin Oncol,2011,29:3503.

