從新考綱中預測 2017年新課標卷的考查方向
■安徽省靈璧中學 湯 偉(特級教師)
從新考綱中預測 2017年新課標卷的考查方向
■安徽省靈璧中學 湯 偉(特級教師)
針對2017年高考問題,教育部發布了高考大綱、考試說明及題型示例,它給我們復習備考指明了方向,如高考大綱中有些內容做了刪減,有些由了解改為了理解,考試說明中及題型示例中也作出了一些調整。下面我們在具體解讀今年化學高考大綱和考試說明的基礎上,預測一下2017年化學高考的基本方向。
一、立德樹人,體現中華優秀傳統文化
今年的高考化學大綱修訂的依據源于國務院《關于深化考試招生制度改革的實施意見》,黨的十八大報告指出,要把立德樹人作為教育的根本任務,培養德、智、體、美全面發展的社會主義建設者和接班人。十八屆三中全會決定深化教育領域綜合改革,全面貫徹黨的教育方針,堅持立德樹人,加強社會主義核心價值體系教育,完善中華優秀傳統文化教育,增強學生社會責任感、創新精神、實踐能力,推進考試招生制度改革。由此可見, 2017年高考試題中,可能會適當增加對中國傳統文化進行考查的內容,如將中國古代科技文明作為試題背景材料,體現中國傳統科技文化對人類發展和社會進步的貢獻,試題會遵循繼承、弘揚、創新的發展路徑,注重傳統文化在現實中的創造性轉化和創新性發展,從而實現考試的社會意義和現實目的。
有些古文或諺語包含了豐富的化學知識,下列解釋不正確的是( )。

選項 古文或諺語 化學解釋_ _ _ _ _ _ _ _ A 日照香爐生紫煙 碘的升華_ _ _ _ _ _ _ _ B _ _ _ _ _ _ _以曾青涂鐵,鐵赤色如銅 置換反應_ _ C _ _ _ _ _ _ _煮豆燃豆萁,豆在釜中泣 化學能轉化為熱能_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ D雷雨肥莊稼_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _自然界固氮作用
解析:該試題較好地體現了中華優秀的傳統文化與現代文化知識的考查。“日照香爐生紫煙”是一種氣溶膠產生的丁達爾現象,選項A錯誤。“曾青”是CuSO4溶液,鐵與CuSO4發生置換反應,故選項B正確。“豆萁”是大豆的秸稈,主要成分為纖維素,燃燒纖維素是把化學能轉化為熱能,故選項C正確。“閃電下雨”過程發生的主要化學反應有:N2+O2??2NO,2NO+O2??2NO2, 3NO2+H2O??2HNO3+NO,HNO3與土壤中的弱酸鹽反應生成硝酸鹽,農作物吸收NO-3中化合態的氮,其中第一個反應是“將游離態的氮轉化為化合態氮”,屬于自然界固氮作用,故選項D正確。
答案:A
二、關注能力與創新,注重測試考生化學學科素養
新修訂的高考化學大綱強調指出,命題設計上要有利于選拔具有學習潛能和創新精神的考生,以能力測試為主導,在測試考生進一步學習所必需的知識、技能和方法的基礎上,全面檢測考生的化學科學素養。針對化學學科素養,現在基本確定為“宏觀辨識與微觀探析、變化觀念與平衡思想、證據推理與模型認知、實驗探究與創新意識、科學精神與社會責任”五個方面,預計2017年高考化學試題設計和測試過程中,在關注能力與創新的同時,還會進一步強化學學科素養的滲入,讓學生更加重視理論聯系實際,關注與化學有關的科學技術、社會經濟和生態環境的協調發展,由此促進考生在知識和技能、過程和方法、情感、態度和價值觀等方面的全面發展。
能源是國民經濟發展的重要基礎,我國目前使用的能源主要是化石燃料。
(1)已知:①C(s)+O2(g)??CO2(g) ΔH=-393.5kJ·mol-1
②H2(g)+O2(g)??H2O(g) ΔH=-241.8kJ·mol-1
則煤氣化的主要反應C(s)+H2O(g)??CO(g)+H2(g)的ΔH=____。
(2)甲醇制甲醚的有關反應為2CH3OH(g)???CH3OCH3(g)+H2O(g)。一定溫度下,在三個容積均為1.0L的恒容密閉容器中發生該反應如表1。
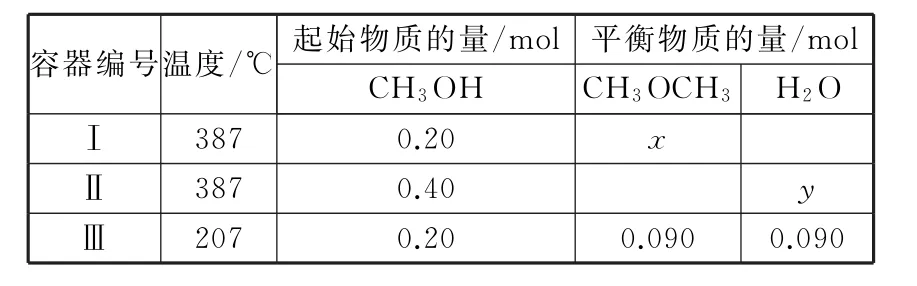
表1
②已知387℃時該反應的化學平衡常數K=4。該溫度下,若起始時向容器Ⅰ中充入0.10molCH3OH(g)、0.15molCH3OCH3(g)和 0.10molH2O(g),則反應將向____(填“正”或“逆”)反應方向進行。
③容器Ⅱ中反應達到平衡后,若要進一步提高甲醚的產率,可以采取的措施為____ (填字母)。
A.升高溫度
B.降低溫度
C.其他條件不變,增加CH3OH的物質的量
D.保持其他條件不變,通入氖氣
(3)以甲醇為主要原料,電化學合成碳酸二甲酯的工作原理如圖1所示。

圖1
則電源的負極為____(填“A”或“B”),寫出陽極的電極反應式:____。
(4)將化石燃料的燃燒產物CO2通入NaOH 溶液中可制得碳酸氫鈉。取0.2mol·L-1碳酸氫鈉溶液與0.2mol·L-1氯化鋇溶液等體積混合產生渾濁,請結合以下數據,通過計算說明產生渾濁的原因: ____。[已知:25℃時,0.1mol·L-1碳酸氫鈉溶液中碳酸根離子的濃度為0.0011mol ·L-1,Ksp(BaCO3)=5.1×10-9]
解析:(1)利用蓋斯定律,反應①-②-③得目標反應,則ΔH=-393.5-(-241.8) -(-283.0)=+131.3(kJ·mol-1)。
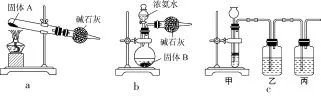
(2)①反應兩邊氣體計量數相等,Ⅰ和Ⅱ的溫度相同,容積不變,則反應的轉化量Ⅱ是Ⅰ的2倍,則。②此時Q=c=1.5 (3)根據圖示可知,右側是陰極,電解時電極反應式為O2+4e-+4H+??2H2O,即B是電源負極,A是電源正極,電解時陽極反應為2CH3OH+CO-2e-??(CH3O)2CO+2H+。 (4)等體積混合后溶液濃度減半,題目已給碳酸根離子濃度,代入可得Qc=10-4>Ksp(BaCO3)=5.1×10-9,故有沉淀產生。 答案:(1)+131.3kJ·mol-1 (3) B 2CH3OH+CO-2e-??(CH3O)2CO+2H+ 尿素(H2NCONH2)是一種非常重要的高氮化肥,同時也具有重要的工業用途。 (1)將尿素溶液噴霧,可進行汽車尾氣的處理,其主要的反應為2H2NCONH2+6NO??5N2+4H2O+2CO2。該反應中氧化劑為____(填化學式),當有1.2mol電子轉移時,消耗的NO在標準狀況下的體積為____L。 (2)工業上利用下列反應合成尿素: 2NH3+CO2???H2NCOONH4(氨基甲酸銨),氨基甲酸銨脫水可生成尿素。某實驗小組模擬制備氨基甲酸銨的裝置如圖2所示。 圖2 已知生成的氨基甲酸銨小晶體懸浮在四氯化碳中;氨基甲酸銨易水解。 ①裝置B中盛放的試劑為____(填字母)。 a.濃硫酸 b.堿石灰 c.氯化鈣 d.硅膠 ②裝置D中,濃硫酸的作用是____。 ③從裝置C中分離出氨基甲酸銨的操作為____(填操作名稱)。 (3)某實驗小組在實驗室里設計了如圖3所示裝置用來制取合成氨基甲酸銨的原料氣體——干燥的氨氣和二氧化碳。 圖3 ①若用圖3a所示裝置制取氨氣,固體A能否用NH4Cl固體?____(填“能”或“不能”),原因是____。 ②若用圖3b所示裝置制取氨氣,固體B可用____(填藥品名稱)。 ③若用圖3c所示裝置制取二氧化碳,則甲中為石灰石與稀鹽酸反應,圖中的乙裝置能否省略?____(填“能”或“不能”),原因是____。 (4)尿素水解可生成(NH4)2CO3,常溫下,NH3·H2O的電離平衡常數Kb=2× 10-5,H2CO3的電離平衡常數K1=4×10-7, K2=4×10-11,則反應NH4+CO2-3+H2O???NH3·H2O+HCO3-的平衡常數K=____。 解析:(1)NO中N元素的化合價為+2,生成物N2中N元素的化合價為0,故NO為氧化劑。每消耗1molNO轉移的電子為2mol,則轉移1.2mol電子時消耗NO的物質的量=1.2÷2=0.6(mol),在標準狀況下NO的體積=22.4L·mol-1×0.6mol =13.44L。(2)濃硫酸具有吸水性,可防止水蒸氣進入裝置C,同時濃硫酸可吸收堿性氣體氨氣。氨基甲酸銨小晶體懸浮在四氯化碳中,屬于固、液體系,分離方法為過濾。(3)①若用圖3a所示裝置制取氨氣,固體A不能用NH4Cl固體,因加熱時氯化銨可分解為氨氣和氯化氫,兩氣體在試管口處冷卻又會重新合成氯化銨固體。②用圖3b所示裝置制取氨氣時,固體B可用生石灰或NaOH。③用圖3c所示裝置制取二氧化碳時,甲中應是石灰石與稀鹽酸發生反應制取二氧化碳,二氧化碳中混有HCl和水蒸氣,需用飽和碳酸氫鈉溶液洗去HCl,用濃硫酸洗去水蒸氣,故乙裝置不可省略。(4)該反應的平衡常數 答案:(1)NO 13.44 (2)①d ②吸收多余的氨氣,防止水蒸氣進入裝置C ③過濾 (3)①不能 加熱時氯化銨可分解為氨氣和氯化氫,在試管口處冷卻,兩氣體又會重新合成氯化銨固體 ②生石灰或NaOH ③不能 二氧化碳中混有的HCl雜質需除去,否則得不到純凈的二氧化碳 (4)12.5 新高考大綱內容作了較大的修訂,考試內容改革的方向不再是單純的選拔功能的優化和提升,而應是更加有意識地發揮考試在育人方面的導向功能,推動素質教育實施,促進人才培養模式轉變,提高教育考試質量,為社會經濟轉型升級提供強有力的人才和智力支撐,用考試改革這根杠桿,來撬動中學教育改革。可以預見,2017年高考試題中,不僅在文科中會加強考查社會主義核心價值觀,其他學科也一定會在試題中滲透社會主義核心價值觀,由此發揮高考對考生的引導和教育作用。 污染物的有效去除和資源的充分利用是化學造福人類的重要研究課題。某研究小組利用軟錳礦(主要成分為MnO2,另含少量鐵、鋁、銅等金屬化合物)作脫硫劑,通過如下簡化流程,既脫除燃煤尾氣中的SO2,又制得電池材料MnO2(反應條件已省略)。 請回答下列問題: (1)上述流程脫硫實現了____(填編號)。 a.廢棄物的綜合利用 b.白色污染的減少 c.酸雨的減少 d.臭氧層空洞的減少 (2)步驟Ⅰ生成無水MnSO4的化學方程式是____。 步驟Ⅳ生成無水MnO2的化學方程式是____。 (3)步驟Ⅱ中,用MnCO3能除去溶液中Al3+和Fe3+,其原因是____。濾渣M的成分是____。銅元素以____形式存在于濾渣N中。 (4)假設脫除的SO2只與軟錳礦漿中MnO2反應。按照流程,將2.0m3(標準狀況)含SO2的體積分數為60%的尾氣通入礦漿,若SO2的脫除率為89.6%,最終得到MnO2的質量10.44kg。則在除去鐵、鋁、銅、鎳等雜質的過程中,所引入的錳元素為____kg。 解析:該試題通過環保知識,不僅考查了化學知識在現實社會中的綜合應用,而且還進一步借助試題情景喚醒考生的社會責任心。(1)題中流程脫硫,可以使物質中的硫轉化為爐渣,然后再綜合利用,同時還可以減少SO2的產生,從而降低空氣污染,因此實現了廢棄物的綜合利用和酸雨的減少。(2)步驟Ⅰ中,SO2與MnO2發生氧化還原反應產生MnSO4,化學方程式是MnO2+SO2??MnSO4;在步驟Ⅳ中MnSO4被酸性KMnO4溶液氧化生成MnO2,反應的化學方程式是2KMnO4+3MnSO4+2H2O??K2SO4+ 5MnO2+2H2SO4。(3)步驟Ⅰ中,MnCO3難溶于水,在溶液中存在沉淀溶解平衡: 可以與溶液中的H+發生反應,使溶液的酸性減弱,這樣就會促進Al3+和Fe3+水解生成氫氧化物沉淀,從而能除去溶液中Al3+和Fe3+,所以濾渣M的成分是Al(OH)3、Fe(OH)3。當向含有雜質的MnSO4中加入MnS時,MnS溶解電離產生S2-,由于c(S2-)·c(Cu2+)>Ksp(CuS),就形成CuS沉淀而進入到濾渣N中。(4)實際反應的SO2的物質的量是n(SO2)=(2000L× 60%×89.6%)÷22.4L·mol-1=48mol,根據方程式MnO2+SO2??MnSO4可知,形成MnSO4的物質的量是48mol,最終形成MnO2的質量是10.44kg×1000g/kg= 1.044×104g,根據方程式3MnSO4+ 2KMnO4+2H2O??5MnO2+K2SO4+ 2H2SO4可知,消耗硫酸錳的物質的量是(10.44×104g÷87g·mol-1)×mol=72mol,則除去鐵、鋁、銅、鎳等雜質時,所引入的錳元素的物質的量是72mol-48mol=24mol,則其中含有的Mn元素的質量是:m(Mn)= 24mol×55g·mol-1=1320g=1.32kg。 答案:(1)a、c (2)MnO2+SO2??MnSO4 (3)消耗溶液中的酸,促進Al3+和Fe3+水解生成氫氧化物沉淀 Al(OH)3、Fe(OH)3CuS (4)1.32 (責任編輯 謝啟剛)
三、注重實踐,從試題的選拔功能中滲透社會責任感



