苦參素聯合復方茵陳顆粒預處理對大鼠急性肝衰竭的防治作用觀察
張弦,蔣道榮,趙華,蔣偉
(1南通大學附屬醫院,江蘇南通226001;2南通大學)
苦參素聯合復方茵陳顆粒預處理對大鼠急性肝衰竭的防治作用觀察
張弦1,蔣道榮1,趙華1,蔣偉2
(1南通大學附屬醫院,江蘇南通226001;2南通大學)
目的 觀察苦參素(OMT)聯合復方茵陳顆粒(FYK)預處理對大鼠急性肝衰竭的防治作用,并探討其機制。方法 雄性SD大鼠90只,隨機分為實驗1組、實驗2組、實驗3組、OMT組、損傷組、對照組,每組15只。OMT組腹腔注射OMT 120 mg/kg,1次/d;實驗1組、實驗2組、實驗3組分別灌服3、6、12 g/(kg·d)的FYK,2 h后再注射OMT,劑量參照OMT組;對照組和損傷組腹腔注射等容量生理鹽水;各組用藥連續3 d。用藥2 d后大鼠禁食24 h,除對照組外,其余各組腹腔注射D-氨基半乳糖(D-GalN)、皮內注射脂多糖(LPS)。24 h后處死大鼠,HE染色觀察肝組織病理改變、全自動生化分析儀檢測血清ALT、AST(ALT>1 700 IU/L、AST>1 500 IU/L)以評價肝衰竭發生情況;流式細胞術測算肝組織中細胞凋亡率;Western blotting法檢測肝組織中的TLR4、p38、p-p38、JNK及p-JNK蛋白;免疫組化SP法檢測肝組織中的TLR4、Bax、Bcl-2和active-caspase-3蛋白。結果 損傷組實驗過程中死亡5只,OMT組死亡1只,死因均為肝衰竭。對照組及實驗1、2、3組大鼠均存活。OMT組及實驗1、2、3組肝組織病理損傷較損傷組減輕。損傷組血清AST、ALT水平高于其余各組,OMT組血清AST、ALT水平低于損傷組,實驗2、3組血清AST、ALT水平低于OMT組(P均<0.05)。損傷組肝衰竭發生率100%,OMT組為66.7%,實驗1、2、3組分別為53.3%、40%、33.3%,OMT組及實驗1、2、3組肝衰竭發生率低于損傷組,且OMT組與實驗1、2、3組肝衰竭發生率依次降低(P均<0.05)。損傷組肝細胞凋亡率高于其余各組,OMT組肝細胞凋亡率低于損傷組,實驗3組肝細胞凋亡率低于OMT組(P均<0.05)。與其余各組相比,損傷組肝組織中TLR4蛋白相對表達量增高,p-p38/p38、p-JNK/JNK增高;OMT組肝組織中TLR4蛋白相對表達量和p-p38/p38、p-JNK/JNK低于損傷組;實驗2、3組肝組織中TLR4蛋白相對表達量和p-p38/p38、p-JNK/JNK低于OMT組,且實驗3組低于實驗2組(P均<0.05)。損傷組肝組織中TLR4、Bax、active-caspase-3蛋白表達積分高于其余各組,OMT組TLR4、Bax、active-caspase-3蛋白表達積分低于損傷組,實驗3組低于OMT組(P均<0.05)。損傷組肝組織中Bcl-2蛋白表達積分低于其余各組,OMT組Bcl-2蛋白表達積分高于損傷組,實驗3組高于OMT組(P均<0.05)。結論 OMT聯合FYK預處理對肝衰竭有一定防治作用,可減輕肝組織病理損傷,減少肝細胞凋亡,機制可能包括TLR4、active-caspase-3蛋白表達下調,p-p38/p38、p-JNK/JNK、Bax/Bcl-2下降,TLR4/p38/JNK信號通路功能抑制等。
肝衰竭;苦參素;復方茵陳顆粒;Toll樣受體4;p38絲裂原活化蛋白激酶;c-Jun氨基末端激酶;細胞凋亡;丙氨酸氨基轉移酶;門冬氨酸氨基轉移酶
急性肝衰竭的主要病理變化是肝細胞大量死亡,引起肝功能嚴重受損[1]。在急性肝衰竭的發病過程中,細胞凋亡起著非常重要的作用,但肝細胞凋亡的機制尚未知。TLR4主要識別革蘭陰性菌胞壁成分脂多糖(LPS)。研究[2~4]發現,在肝衰竭小鼠中TLR4表達顯著升高。Tournier等[5]研究認為,在絲裂原活化蛋白激酶(MAPK)信號轉導途徑中,p38與JNK通路參與介導細胞凋亡。對于急性肝衰竭時肝細胞凋亡過程中是否有TLR4介導的p38/JNK信號通路參與,目前尚未明確。苦參素(OMT)具有抗過敏、抗凋亡、抗炎、抗氧化、抗纖維化及抗病毒等作用。復方茵陳顆粒(FYK)由茵陳、丹參及大黃按一定比例配置而成,其中茵陳可促進內毒素從膽汁排出,丹參可改善肝臟微循環、減輕中毒性肝損傷,大黃可抗菌消炎、排毒、通里攻下,減輕急性肝衰竭時肝細胞損傷。本研究觀察了OMT聯合FYK預處理對大鼠急性肝衰竭的防治作用,并探討其機制。
1 材料與方法
1.1 實驗動物與材料 雄性SD大鼠90只,SPF級別,體質量200~250 g,由南通大學實驗動物中心提供,許可證號SYXK(蘇)2012-0031。大鼠適應性飼養1周后,隨機分為實驗1組、實驗2組、實驗3組、OMT組、損傷組、對照組,每組15只。復方茵陳顆粒劑為南通市中醫院制劑室將茵陳、丹參、大黃按2∶1∶1比例制成的顆粒劑,1劑10 g,含茵陳、丹參、大黃分別為5、2.5、2.5 g。用前以雙蒸水配制,分為小、中、大3個劑量,其劑量比例分別為1∶2∶4,濃度分別為1.5、3、6 g/mL,中劑量相當于臨床應用劑量。
1.2 用藥方法及肝衰竭情況觀察 OMT組腹腔注射OMT 120 mg/kg,1次/d,給藥容量均為2 mL/kg;實驗1組、實驗2組、實驗3組分別灌服3、6、12 g/(kg·d)的FYK,2 h后再注射OMT,劑量參照OMT組;對照組和損傷組腹腔注射等容量生理鹽水;各組用藥連續3 d。D-GalN和LPS聯合用藥是建立大鼠急性肝衰竭模型最常用的方法之一,參照文獻[6]方法,各組用藥2 d后將大鼠禁食24 h,除對照組外,其余各組大鼠腹腔注射D-GalN 700 mg/kg、同時皮內注射LPS 10 μg/kg。肝衰竭判定標準為:血ALT>1 700 IU/L、AST>1 500 IU/L,病理檢查見肝細胞大量壞死、無正常肝小葉結構、纖維網狀支架塌陷、匯管區大量炎癥細胞浸潤。
1.3 肝細胞凋亡率測算 取出大鼠肝組織,將0.2 g肝中葉組織塊剪碎成小塊,放入研磨器中并加入3 mL生理鹽水研磨至勻漿,反復用生理鹽水沖洗研磨器,收集細胞懸液,用300目尼龍網濾去細胞團塊,800 r/min離心5 min,PBS清洗3次,500 r/min離心5 min,棄上清。加入250 μL的loading buffer重懸細胞。加入2.5 μL的Annexin V-FITC輕輕混勻。室溫避光孵育10 min。500 r/min離心5 min,棄上清。加入250 μL的loading buffer輕輕重懸細胞。加入2.5 μL的PI輕輕混勻,冰浴避光放置。1 h內上流式細胞儀檢測。
1.4 Western blotting法檢測肝組織中TLR4、p38、p-p38、JNK及p-JNK蛋白 稱取100 mg肝組織,盡量剪碎成小塊置于預冷的PBS(含0.1 mmol/L PMSF)中清洗,反復3次,去除紅細胞。加入預冷的蛋白裂解液(含1 mmol/L PMSF)中冰浴勻漿至充分裂解。4 ℃、12 000 r/min離心5 min,吸取上清,BCA法測定蛋白濃度。經電泳、轉膜、封閉后,加入對應一抗孵育,放入4 ℃冰箱過夜,用1×TBST溶液洗3次,加入二抗孵育2 h,再用1×TBST溶液洗3次。將顯影液A、B液滴加到膜上,于ChemiDox XRS型凝膠電化學發光成像系統下顯影,掃描成灰度照片。Image J軟件分析各組條帶灰度值,以目的蛋白灰度值與內參蛋白灰度值的比值表示目的蛋白相對表達量。
1.5 免疫組化法檢測肝組織中TLR4、Bax、Bcl-2、active-caspase-3蛋白 取大鼠肝臟,將肝中葉組織一部分切成6 mm×5 mm×5 mm小塊浸入10%中性甲醛溶液中固定,用于HE染色及免疫組化分析。組織塊固定24 h后按脫水、透明、浸蠟、包埋、切片等步驟制成石蠟切片。采用SP法染色觀察肝組織中TLR4、Bax、Bcl-2、active-caspase-3蛋白表達情況。結果判定:TLR4陽性細胞為胞質呈棕黃色,Bax陽性細胞為胞膜、胞質有棕黃色顆粒沉著,Bcl-2陽性細胞為胞膜、胞質有棕黃色顆粒沉著,active-caspase-3陽性細胞為胞核、胞質呈棕黃色。參照Formwitz法進行評分,每張切片觀察10個高倍視野(400×),按著色深淺和陽性細胞百分比進行半定量分析:無明顯著色為0分,淺黃色為1分,棕黃色為2分,深棕色為3分;陽性細胞百分比<5%為0分,5%~<25%為1分,25%~<50%為2分,50%~<75%為3分,≥75%為4分;兩項得分相乘,記錄各目的蛋白的表達積分。
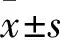
2 結果
2.1 各組肝衰竭發生情況 實驗過程中損傷組死亡5只,OMT組死亡1只,死因均為肝衰竭。對照組及實驗1、2、3組大鼠均存活且一般情況較好。損傷組可見肝臟大體腫脹明顯,表面彌漫出血,大片瘀斑,呈暗紅色;HE染色見損傷組肝細胞明顯壞死,僅少量肝細胞殘存、散在分布,無正常肝小葉結構,纖維網狀支架塌陷,匯管區大量炎癥細胞浸潤。OMT組及實驗1、2、3組肝組織病理損傷逐漸減輕。損傷組血清ALT、AST水平高于其余各組,OMT組血清AST、ALT水平低于損傷組,實驗2、3組血清AST、ALT水平低于OMT組(P均<0.05,見表1)。損傷組肝衰竭發生率100%,OMT組為66.7%,實驗1、2、3組分別為53.3%、40.0%、33.3%,OMT組及實驗1、2、3組肝衰竭發生率低于損傷組,且OMT組與實驗1、2、3組肝衰竭發生率依次降低(P均<0.05)。
2.2 各組大鼠肝細胞凋亡率比較 實驗1組、實驗2組、實驗3組、OMT組、損傷組、對照組大鼠肝細胞凋亡率分別為49.38±5.90%、42.72%±4.92%、35.42%±3.60%、52.67%±4.69%、67.82%±8.73%、18.34%±2.37%,其中損傷組肝細胞凋亡率高于其余各組(P均<0.05),OMT組肝細胞凋亡率低于損傷組,實驗3組肝細胞凋亡率低于OMT組(P均<0.05)。

表1 各組大鼠血清ALT、AST水平比較
注:與對照組比較,*P<0.05;與損傷組比較,#P<0.05;與OMT組比較,△P<0.05。
2.3 各組大鼠肝組織中TLR4、p-p38、p38、p-JNK、JNK蛋白表達比較 與其余各組相比,損傷組肝組織中TLR4蛋白相對表達量增高,p-p38/p38、p-JNK/JNK增高;OMT組肝組織中TLR4蛋白相對表達量和p-p38/p38、p-JNK/JNK低于損傷組;實驗2、3組肝組織中TLR4蛋白相對表達量和p-p38/p38、p-JNK/JNK低于OMT組,實驗3組肝組織中TLR4蛋白相對表達量和p-p38/p38、p-JNK/JNK低于實驗2組(P均<0.05)。詳見表2。
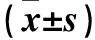
表2 各組大鼠肝組織TLR4蛋白相對表達量、p-p38/p38、p-JNK/JNK比較
注:與對照組比較,*P<0.05;與損傷組比較,#P<0.05;與OMT組比較,△P<0.05。
2.4 各組大鼠肝組織中TLR4、Bax、Bcl-2、active-caspase-3蛋白表達積分比較 損傷組肝組織中TLR4、Bax、active-caspase-3蛋白表達積分高于其余各組,OMT組TLR4、Bax、active-caspase-3蛋白表達積分低于損傷組,實驗3組低于OMT組(P均<0.05)。損傷組肝組織中Bcl-2蛋白表達積分低于其余各組,OMT組Bcl-2蛋白表達積分高于損傷組,實驗3組高于OMT組(P均<0.05)。詳見表3。
3 討論
研究[7]表明細胞凋亡是急性肝衰竭的主要病理特征。在病毒和內毒素等損傷因子引起的肝損傷相關研究中發現肝細胞凋亡現象明顯[8]。OMT具有多種藥理活性,被廣泛應用于一些炎癥性疾病、肝炎、心臟疾病的治療[9],然而,OMT聯合FYK對肝衰竭時肝細胞凋亡的抑制作用及其機制尚不清楚。
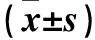
表3 各組大鼠肝組織中TLR4、Bax、Bcl-2、active-caspase-3蛋白表達積分比較
注:與對照組比較,*P<0.05;與損傷組比較,#P<0.05;與OMT組比較,△P<0.05。
文獻表明,應用D-GalN和LPS聯合誘導動物急性肝衰竭的實驗方法比較完善,出現的肝損害表現與臨床病毒性肝衰竭較相近,是一種較為理想的肝衰竭動物模型。D-GalN是特異性肝細胞轉錄抑制物,可破壞肝臟的生物合成功能,造成肝彌漫性壞死和炎癥。LPS是重要的毒性成分[10~13]。本研究先給予OMT聯合FYK預處理,并給予LPS/D-GalN,觀察各組急性肝衰竭發生情況、肝臟病理形態的改變,發現OMT組和實驗1、2、3組肝組織病理損傷不同程度改善;OMT組及實驗1、2、3組肝衰竭發生率低于損傷組,且OMT組與實驗1、2、3組肝衰竭發生率依次降低,提示OMT聯合FYK預處理有助于預防急性肝衰竭的發生,與相關研究結果一致[6]。
在肝細胞壞死、細胞膜損傷時,細胞內AST、ALT自細胞內流向血液,使血清中 AST、ALT水平增高,因此,血清AST、ALT水平可反映肝功能受損程度。本研究結果顯示,損傷組血清AST、ALT水平及肝細胞凋亡率高于其余各組,OMT組血清AST、ALT水平及肝細胞凋亡率低于損傷組,實驗2、3組血清AST、ALT水平低于OMT組,實驗3組肝細胞凋亡率低于OMT組,提示OMT聯合FYK預處理可降低大鼠血清ALT、AST水平,減少肝細胞凋亡,改善肝功能,保護肝組織。
MAPK是公認的與細胞增殖、分化及凋亡有關的細胞內信號轉導酶類。在LPS/D-GalN誘導的肝損傷中,激活的MAPKs可導致肝組織炎癥反應。p38在調節炎癥、纖維化和細胞凋亡中起著至關重要的作用[14]。蛋白激酶JNK包括JNK1、JNK2、JNK3三個基因,編碼10個不同的剪接變異體[15]。我們采用Western blotting法檢測了肝組織中的TLR4、p38、p-p38、JNK及p-JNK蛋白,發現與其余各組相比,損傷組肝組織中TLR4蛋白相對表達量增高,p-p38/p38、p-JNK/JNK增高;OMT組肝組織中TLR4蛋白相對表達量和p-p38/p38、p-JNK/JNK低于損傷組;實驗2、3組肝組織中TLR4蛋白相對表達量和p-p38/p38、p-JNK/JNK低于OMT組,且實驗3組低于實驗2組。上述結果提示,OMT聯合FYK能降低肝衰竭大鼠肝組織中TLR4表達,降低p38及JNK的磷酸化水平,OMT聯合FYK可能通過調節TLR4/p38/JNK信號通路保護肝細胞。
急性肝衰竭時,LPS、氧化應激和炎癥因子作用均可激活肝細胞內的MAPK和caspase-8,導致JNK磷酸化,在肝細胞死亡的誘導和執行中起著至關重要的作用。JNK磷酸化可影響Bax及抗凋亡蛋白Bcl-2的釋放和激活[16,17]。LPS/D-GalN刺激后,大鼠肝細胞凋亡率明顯增加,細胞色素C從線粒體釋放到細胞質,激活下游的caspase(如caspase-3),參與凋亡程序執行。LPS誘導Bax蛋白寡聚化,增強細胞通透性,通過caspase介導的細胞凋亡程序損傷線粒體結構。Bcl-2家族Bax是細胞凋亡的關鍵效應蛋白,可調控程序性細胞死亡或凋亡。面對外來刺激時,細胞存活或凋亡主要取決于Bcl-2家族中促進細胞死亡因子和促進細胞存活因子的比例。本研究結果顯示,損傷組肝組織中TLR4、Bax、active-caspase-3蛋白表達積分高于其余各組,OMT組TLR4、Bax、active-caspase-3蛋白表達積分低于損傷組,實驗3組低于OMT組;損傷組肝組織中Bcl-2蛋白表達積分低于其余各組,OMT組Bcl-2蛋白表達積分高于損傷組,實驗3組高于OMT組。上述結果提示OMT聯合FYK可使Bax、active-caspase-3表達進一步降低,Bcl-2表達進一步增加,從而減少肝細胞凋亡,發揮肝細胞保護作用。
結合上述研究結果,我們認為,OMT聯合FYK預處理對肝衰竭有一定防治作用,可減輕肝組織病理損傷,減少肝細胞凋亡,機制可能包括TLR4、active-caspase-3蛋白表達下調,p-p38/p38、p-JNK/JNK、Bax/Bcl-2下降,TLR4/p38/JNK信號通路功能抑制等。
[1] Shirozu K, Tokuda K, Marutani E, et al. Cystathionine gamma-lyase deficiency protects mice from galactosamine/lipopolysaccharide-induced acute liver failure[J]. Antioxid Redox Signal, 2014,20(2):204-216.
[2] Benias PC, Gopal K, Bodenheimer H Jr, et al. Hepatic expression of toll-like receptors 3, 4, and 9 in primary biliary cirrhosis and chronic hepatitis C[J]. Clin Res Hepatol Gastroenterol, 2012,36(5):448-454.
[3] Schwabe RF, Seki E, Brenner DA. Toll-like receptor signaling in the liver[J]. Gastroenterology, 2006,130(6):1886-1900.
[4] Kawasaki T, Kawai T. Toll-like receptor signaling pathways[J]. Front Immunol, 2014,5:461.
[5] Tournier C, Hess P, Yang DD, et al. Requirement of JNK for stress-induced activation of the cytochrome c-mediated death pathway[J]. Science, 2000,288(5467):870-874.
[6] Imai Y, Takai S, Jin D, et al. Chymase inhibition attenuates lipopolysaccharide/ d-galactosamine-induced acute liver failure in hamsters[J]. Pharmacology, 2014,93(1-2):47-56.
[7] Riordan SM, Williams R. Mechanisms of hepatocyte injury, multiorgan failure, and prognostic criteria in acute liver failure[J]. Semin Liver Dis, 2003,23(3):203-215.
[8] Wang Y, Singh R, Lefkowitch JH, et al. Tumor necrosis factor-induced toxic liver injury results from JNK2-dependent activation of caspase-8 and the mitochondrial death pathway[J]. J Biol Chem, 2006,281(22):15258-15267.
[9] Liu Y, Zhang XJ, Yang CH, et al. Oxymatrine protects rat brains against permanent focal ischemia and downregulates NF-kappaB expression[J]. Brain Res, 2009,1268:174-180.
[10] Herzum I, Renz H. Inflammatory markers in SIRS, sepsis and septic shock[J]. Curr Med Chem, 2008,15(6):581-587.
[11] Byun EB, Sung NY, Park JN, et al. Gamma-irradiated resveratrol negatively regulates LPS-induced MAPK and NF-kappaB signaling through TLR4 in macrophages[J]. Int Immunopharmacol, 2015,25(2):249-259.
[12] Akira S, Takeda K, Kaisho T. Toll-like receptors: critical proteins linking innate and acquired immunity[J]. Nat Immunol, 2001,2(8):675-680.
[13] Liu LM, Zhang JX, Luo J, et al. A role of cell apoptosis in lipopolysaccharide (LPS)-induced nonlethal liver injury in D-galactosamine (D-GalN)-sensitized rats[J]. Dig Dis Sci, 2008,53(5):1316-1324.
[14] Debacq-Chainiaux F, Boilan E, Dedessus Le Moutier J, et al. p38(MAPK) in the senescence of human and murine fibroblasts[J]. Adv Exp Med Biol, 2010,694:126-137.
[15] Davis RJ. Signal transduction by the JNK group of MAP kinases[J]. Cell, 2000,103(2):239-252.
[16] Li WW, Yu JY, Xu HL, et al. Concanavalin A: a potential anti-neoplastic agent targeting apoptosis, autophagy and anti-angiogenesis for cancer therapeutics[J]. Biochem Biophys Res Commun, 2011,414(2):282-286.
[17] Hetz C, Bernasconi P, Fisher J, et al. Proapoptotic BAX and BAK modulate the unfolded protein response by a direct interaction with IRE1alpha[J]. Science, 2006,312(5773):572-576.
江蘇省中醫藥局科技項目(YB2015177)。
蔣偉(E-mail: zhangxian8412@163.com)
10.3969/j.issn.1002-266X.2017.15.010
R575.3
A
1002-266X(2017)15-0037-04
2016-11-11)

