慢性高原病大鼠肝組織中扭轉原腸胚形成同系物1、鐵調素表達觀察
劉玉潔,耿惠
(1淄博礦業集團集團中心醫院,山東淄博255120;2青海大學附屬醫院)
·基礎研究·
慢性高原病大鼠肝組織中扭轉原腸胚形成同系物1、鐵調素表達觀察
劉玉潔1,耿惠2
(1淄博礦業集團集團中心醫院,山東淄博255120;2青海大學附屬醫院)
目的 觀察慢性高原病(CMS)大鼠肝組織中扭轉原腸胚形成同系物1(TWSG1)、鐵調素的表達變化,并探討其意義。方法 50只雄性健康大鼠由西安運至西寧,隨機分成6組,即低氧1組、低氧2組、CMS組、常氧1組、常氧2組、常氧3組。常氧1、2、3組分別在西寧(海拔2 260 m)常規飼養7、15、30 d。低氧1、2組和CMS組放入低壓氧倉模擬海拔5 000 m環境,分別飼養7、15、30 d。CMS組成功制作CMS模型。采用qRT-PCR法檢測肝組織中的鐵調素、TWSG1 mRNA;采用免疫組化法檢測肝組織中的TWSG1蛋白。結果 低氧2組、CMS組肝組織中鐵調素mRNA相對表達量分別低于常氧2、3組,CMS組低于低氧1組(P均<0.05)。低氧1組、低氧2組、CMS組肝組織中TWSG1 mRNA相對表達量分別高于常氧1、2、3組,低氧1組、低氧2組、CMS組TWSG1 mRNA相對表達量依次增高(P均<0.05)。低氧1組、低氧2組、CMS組TWSG1蛋白表達陽性分別為8、9、9例,常氧1、2、3組分別為8、8、8例。低氧2組、CMS組肝組織中TWSG1蛋白相對表達量分別高于常氧2、3組,低氧1組、低氧2組、CMS組TWSG1蛋白相對表達量依次增高(P均<0.05)。結論 CMS大鼠肝組織中鐵調素表達下調,TWSG1表達上調;隨低氧暴露時間延長,機體鐵調素和TWSG1表達變化越明顯,預示CMS狀態下鐵代謝逐漸發生改變。
慢性高原病;扭轉原腸胚形成同系物1;鐵調素
慢性高原病(CMS)是長時間居住于海拔2 500 m以上地區的人群逐漸對低氧低壓環境不適應而發生的臨床綜合征。CMS以紅細胞過度增生、低氧血癥為特征。鐵調素是一種由HAMP基因編碼的含有25個氨基酸的肝臟抗菌肽,是由8個半胱氨酸殘基組成的單一發夾結構。鐵調素通過與膜鐵轉運蛋白(FPN)結合并引起FPN內化降解從而調節機體鐵穩態。鐵調素受炎癥因素和機體鐵含量增加的正性調節,受紅系增殖活性增加和缺氧的負性調節,上述過程主要有BMP-SMAD、JAK-STAT3和HFE-TfR2三條信號通路參與。扭轉原腸胚形成同系物1(TWSG1)是近年來發現的鐵調控蛋白。TWSG1是一個高度保守的分泌性糖蛋白,含有24個半胱氨酸殘基和一個疏水的信號序列。有學者發現TWSG1能通過抑制BMP-SMAD信號轉導間接抑制鐵調素合成。經查閱國內外文獻,有關CMS患者鐵代謝基因表達的研究尚不多見。為此,我們制備了慢性高原病大鼠模型,觀察大鼠肝組織中TWSG1、鐵調素的表達變化,現報告如下。
1 材料與方法
1.1 實驗動物及分組 雄性SPF級SD健康大鼠50只,鼠齡為42 d左右,體質量200~300 g,由西安交通大學第一附屬醫院提供。50只大鼠由西安運至西寧,適應性喂養1周后進行實驗。將大鼠隨機分為6組,低氧1組8只、低氧2組9只、CMS組9只、常氧1組8只、常氧2組8只、常氧3組8只。
1.2 CMS模型建立及判定標準 常氧1、2、3組分別在西寧(海拔2 260 m)常規飼養7、15、30 d。低氧1、2組和CMS組放入低壓氧倉模擬海拔5 000 m環境,分別飼養7、15、30 d。CMS模型制作成功標準[1]:血紅蛋白>210 g/L,紅細胞比容>65%,有口唇、耳廓發紺等缺氧表現。根據判定標準,CMS組模型均制作成功。造模結束后麻醉大鼠,取腹主動脈血1 mL送檢血常規;取出遠離肝血管部位50 mg肝臟組織若干塊,RNA later固定,用于鐵調素、TWSG1 mRNA檢測;取出一塊遠離肝血管部位的肝臟組織,4%多聚甲醛液固定,用于TWSG1蛋白檢測。
1.3 大鼠肝組織中鐵調素、TWSG1 mRNA檢測 根據TRIzol使用說明書提取大鼠肝臟總RNA,選取OD260/OD280為1.8~2.0的RNA樣本,依照試劑盒說明書進行逆轉錄。用Primer Premier5.0引物設計軟件設計目的基因、內參基因actin引物序列,均由Invitrogen公司純化合成。TWSG1基因上游引物序列為5′-ATGAGTGTTGCGATTGTGT-3′,下游引物序列為5′-TGAAGTGGGAGGTGTGTC-3′;鐵調素基因上游引物序列為5′-CAACAGACGAGACAGACTACGG-3′,下游引物序列為5′-ACAAGGCTCTTGGCTCTCTATG-3′;內參β-actin基因上游引物序列為5′-CCTAGACTTCGAGCAAGAGA-3′,下游引物序列為5′-GGAAGGAAGGCTGGAAGA-3′。qRT-PCR反應在ABI7500 PCR儀上進行,每組設陰性對照,每個樣品設3個重復孔。PCR反應條件:94 ℃ 3 min,1個循環;94 ℃ 30 s、58 ℃ 30 s、72 ℃ 45 s,35個循環。采用ABI7500軟件進行數據分析,以2-ΔΔCt表示目的基因相對表達量。
1.4 大鼠肝組織中TWSG1蛋白檢測 采用免疫組化法。肝組織標本經固定、脫鈣、石蠟包埋、切片后,進行免疫組化染色。TWSG1陽性細胞為細胞核和細胞質呈棕黃色至棕褐色。根據著色程度、著色顆粒大小與陽性細胞百分比判定結果:無色計0分、淡黃色計1分、棕黃色計2分、棕褐色計3分,無顆粒計0分、細顆粒計1分、中顆粒計2分、粗顆粒計3分,無陽性細胞計0分、陽性細胞百分比≤25%計1分、>25%~50%計2分、>50%~75%計3分、>75%計4分;將三項得分相加,0~2分為-,3~5分為+,6~7分為++,8~9分為+++,10分為++++。
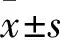
2 結果
2.1 各組大鼠肝組織中鐵調素、TWSG1 mRNA表達比較 低氧2組、CMS組肝組織中鐵調素mRNA相對表達量分別低于常氧2、3組,CMS組低于低氧1組(P均<0.05)。低氧1組、低氧2組、CMS組肝組織中TWSG1 mRNA相對表達量分別高于常氧1、2、3組,低氧1組、低氧2組、CMS組TWSG1 mRNA相對表達量依次增高(P均<0.05)。見表1。
2.2 各組大鼠肝組織中TWSG1蛋白表達比較 免疫組化染色結果見圖1。低氧1組、低氧2組、CMS組TWSG1蛋白陽性分別為8、9、9例,常氧1、2、3組分別為8、8、8例。低氧2組、CMS組肝組織中TWSG1蛋白相對表達量分別高于常氧2、3組,低氧1組、低氧2組、CMS組TWSG1蛋白相對表達量依次增高(P均<0.05)。見表1。
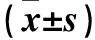
表1 各組大鼠肝組織中鐵調素、TWSG1 mRNA及TWSG1蛋白表達比較
注:與低氧1組比較,▲P<0.05;與低氧2組比較,■P<0.05;與CMS組比較,★P<0.01。
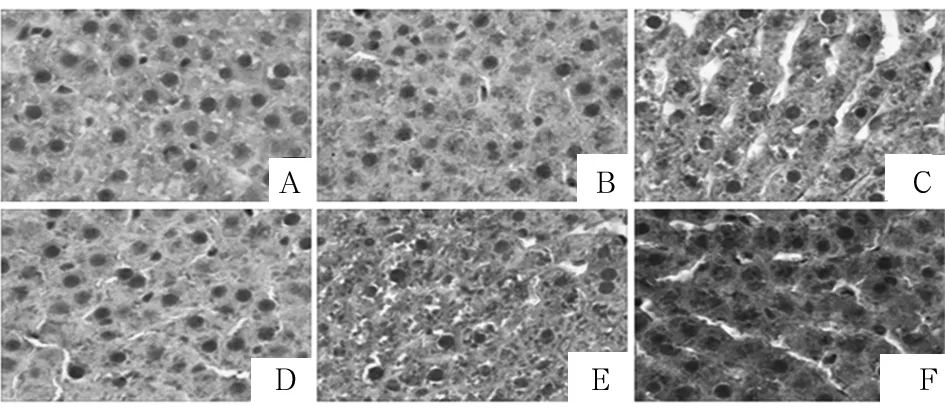
注:A為常氧1組;B為常氧2組;C為常氧3組;D為低氧1組;E為低氧2組;F為CMS組。
3 討論
CMS主要由機體缺氧造成的,慢性缺氧條件下(如慢性阻塞性肺疾病、右到左心臟分流術和高海拔環境),低氧誘導因子(HIF)能通過協調細胞特定類型缺氧反應,包括增加腎臟和肝臟中促紅細胞生成素(EPO)的生成、促進紅系祖細胞成熟和增殖的骨髓微環境改變、提高鐵攝取和利用等,從而促進紅細胞生成[2]。紅細胞生成增加源于骨髓來源的系統信號,這種系統信號抑制了鐵調素的表達,研究[3]發現參與這種信號通路的因子可能包括骨髓中紅系前體細胞產生的循環分子,如生長分化因子15(GDF15)及TWSG1。鐵調素受抑制后FPN水平增高,進而增加用于紅細胞生成的鐵的可用性[2]。本課題分別設計了常氧組和低氧組,并模擬海拔5 000 m制備CMS大鼠模型,觀察低氧狀態及不同低氧暴露時間條件下大鼠肝組織中鐵調素、TWSG1的表達變化,進而分析CMS對鐵代謝的影響及其機制。
Nicolas等[4]在氧濃度為0.1%~2%的條件下培養HepG2細胞,發現與氧濃度為20%的常氧條件下相比,細胞中鐵調素mRNA表達明顯下降。研究[5]證明高海拔急性缺氧條件下,紅細胞生成和血紅蛋白合成所需的鐵急劇增加,血漿鐵調素濃度下降。有學者[6,7]發現CMS大鼠鐵調素水平明顯降低。本研究結果顯示,低氧2組、CMS組肝組織中鐵調素 mRNA相對表達量分別低于常氧2、3組,CMS組低于低氧1組,表明低氧環境下鐵調素表達下調,在CMS狀態下更加明顯,其原因可能與低氧抑制鐵調素表達有關。低氧抑制鐵調素表達的途徑可能包括:①低氧下啟動HIF-1α直接與鐵調素基因啟動子上氧反應原件(HREs)作用,降低鐵調素表達;②低氧能夠通過HIF-1α使弗林蛋白酶(Furin)分泌增多,Furin是一種內質網中能分解鐵調素調節蛋白(HJV)的蛋白酶,從而釋放可溶性鐵調素調節蛋白(sHJV),而sHJV通過與BMPs結合、減少受體-配體相互作用,拮抗鐵調素的作用;③低氧狀態下HIF-1α可調節跨膜絲氨酸蛋白酶6(TMPRSS6)水平,并通過BMP-SMAD信號轉導通路負性調節鐵調素表達[8];④通過血小板源性生長因子(PDGF)通路抑制鐵調素合成[9];⑤低氧使無調性同系物8(ATOH8)水平下降而發揮抑制鐵調素的作用[10];⑥低氧下HIF-2促使腎臟EPO生成和紅細胞生成,骨髓來源的系統信號因子可能包括GDF-15和TWSG1抑制鐵調素表達[3]。
Mirciov等[11]在β-地中海貧血、缺鐵性貧血大鼠的骨髓和脾臟中檢測到TWSG1和GDF15。TWSG1是細胞外基質中BMP信號調節器之一,它能根據環境正性或負性地調節BMP的活性[12~19]。有學者[20]研究發現TWSG1在惡性肝臟上皮細胞癌中表達增加,且與BMP4表達有關。Tanno等[13]在人肝癌細胞株HuH-7和初級人類肝臟細胞的研究中發現,TWSG1在紅細胞生成的早期階段(相對成熟階段)表達增加,能通過抑制BMP2/BMP4與BMP受體結合,抑制Smad1/5/8的磷酸化,達到間接抑制鐵調素合成的作用。Kroot等[14]進一步發現大鼠體內腎臟產物EPO促進紅細胞生成,然后通過GDF15、TWSG1與肝臟細胞相關聯,從而影響鐵調素的表達,這可能是通過抑制BMP/SMAD信號轉導完成的。
本研究結果顯示,低氧1組、低氧2組、CMS組肝組織中TWSG1 mRNA相對表達量分別高于常氧1、2、3組,低氧1組、低氧2組、CMS組TWSG1 mRNA相對表達量依次增高;低氧2組、CMS組肝組織中TWSG1蛋白相對表達量分別高于常氧2、3組,低氧1組、低氧2組、CMS組TWSG1蛋白相對表達量依次增高。上述結果表明,隨缺氧時間和缺氧程度的增加,TWSG1表達逐漸增加,且在CMS中維持高表達。分析其原因,CMS狀態下,隨缺氧時間和程度增加,紅細胞生成對鐵的需求增加,進一步通過GDF15/TWSG1介導HIF-2對鐵調素表達的抑制作用,調節鐵代謝,從而為紅細胞生成提供充足的原料。但對于CMS狀態下TWSG1與紅系增殖之間的關系仍不明確。
總之,CMS大鼠肝組織中鐵調素表達下調,TWSG1表達上調;隨低氧暴露時間延長,機體鐵調素和TWSG1表達變化越明顯,預示鐵代謝狀態逐漸發生改變。
[1] 靳國恩,韻海霞,馬蘭,等.高原紅細胞增多癥動物模型的建立及其生理功能反應[J].中國組織工程研究與臨床康復,2009,13(24):4713-4716.
[2] Volker H. Hypoxic regulation of erythropoiesis and iron metabolism[J]. Am J Physiol Renal Physiol, 2010, 299(1):1-13.
[3] Fleming RE, Ponka P. Iron overload in human disease[J]. N Engl J Med, 2012, 366:348-359.
[4] Nicolas G, Chauvet C, Viatte L, et al. The gene encoding the iron regulatory peptide hepcidin is regulated by anemia, hypoxia, and inflammation [J]. J Clin Invest, 2002,110(7):1037-1044.
[5] Talbot N, Lakhal S, Smith T, et al. Regulation of hepcidin expression at high altitude[J]. Blood, 2012,119(3):857-860.
[6] 耿惠.高原紅細胞增多癥大鼠模型的sTfR和hepcidin表達[J].青海醫學院學報,2015,36(1):6-10.
[7] 耿惠,陳碧琴.GDF-15在慢性高原病大鼠模型中的表達及其與hepcidind的關系[J].實用醫學雜志,2015,31(4):2255-2257.
[8] Mastrogiannaki M, Matak P, Mathieu JR, et al. Hepatic hypoxia-inducible factor-2 down-regulates hepcidin expression in mice through an erythropoietin-mediated increase in erythropoiesis[J]. Haematologica, 2012,97(6):827-834.
[9] Sonnweber T, Nachbaur D, Schroll A, et al. Hypoxia induced downregulation of hepcidin is mediated by platelet derived growth factor BB[J]. Gut, 2014,63(12):1951-1959.
[10] Patel N, Varghese J, Masaratana P, et al. The transcription factor ATOH8 is regulated by erythropoietic activity and regulates HAMP transcription and cellular pSMAD1,5,8 levels[J]. Br J Haematol, 2014,164(4):586-596.
[11] Mirciov CS, Wilkins SJ, Dunn LA, et al. Characterization of putative erythroid regulators of hepcidin in mouse models of anemia[J]. PLoS One, 2017,12(1):e0171054.
[12] Troilo H, Barrett A, Zuk A, et al. Structural characterization of twisted gastrulation provides insights into opposing functions on the BMP signalling pathway[J]. Matrix Biol, 2016,55(1):49-62.
[13] Tanno T, Porayette P, Sripichai O, et al. Identification of TWSG1 as a second novel erythroid regulator of hepcidin expression in murine and human cells[J]. Blood, 2009,114(1):181-186.
[14] Kroot J, Tjalsma H, Fleming R, et al. Hepcidin in human iron disorders: diagnostic implications[J]. Clin Chem, 2011,57(12):1650-1669.
[15] Pham L, Beyer K, Jensen E, et al. Bone morphogenetic protein 2 signaling in osteoclasts is negatively regulated by the BMP antagonist, twisted gastrulation[J]. J Cell Biochem, 2011,112(3):793-803.
[16] Huntley R, Davydova J, Petryk A, et al. The Function of Twisted Gastrulation in Regulating Osteoclast Differentiation is Dependent on BMP Binding[J]. J Cell Biochem, 2015,116(10):2239-2246.
[17] Forsman C, Ng B, Heinze R, et al. BMP-binding protein Twisted gastrulation is required in mammary gland epithelium for normal ductal elongation and myoepithelial compartmentalization[J]. Dev Biol, 2013,373(1):95-106.
[18] Heinke J, Juschkat M, Charlet A, et al. Antagonism and synergy between extracellular BMP modulators Tsg and BMPER balance blood vessel formation[J]. J Cell Sci, 2013,126(14):3082-3094.
[19] Yamada S, Nakamura J, Asada M, et al. Twisted Gastrulation, a BMP Antagonist, Exacerbates Podocyte Injury[J]. PLoS One, 2014,9(2):e89135.
[20] Johnston J, Al-Bahrani R, Abuetabh Y, et al. Twisted gastrulation expression in cholangiocellular and hepatocellular carcinoma[J]. J Clin Pathol, 2012,65(10):945-948.
青海省科技計劃資助項目(2014-ZJ-720)。
耿惠(E-mail: gh0227@sina.com)
10.3969/j.issn.1002-266X.2017.15.008
R594.3
A
1002-266X(2017)15-0031-04
2016-05-19)

