DAPT對結腸癌細胞株HT-29增殖及乙醛脫氫酶1、Notch信號通路受體和配體表達的影響
趙小芳,王紅
(1遵義醫學院附屬醫院,貴州遵義563000;2遵義市第一人民醫院)
DAPT對結腸癌細胞株HT-29增殖及乙醛脫氫酶1、Notch信號通路受體和配體表達的影響
趙小芳1,2,王紅1
(1遵義醫學院附屬醫院,貴州遵義563000;2遵義市第一人民醫院)
目的 觀察γ-分泌酶抑制劑(GSIs)DAPT對結腸癌細胞株HT-29增殖及結直腸癌腫瘤干細胞標志物乙醛脫氫酶1(ALDH1)、Notch信號通路受體Notch4、Notch信號通路配體DLL1表達的影響。方法 體外培養HT-29細胞,取對數生長期細胞用于實驗。分別以0、5、10、20、40、80 μmol/L的DAPT作用于HT-29細胞24、48、72 h后,倒置顯微鏡下觀察細胞形態,用MTT比色法檢測細胞增殖能力(以OD值表示)。分別以0、20、40 μmol/L的DAPT作用于HT-29細胞24 h后,采用RT-PCR法檢測細胞中的ALDH1、Notch4、DLL1 mRNA,分別采用Western blotting法和免疫組化法檢測ALDH1、Notch4、DLL1蛋白。分析HT-29細胞中ALDH1、Notch4、DLL1 mRNA及蛋白表達的相關性。結果 DAPT對HT-29細胞的增殖抑制作用呈一定劑量、時間依賴性,40、80 μmol/L濃度組培養48、72 h時細胞增殖能力低于培養24 h時(P均<0.05)。DAPT處理后的細胞形態出現典型凋亡狀態改變。20、40 μmol/L的DAPT作用后HT-29細胞中ALDH1、Notch4、DLL1 mRNA相對表達量低于0 μmol/L組(P均<0.05)。0、20、40 μmol/L的DAPT作用后HT-29細胞中ALDH1、Notch4、DLL1蛋白相對表達量依次降低(P均<0.05)。免疫組化染色圖像分析結果示,0、20、40 μmol/L的DAPT作用后HT-29細胞中ALDH1、Notch4、DLL1蛋白表達OD值依次降低(P均<0.05)。HT-29細胞中ALDH1、DLL1 mRNA表達與Notch4 mRNA表達均呈正相關關系(r分別為0.997、0.998,P均<0.05)。HT-29細胞中ALDH1、DLL1蛋白表達與Notch4蛋白表達均呈正相關關系(r分別為0.998、0.999,P均<0.05)。結論 DAPT作用后,細胞增殖受到抑制,細胞中ALDH1、Notch4、DLL1 mRNA和蛋白表達下調;DAPT對HT-29細胞的增殖抑制作用可能與降低腫瘤干細胞特性、下調Notch信號通路受體與配體表達實現的。
結腸癌;HT-29細胞;γ-分泌酶抑制劑;(2S)-N-N-(3,5-氟苯乙酰基)-L-丙氨酰-2-苯基甘氨酸叔丁酯;腫瘤干細胞;乙醛脫氫酶1;Notch信號通路;Notch4;DLL1
近年來結直腸癌在我國的發病率、病死率呈逐年保持上升趨勢,且發病年齡提前[1],嚴重威脅人們健康。Notch信號通路參與腫瘤的發生發展。Notch受體和配體分子表達失調及Notch信號異常激活現象存在于多種惡性腫瘤中。研究[2,3]還發現,Notch信號通路是維持腫瘤干細胞特性的關鍵,腫瘤干細胞自我更新也需要Notch信號的調節。部分大腸癌的形成可能與Notch信號通路對結直腸腫瘤干細胞調控異常有關。本實驗將Notch信號通路阻斷劑γ-分泌酶抑制劑(GSIs)DAPT作用于結腸癌細胞HT-29,觀察DAPT對HT-29增殖及結直腸癌腫瘤干細胞標志物ALDH1、Notch信號通路受體Notch4、Notch信號通路配體DLL1表達的影響,現報告如下。
1 材料與方法
1.1 主要實驗材料 結腸癌細胞株HT-29由遵義醫學院消化內科研究所實驗室常規傳代保種,培養于含10%胎牛血清(FBS)的改良型1640培養基(美國Hyclone公司)中,靜置于37 ℃、5% CO2恒溫培養箱中。每48 h換液、傳代1次,觀察細胞生長情況,處于對數生長期細胞用于實驗。MTT試劑購自中國凱基生物公司;二甲基亞砜(DMSO)及DAPT購于美國Sigma公司;RT-PCR逆轉錄試劑盒及擴增試劑盒均購自中國北京索萊寶科技有限公司;ALDH1單克隆抗體、Notch4單克隆抗體及DLL1多克隆抗體購于美國Abcam公司;倒置顯微鏡為日本Olympus公司產品。
1.2 DAPT對HT-29細胞增殖的影響觀察 調整DAPT濃度為0、5、10、20、40、80 μmol/L,分別加入含有相同數目的HT-29細胞培養瓶中,分別培養24、48、72 h后PBS漂洗,將培養瓶置于Olympus倒置顯微鏡下觀察細胞形態并拍攝照片。采用MTT法觀察細胞增殖情況。取對數生長期的細胞消化制成單細胞懸液,接種于96孔板內,每孔100 μL細胞懸液,接種密度為1×104/mL,貼壁后血清培養細胞。將細胞分組,每組設置5個復孔,分別加入0、5、10、20、40、80 μmol/L的DAPT和10%FBS-1640培養基100 μL,并以0.2%體積分數的DMSO替代DAPT作為溶酶對照組。使用MTT比色法觀察培養24、48、72 h后細胞增殖情況,實驗重復3次。以OD值代表細胞增殖能力。
1.3 DAPT對HT-29細胞中ALDH1、Notch4、DLL1表達的影響觀察 取對數生長期的HT-29細胞,以5×104/孔接種于12孔板,置于恒溫培養箱中培養,培養24 h后分別加入含0、20、40 μmol/L DAPT的10%FBS-1640培養基2 mL,用于Notch4、DLL1、ALDH1 mRNA和蛋白檢測。
1.3.1 ALDH1、Notch4、DLL1 mRNA檢測 按照RT-PCR試劑盒說明書提取細胞總RNA,總RNA定量為0.2 μg/μL。將mRNA逆轉錄為cDNA,反應條件為37 ℃×15 min,85 ℃×5 s,4 ℃保持。cDNA產物放-20 ℃冰箱保存備用。ALDH1基因上游引物序列為5′-TTGTCCAGCCCACAGTGTTCTC-3′,下游引物序列為5′-TGTCTTTGGTAAACACTCCTGCTGA-3′;Notch4基因上游引物序列為5′-CTTCGGGACTTCTGTTCAGC-3′,下游引物序列為5′-TCGTTGACATCACGTTCACA-3′;DLL1基因上游引物序列為5′-GATGTGATGAGCAGCATGGA-3′,下游引物序列為5′-CCATGGAGACAGCCTGGATA-3′;內參基因β-actin上游引物序列為5′-TGGCACCCAGCACAATGA-3′,下游引物序列為5′-CTAAGTCATAGTCCGCCTAGAAG-3′。按擴增體系進行擴增,擴增反應條件:95 ℃×5 min、95 ℃×30 s、56.9 ℃退火×30 s、72 ℃×1 min 30 s、72 ℃×10 min;擴增產物-20 ℃冰箱保存。以2-ΔΔCt表示目的基因相對表達量。
1.3.2 ALDH1、Notch4、DLL1蛋白檢測 ①Western boltting法:按照試劑盒說明提取細胞總蛋白,于酶標儀上做蛋白定量測量;按Western boltting實驗步驟進行凝膠電泳,用脫脂奶粉封閉1 h,分別加入最適比例的相應一抗和β-actin,4 ℃冰箱搖床上封閉過夜,洗膜后加入與一抗來源相同的二抗(1∶5 000);顯色曝光,掃描儀掃描膠片,用Image-plus軟件測量灰度值,結果用Image Pro Plus圖像處理軟件統計灰度值,以目的蛋白IOD值/內參β-actin IOD值表示蛋白相對表達量。②免疫組化法:按照免疫組化染色步驟進行,一抗4 ℃孵育過夜,加二抗生物素標記的山羊抗大鼠IgG工作液50 μL,培養30 min,DAB顯色劑顯色,顯微鏡下觀察,ALDH1、Notch4、DLL1陽性細胞為細胞膜和(或)細胞質中出現黃色至棕色顆粒,采集圖像后用Image Pro Plus6.0圖像分析軟件進行分析,得出OD值,計算視野內平均OD值。
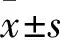
2 結果
2.1 DAPT對HT-29細胞增殖的影響 與未用DAPT處理細胞對比,DAPT處理后的細胞形態出現典型凋亡狀態改變:細胞呈近似圓形或橢圓形,細胞間隙增大,數量逐漸減少,細胞分散,細胞輪廓欠清晰,部分胞體變圓。相同時間下,DAPT作用濃度增高,細胞增殖能力下降;相同DAPT作用濃度下,隨作用時間延長,細胞增殖能力也下降;DAPT對HT-29細胞的增殖抑制作用呈一定劑量、時間依賴性,其中40、80 μmol/L濃度組培養48、72 h時細胞增殖能力低于培養24 h時(P均<0.05)。詳見表1。
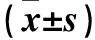
表1 不同濃度DAPT作用不同時間后各組細胞增殖能力比較
注:與相同培養時間對照組比較,*P<0.05,**P<0.01;與相同濃度培養24 h時比較,#P<0.05。
2.2 DAPT對HT-29細胞中ALDH1、Notch4、DLL1 mRNA表達的影響 20、40 μmol/L的DAPT作用后HT-29細胞中ALDH1、Notch4、DLL1 mRNA相對表達量低于0 μmol/L組(P均<0.05,見表2)。
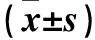
表2 不同濃度DAPT作用后HT-29細胞中ALDH1、Notch4、DLL1 mRNA及蛋白表達比較
注:與對照組相比,*P<0.05,**P<0.01;與20 μmol/L組比較,#P<0.05。
2.3 DAPT對HT-29細胞中ALDH1、Notch4、DLL1蛋白表達的影響 0、20、40 μmol/L的DAPT作用后HT-29細胞中ALDH1、Notch4、DLL1蛋白相對表達量依次降低(P均<0.05),見表2。免疫組化染色顯示,0 μmol/L組細胞胞膜、胞質呈棕黃色染色,細胞形態正常;20、40 μmol/L組ALDH1、Notch4、DLL1陽性細胞數量較0 μmol/L組減少,且著色程度減弱。0、20、40 μmol/L的DAPT作用后HT-29細胞中ALDH1蛋白OD值分別為2.00±0.24、1.03±0.09、0.54±0.10,Notch4蛋白表達OD值分別為1.33±0.19、0.86±0.11、0.27±0.05,DLL1蛋白表達OD值分別為1.08±0.10、0.72±0.12、0.33±0.05,0、20、40 μmol/L的DAPT作用后HT-29細胞中ALDH1、Notch4、DLL1蛋白OD值依次降低(P均<0.05)。
2.4 HT-29細胞中ALDH1、DLL1、Notch4 mRNA及蛋白表達的相關性 HT-29細胞中ALDH1、DLL1 mRNA表達與Notch4 mRNA表達均呈正相關關系(r分別為0.997、0.998,P均<0.05)。HT-29細胞中ALDH1、DLL1蛋白表達與Notch4蛋白表達均呈正相關關系(r分別為0.998、0.999,P均<0.05)。
3 討論
Notch信號通路幾乎存在于所有的細胞、生物中,是一個高度保守的系統,介導細胞增殖、分化、遷移、凋亡,參與造血、胚胎發育、結直腸上皮細胞成熟、免疫細胞成熟等過程,且在相鄰細胞細胞間的互相聯系中也發揮重要作用[4]。已有研究[5]發現Notch信號通路分子在許多惡性腫瘤中呈異常表達,如胰腺癌、前列腺癌、尤因肉瘤、宮頸癌和結腸癌等。Notch1和Hes-1高表達與結直腸癌分期、耐藥有關[6],Notch3表達與Ⅱ、Ⅲ期結直腸癌的復發密切相關[7],但Notch2表達與結直腸癌進展呈負相關[8]。有學者[9]發現DLLl基因表達異常可能與結直腸癌早期發病有關,由此推測Notch信號通路分子可能成為腫瘤早期診斷和預防的重要靶點。
Notch信號通路中有三個腫瘤治療靶點[10]:①抑制NICD釋放,如使用GSIs DAPT[11,12];②阻斷受體與配體的結合,如shRNA沉默大腸癌細胞中Jagged1表達;③作用于共激活復合物,如使用CLS的小分子抑制性肽以減少靶基因的轉錄活化[13]。本實驗選擇的Notch信號通路抑制劑為DAPT,一種人工合成的非選擇性GSIs,可阻斷Notch受體第三步酶切過程,使Notch受體分子無法轉變成有效的活性片段,從而抑制Notch信號通路激活,阻止Notch活化[14]。且DAPT細胞毒性小,即使阻斷γ-分泌酶而引起底物堆積也不會產生毒性作用。本研究分別將不同濃度的DAPT作用于HT-29細胞,結果顯示,相同時間下,隨著DAPT作用濃度增高,細胞增殖能力逐漸下降;而在相同DAPT作用濃度下,隨作用時間延長,細胞增殖能力也逐漸下降;DAPT對HT-29細胞的增殖抑制作用呈一定劑量、時間依賴性;DAPT處理后的細胞出現典型凋亡狀態改變。這說明DAPT可抑制HT-29細胞增殖,誘導其發生凋亡,具有一定的抗腫瘤作用。
研究[15]證實,人結直腸癌組織中腸道干細胞表面標志物高表達,后者可通過作用于Notch、Wnt等通路導致腫瘤形成。干細胞表面標志物檢測有助于對正常干細胞和腫瘤干細胞進行鑒別[16]。ALDH1是乙醛脫氫酶家族之一,參與多種組織的分化與基因表達,也是正常干細胞與腫瘤干細胞生長、分化的必需物質,在腫瘤發展過程中也發揮重要作用。已有研究[17]顯示,Notch誘導ALDH1A1去乙酰化可能與腫瘤高侵襲性有關。本研究結果顯示,20、40 μmol/L的DAPT作用后HT-29細胞中ALDH1、Notch4、DLL1 mRNA相對表達量低于0 μmol/L組;0、20、40 μmol/L的DAPT作用后HT-29細胞中ALDH1、Notch4、DLL1蛋白相對表達量依次降低。由上可見結腸癌細胞中高表達的ALDH1經Notch信號通路抑制劑DAPT作用后表達下調,且細胞中Notch信號通路分子Notch4和DLL1表達也發生下調,推測DAPT對結腸癌細胞的增殖抑制、促凋亡作用與降低腫瘤干細胞特性、下調Notch信號通路受體與配體表達有關。另外,本研究還發現HT-29細胞中ALDH1、DLL1 mRNA表達與Notch4 mRNA表達呈正相關關系,ALDH1、DLL1蛋白表達與Notch4蛋白表達也呈正相關關系,提示ALDH1、DLL1、Notch4在結腸癌細胞增殖中存在協同作用,詳細機制有待進一步研究。
[1] Grizzi F, Celesti G, Basso G, et al. Tumor budding as a potential histopathological biomarker in colorectal cancer:hype or hope?[J]. World J Gastroenterol, 2012,18(45):6532-6536.
[2] MiyamotoS, Rosenberg DW. Role of Notch signaling in colon homeostasis and carcinogenesis[J]. Cancer Sci, 2011,102(11):1938-1942.
[3] Sikandar S, Dizon D, Shen X, et al. The class I HDAC inhibitor MGCD0103 induces cell cycle arrest and apoptosis in colon cancer initiating cells by upregulating Dickkopf-1 and non-canonical Wnt signalin[J]. Oncotarget, 2010,1(7):596-605.
[4] Andersson ER, Sandberg R, Lendahl U. Notch signaling: simplicity in design, versatility in function[J]. Development, 2011,138(17):3593-3612.
[5] Abetov D, Mustapova Z, Saliev T, et al. Biomarkers and signaling pathways of colorectal cancer stem cells[J]. Tumour Biol, 2015,36(3):1339-1353.
[6] Yuan R, Ke J, Sun L, et al. HES1 promotes metastasis and predicts poor survival in patients with colorectal cancer[J]. Clin Exp Metastasis, 2015,32(2):169-179.
[7] Ozawa T, Kazama S, Akiyoshi T, et al. Nuclear Notch3 expression is associated with tumor recurrence in patients with stage Ⅱ and Ⅲ colorectal cancer[J]. Ann Surg Oncol, 2014,21(8):2650-2658.
[8] Masuda S. Notch1 and Notch2 have opposite prognostic effects on patients with colorectal cancer[J]. Ann Oncol, 2011,22(11): 2533-2534.
[9] 金黑鷹,徐俊華,王小峰,等.Notch信號轉導途徑配體基因JAGl和DLLl在結直腸癌中的表達及臨床意義[J].中華胃腸外科雜志,2012,15(4):396-399.
[10] Sriuranpong V, Borges MW, Ravi RK, et al. Notch signaling induces cell cycle arrest in small cell lung cancer cells[J]. Cancer Res, 2001,61(7):3200-3205.
[11] Aleksic T, Feller SM.Gamma-secretase inhibition combined with platinum compounds enhances cell death in a large subset of colorectal cancer cells[J]. Cell Commun Signal, 2008,6:8.
[12] Meng RD, Shelton CC, Li YM, et al. γ-secretase inhibitors abrogate oxaliplatin-induced activation of the notch-1 signaling pathway in colon cancer cells resulting in enhanced chemosensitivity[J]. Cancer Res, 2009,69(2):573-582.
[13] Ridgway J, Zhang G, Wu Y, et al. Inhibition of Dll4 signalling inhibits tumour growth by deregulating angiogenesis[J]. Nature, 2006,444(7122):1083-1087.
[14] Daudet N, Ariza-McNaughton L, Lewis J. Notch signalling is needed to maintain, but not to initiate, the formation of prosensory patches in the chick inner ear[J]. Development, 2007,134(12):2369-2378.
[15] 丁博月,韓春.結直腸癌干細胞表面標志物和信號通路研究進展[J].基礎醫學與臨床,2017,37(1):133-137.
[16] Vaiopoulos AG, Kostakis ID, Koutsilieris M, et al. Colorectal cancer stem cells[J]. Stem Cells, 2012,30(3):363-371.
[17] Zhao D, Mo Y, Li MT, et al. NOTCH-induced aldehyde dehydrogenase 1A1 deacetylation promotes breast cancer stem cells[J]. J Clin Invest, 2014,124(12):5453-5465.
Effects of DAPT on proliferation of colon cancer cell line HT-29, expression of ALDH1, Notch signaling pathway receptor and ligand
ZHAOXiaofang1,WANGHong
(1AffiliatedHospitalofZunyiMedicalCollege,Zunyi563000,China)
Objective To observed the effects of γ-secretase inhibitors (GSIs) DAPT on proliferation of colon cancer cell line HT29, colorectal tumor stem cell marker aldehyde dehydrogenase 1 (ALDH1), Notch signaling pathway receptor Notch4 and Notch signal pathway ligand DLL1 expression. Methods HT-29 cells were cultured in vitro, and the cells in the logarithmic phase were used in the experiment. DAPT (0, 5, 10, 20, 40, 80 umol/L) was used to treat HT-29 cells for 24, 48 and 72 h, we observed the cell morphology under inverted microscope, detected the cell proliferation ability by MTT colorimetry (OD value). DAPT (0, 20, 40 μmol/L) was used to treat HT-29 cells for 24 h, the ALDH1, Notch4, DLL1 mRNA was detected by RT-PCR, the ALDH1, Notch4, DLL1 protein was detected using Western blotting and immunohistochemistry. The correlation of ALDH1, Notch4, DLL1 mRNA and protein expression in HT-29 cells was analyzed. Results The proliferation inhibition of DAPT on HT-29 cells was in a dose- and time-dependent manner. The proliferation ability of cells at 48, 72 h was lower than that at 24 h in the 40, 80 umol/L groups (P<0.05). Cells showed typical apoptosis state change after DAPT treatment. The mRNA expression of ALDH1, Notch4 and DLL1 in HT-29 cells treated with 20, 40 umol/L DAPT was lower than that treated with 0 umol/L DAPT (allP<0.05). The protein expression of ALDH1, Notch4 and DLL1 in HT-29 cells treated with 0, 20, 40 μmol/L DAPT was decreased successively (allP<0.05). Immunohistochemical image analysis, the OD value of protein expression of ALDH1, Notch4, and DLL1 in HT-29 cells treated with 0, 20, 40 umol/L DAPT was reduced in turn (allP<0.05). The mRNA expression of ALDH1 and DLL1 in HT-29 cells was positively correlated with Notch4 mRNA expression (r=0.997, 0.998; allP<0.05). The protein expression of ALDH1and DLL1 was positively correlated with Notch4 protein expression in the HT-29 cells (r=0.998, 0.999, allP<0.05). Conclusions After DAPT treatment, the cell proliferation is inhibited and the mRNA and protein expression of ALDH1, Notch4 and DLL1 is down-regulated. The proliferation inhibition of DAPT on HT-29 cells may be related to reducing the cancer stem cell properties and down-regulating Notch signaling pathwayreceptor and ligand expression.
colorectal carcinoma; HT-29 cells; γ-secretase inhibitors; (2S)-NN-(3,5-fluorophenylacetyl) -L-alanyl-2-phenylglycine tert-Aldehyde dehydrogenase 1; tumor stem cells; aldehyde dehydrogenase 1; Notch signaling pathway; Notch4; DLL1
貴州省科技計劃項目(黔科合SY字2013-3006);貴州省科學技術基金資助項目(黔科合SY字2010-2172)。
趙小芳(1986-),女,碩士,主要研究方向為結直腸癌的防治。E-mail: 627813412@qq.com
王紅(1971-),女,主任醫師,主要研究方向為結直腸癌的防治。E-mail: wanghong89zy@163.com
10.3969/j.issn.1002-266X.2017.15.002
R735.3
A
1002-266X(2017)15-0005-04
2016-10-21)

