尼羅羅非魚P2X4R基因克隆及原核表達分析
余艷玲 張永德 潘傳燕 馮鵬霏 羅洪林
摘要:【目的】克隆尼羅羅非魚P2X4R基因,并構建原核表達載體進行誘導表達,為深入研究P2X4R在魚類中的生物學功能打下基礎。【方法】利用PCR克隆尼羅羅非魚P2X4R基因的3個片段(Gl、G2和G3),拼接獲得目的基因后連接pCold Ⅱ載體構建pCold Ⅱ-P2X4R重組質粒,再轉化大腸桿菌BL21(DE3)感受態細胞,以IPTG進行誘導表達。分別采用SDS-PAGE和HWestem blotting檢測分析重組蛋白P2X4R的表達情況,并運用生物信息學在線分析軟件對其理化性質、糖基化位點、跨膜區域、亞細胞定位及信號肽等進行預測分析。【結果】克隆獲得的尼羅羅非P2X4R基因大小為1108 bp,與pCold Ⅱ載體重組后轉化BL21(DE3)感受態細胞獲得的原核表達載體經IPTG誘導可表達獲得目的蛋白,在IPTG 1.0 mmol/L、37℃誘導4 h的條件下重組蛋白表達量高于在IPTG 0.1 mmol/L、16℃過夜誘導的表達量。重組蛋白P2X4R的分子量約43.0 kD,其氨基酸數量為354個,理論等電點(pI)為6.78,不穩定指數為37.62,屬于穩定蛋白,脂肪族指數為74.35;重組蛋白P2X4R具有3個N-糖基化位點和1個O-糖基位點;該蛋白未見跨膜區,其蛋白幾乎100%位于細胞膜內,不含信號肽。【結論】誘導表達獲得的尼羅羅非魚P2X4R蛋白具有3個N-糖基化位點和1個O-糖基化位點,推測其存在糖基化現象,可制備相應抗體用于揭示羅非魚巨噬細胞的抗原呈遞作用機制。
關鍵詞:羅非魚;P2X4R基因;克隆;原核表達;生物信息學分析
中圖分類號:S965.125 文獻標志碼:A 文章編號:2095-1191(2017)12-2259-07
0引言
【研究意義】嘌呤能P2X受體(P2XR)是由細胞外ATP激活的配體結合非選擇性陽離子通道家族成員(Khakh and North,2006),目前已發現有7個亞型,分別為P2X1R~P2X7R(Egan et al.,2004;Weinholdet al.,2010),各亞基結構特征均包含1個大的細胞外環、2個跨膜結構域和2個(氨基和羧基末端)細胞質結構域(North,2002)。經ATP激活后,P2XR在正常和病理條件下可引起不同的細胞反應(Ralevic and Bumstock,1998),且不同P2XR亞型在免疫細胞中均有表達,參與先天免疫調節(Vitiello et al.,2012),其中P2X4R是中樞神經系統中表達量最高的P2XRSIE型。P2X4R基因主要在呼吸道細胞(Nagaoka et al.,2009;Miklavc et a1.,2013)、小膠質細胞(Trang and Salter,2012)、心肌細胞(Yang et al.,2014)、生殖細胞(Gorodeski,2015)、中性白細胞、嗜酸性粒細胞、肥大細胞、T細胞和B淋巴細胞(Di Virgilio and Vu-erich,2015)中表達,因此,明確P2X4R表達分帶情況對研究機體免疫及其調控機理具有重要意義。【前人研究進展】已有研究表明,P2X4R在小膠質細胞中可能參與神經性病理疼痛、炎性疼痛(Guo et al.,2005;Tsuda et al.,2005)或癌性疼痛(Gilchrist et al.,2005)調節。在大鼠C6膠質瘤模型中,P2X4R基因在與腫瘤相關的巨噬細胞中上調表達(Guo et al.,2004),]tP2X4R與P2X7R互動激活NLRP3炎性小體(Zechet al.,2016)。P2X4R在控制動物先天性免疫應答過程中也發揮重要作用(de Rivero Vaccari et al.,2012;Kawano et al.,2012b;Chen et al.,2013),具體表現為調節巨噬細胞自噬能力和激活T細胞功能(Burnstock and Boeynaems,2014),但在嗜酸性粒細胞等其他免疫細胞中的功能尚未明確。成功表達P2X4R蛋白是進一步驗證其作用機理的基礎工作,李琳琳等(2014)成功構建了穩定表達大鼠P2X4R的HEK293細胞系;Zech等(2016)研究發現,P2RX4缺乏可緩解支氣管肺泡嗜酸性粒細胞增多、支氣管周炎、Th2細胞因子產生和支氣管高反應性,即P2RX4拮抗劑是治療過敏性哮喘的新選擇;Asatryan等(2017)研究發現,P2X4R可在較低的ATP濃度(<0.1mmol/L)下被激活,激活后有助于腦源性神經營養因子的釋放,且其在觸覺異常性疼痛和神經性疼痛中的作用已被證實。【本研究切入點】與哺乳動物相比,P2X4R在低等脊椎動物中的研究報道極少,尤其在魚類免疫學中的作用機理亟待闡明。【擬解決的關鍵問題】通過克隆尼羅羅非魚P2X4R基因,并構建其原核表達載體進行誘導表達,以期為深入研究P2X4R在魚類中的生物學功能打下基礎。
1材料與方法
1.1試驗材料
供試尼羅羅非魚取自國家級廣西南寧羅非魚良種場,體重326.3g/尾;大腸桿菌DH5a、BL21(DE3)表達菌株、pCold Ⅱ克隆載體和限制性內切酶購自寶生物工程(大連)有限公司;2xFast Pfu Mix、NovoRecPCR一步定向克隆試劑盒及DL2000 DNAMarker購自Novoprotein公司;AxyPrep質粒DNA小提試劑盒購自康寧生命科學(吳江)有限公司;IPTG購自美國sigma公司;其他試劑均為國產分析純。
1.2 pCodII-P2X4R質粒載體構建
根據尼羅羅非魚P2X4R基因序列(GenBank登錄號XM 003448554),利用Primer Premier 5.0對目的基因分3個片段(G1、G2和G3)進行引物設計(表1),分別為P2X4R-F/P2X4R-R1、P2X4R-F1/P2X4R-R2和P2X4R-F2/P2X4R-R,對應目的片段大小為100、948和109 bp。引物由生工生物工程(上海)股份有限公司合成。
PCR反應體系50.0μL:2×Fast Pfu Mix 25.0μL,上、下游引物(10 μmol/L)各2.0μL,DNA模板1.0μL,ddH20補足至50.0μL。擴增程序:94℃預變性5 min;94℃20 s,55℃20 s,72℃延伸(片段G1和G3為20 s,片段G2為1 min),進行30個循環;最后72℃延伸10 min。然后將擴增獲得的3段PCR產物以摩爾比1:1:1等量混合作為模板,再以P2X4R-F和P2X4R-R為引物進行PCR擴增,將3段基因序列進行拼接,PCR反應體系及擴增程序同上。
利用限制性內切酶Nde Ⅰ與Hind Ⅲ對pCold Ⅱ載體進行雙酶切線性化處理,然后將拼接獲得的目的基因片段與線性化載體以摩爾比5:1混合,采用NovoRecPCR一步定向克隆試劑盒進行連接。PCR反應體系20.0μL:10xReaction Buffer 2.0μL,P2X4R250 ng,pCold Ⅱ(Nde Ⅰ/Hind Ⅲ)300 ng,Seamless Cloning Enzyme 1.0μL。混勻,37℃下放置20 min后立即轉化DH5aα感受態細胞,抽提測序結果正確的陽性克隆即為pCold Ⅱ-P2X4R重組質粒。
1.3 PCR鑒定
挑取轉化培養基上的白色單克隆,置于500.0μL含氨芐青霉素(Amp)的LB液體培養基中,37℃下搖床(180 r/min)培養3~4 h后,用于菌液PCR鑒定。PCR反應體系20.0μL:2xFast Taq Master Mix 10.0μL,上游引物P2X4R-F(10μmol/L)和下游引物P2X4R-R(10μmol/L)各1.0μL,DNA模板1.0μL,ddH20 7.0μL。擴增程序:94℃預變性5 min;94℃20 s,55℃20 s,72℃1 min,進行28個循環;最后72℃延伸10 min。擴增產物用1%瓊脂糖凝膠電泳進行檢測,陽性克隆經擴大培養后送至生工生物工程(上海)股份有限公司測序。
1.4 P2X4R原核表達
1.4.1表達菌株轉化采用AxvPrep質粒DNA小提試劑盒從轉化的DH5a感受態細胞中提取pColdII-P2X4R重組質粒,取10.0μL抽提產物加入到50.0μL的BL21(DE3)感受態細胞中,冰浴30 min后42℃水浴熱激45 s,立即取出置于冰上冷卻2 min,加入500.0μL不含抗生素的LB液體培養基,37℃下振蕩培養1 h。將上述培養液均勻涂布于含Amp的LB固體培養基上,37℃下倒置培養16 h,挑取長勢較好的單菌落接種于LB液體培養基中,37℃下搖床(180r/min)培養3 h。對菌液進行PCR鑒定,并用1%瓊脂糖凝膠電泳檢測PCR產物,陽性克隆送至生工生物工程(上海)股份有限公司測序。
1.4.2目的蛋白誘導表達 挑取陽性單菌落接種于1.O mL的LB液體培養基(Amp 50 μg/mL)中,37℃下搖床(180 r/min)培養過夜,次日按1%(v/v)比例進行擴大培養,37℃下搖床(180 r/min)培養至OD600=0.8,加入IPTG進行誘導。誘導條件:①IPTG1.0 mmol/L,37℃誘導4 h;②IPTG 0.1 mmol/L,16℃過夜誘導。按上述條件誘導表達后收集菌體,并懸浮于PBS緩沖液中,4℃下超聲波破碎,直至溶液透明。12000 r/min離心20 min,分別收集上清液和沉淀,然后進行SDS-PAGE分析及Western blotting檢測。
1.5羅非魚P2X4R蛋白生物信息學分析
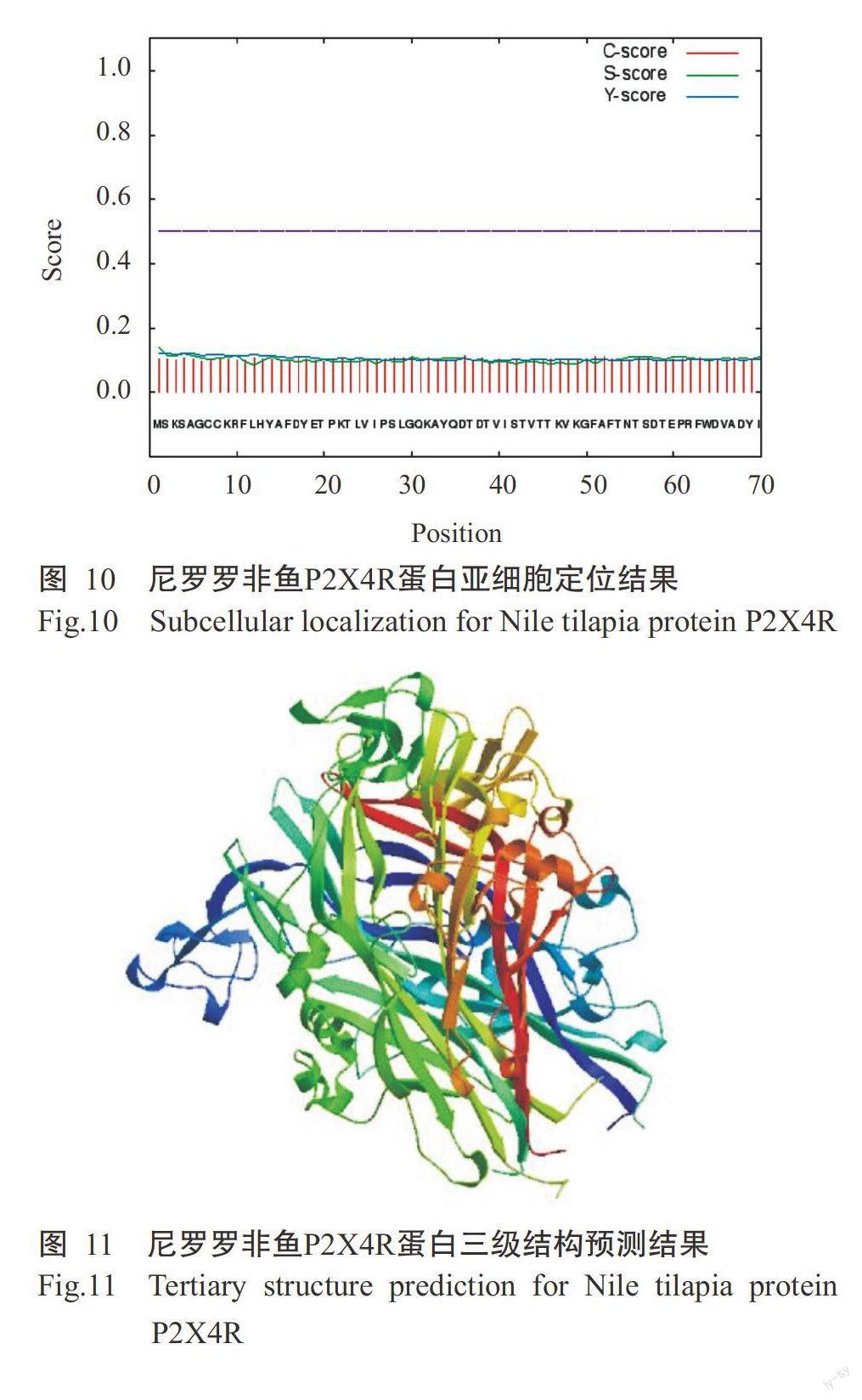
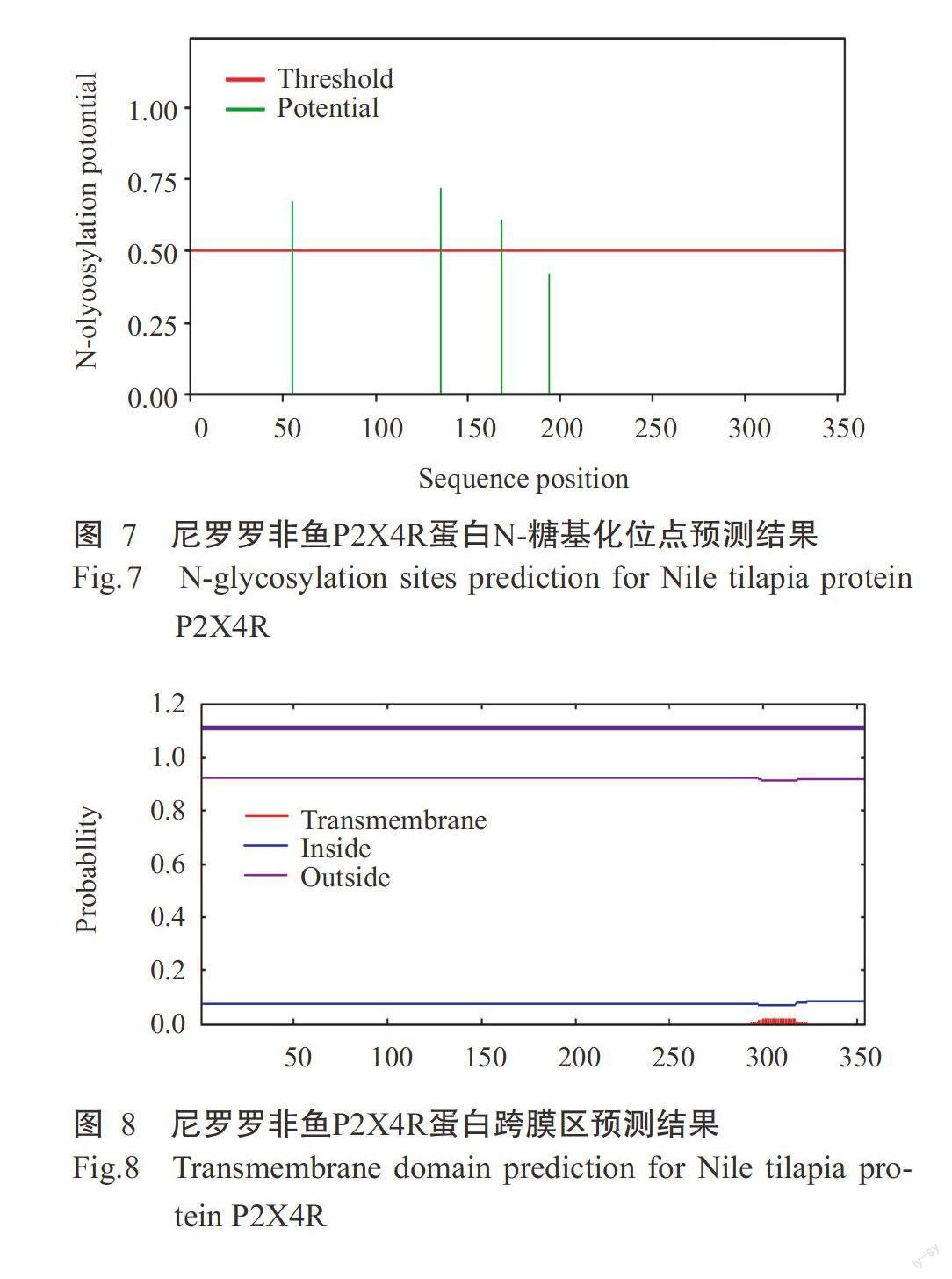
誘導表達獲得的尼羅羅非魚P2X4R蛋白序列采用ProtPara(http:∥web.expasy.org/protparam)進行基本理化性質分析,采用NetNGlyc 1.0及NetOGlyc 4.0(http:∥www,expasy.org/tools)對其糖基化位點進行預測,以ProtScale(http:∥web.expasy.org/protparam/)預測其親/疏水性及穩定性,通過TMHMM(http:∥www.cbs.dtu.dk/services/SignalP)進行蛋白跨膜區和信號肽預測,以TargetP(http:∥www.cbs.dtu.dk/ser-vice/TargetP)進行亞細胞定位,并通過SWISS-MOD-EL(https:∥swissmodel.expasy.org)進行P2X4R蛋白同源性建模。
2結果與分析
2.1尼羅羅非魚P2X4R基因克隆
尼羅羅非魚P2X4R基因分3個片段(G1、G2和G3)進行擴增,電泳結果如圖1所示。其中,G1、G2和G3片段大小分別為100、948和109 bp,且均為單一的特異性條帶,與預期結果一致。將3個基因片段進行PCR拼接擴增,結果得到大小為1108 bp的基因片段(圖2),與預期結果一致,說明目的基因拼接效果良好。
2.2 pCold Ⅱ-P2X4R重組質粒的PCR鑒定結果
挑取轉化培養基上的6個白色單克隆,經PCR擴增和電泳檢測,結果顯示,目的基因片段大小1108bp的單一特異性條帶(圖3),與P2X4R基因的PCR拼接擴增結果一致,說明P2X4R基因已成功連接至pCold Ⅱ載體上。pColdⅡ-P2X4R重組質粒中P2X4R基因的位置如圖4所示。
2.3重組P2RX4蛋白的誘導表達情況
采用兩種不同誘導條件對重組P2X4R蛋白進行誘導表達,經SDS-PAGE分析和Westem blotting檢測發現,兩種誘導條件下重組P2X4R蛋白均有表達(圖5和圖6),重組P2X4R蛋白分子量約43.0 kD,其表達形式均為包涵體,未檢測到可溶性蛋白。此外,在IPTG 1.0 mmol/L、37℃誘導4 h的條件下重組蛋白表達量高于在IPTG 0.1 mmol/L、16℃過夜誘導的表達量。
2.4尼羅羅非魚P2X4R蛋白的生物信息學分析結果
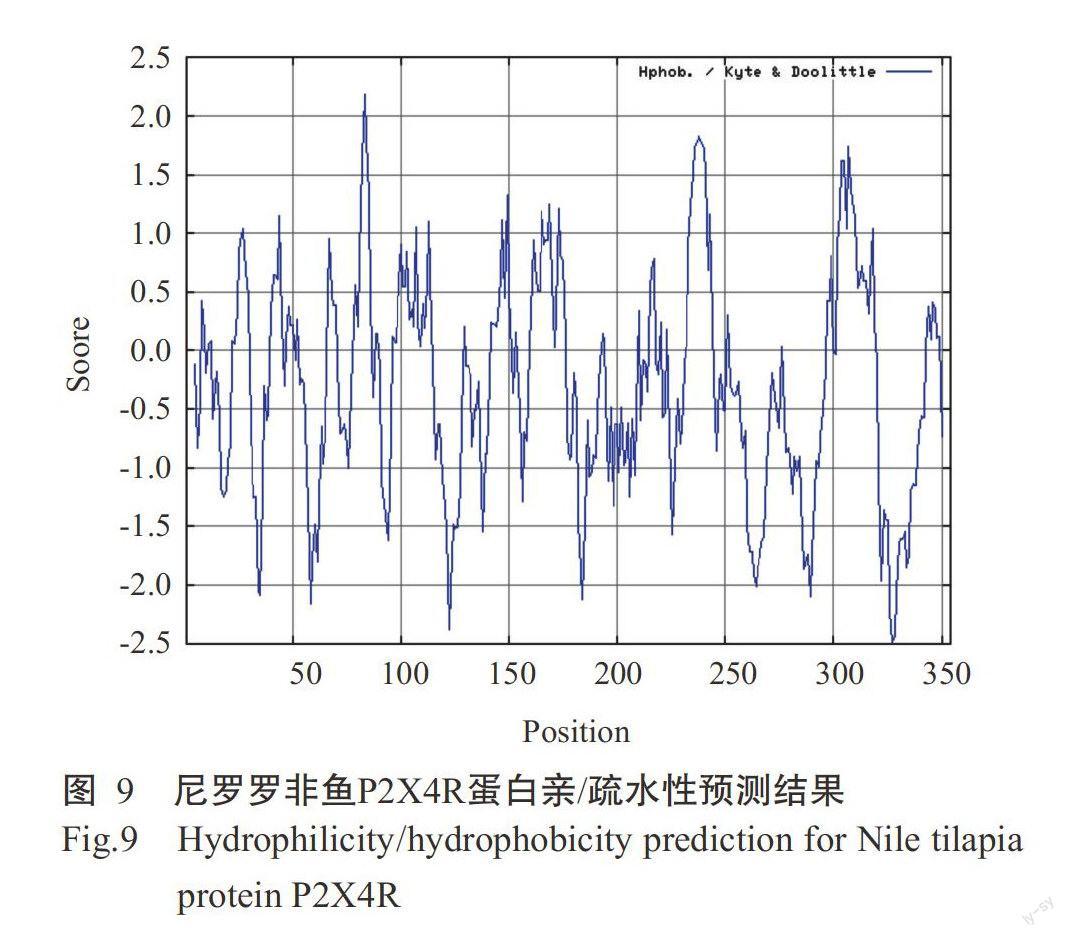
采用ProtPara對誘導表達獲得的尼羅羅非魚P2X4R蛋白進行基本理化性質分析,結果發現該蛋白氨基酸數量為354個,理論等電點(pI)為6.78。尼羅羅非魚P2X4R蛋白在哺乳動物網織紅細胞(體外)的半衰期為30 h,在酵母細胞內的半衰期大于20 h,在大腸桿菌內的半衰期大于10 h;不穩定指數(Ⅱ)為37.62,屬于穩定蛋白,脂肪族指數為74.35。糖基化位點預測結果表明,尼羅羅非魚P2X4R蛋白有3個N-糖基化位點,閾值為0.50(圖7),1個O-糖基位點。采用TMHMM對尼羅羅非魚P2X4R蛋白跨膜區進行預測分析,未發現該蛋白存在跨膜區(圖8),其蛋白幾乎1 00%位于細胞膜內,不含信號肽。親/疏水性預測結果(圖9)顯示,尼羅羅非魚P2X4R蛋白的平均親和性(GRAVY)為-0.307,說明該蛋白為親水性蛋白。亞細胞定位結果發現,尼羅羅非魚P2X4R蛋白的分泌途徑為“-”型(圖10),即定位在其他細胞器,無預測剪切位點序列,與TMHMM預測結果一致。利用SWISS-MODEL對尼羅羅非魚P2X4R蛋白進行三級結構預測,結果如圖11所示。
3討論
P2X4R是不同免疫細胞表達的主要嘌呤能P2X受體亞型之一,在哺乳動物中發揮重要的先天性免疫作用(Coutinho-Silva et al.,2005;de Rivero Vaccari et al.,2012)。與ATP結合后,P2X4R被快速活化,進而導致細胞內鈣離子濃度升高、絲裂原活化蛋白激酶(MAPKs)激活和促炎細胞因子產生(Seil et al.,2010;Tsuchiya et al.,2014)。P2X4R還參與NLRP3炎癥小體激活(de Rivero Vaccari et al.,2012;Chenet al.,2013)和P2X7R依賴性巨噬細胞凋亡(Kawano et al.,2012a),在微生物感染過程中發揮重要作用(Hung et al.,2013)。2009年,Kawate等首次構建了斑馬魚P2X4R的晶體結構;Li等(2015)通過克隆日本比目魚(Paralichthys olivaceus)P2X4基因的全長cDNA序列,發現P2X4R是一種膜糖蛋白,可與ATP釋放通道Pannexin-1相互作用,主要在日本比目魚肝胰腺中表達。本研究通過原核載體成功誘導表達獲得的尼羅羅非魚P2X4R蛋白主要以包涵體形式存在,其可溶性蛋白含量較少。原核表達蛋白常以包涵體形式存在,可通過蛋白復性加以解決,但蛋白復性處理程序較繁瑣,因此在誘導表達目的蛋白時最好降低甚至消除包涵體的產生,實現可溶性蛋白完全表達。導致原核蛋白表達形成包涵體的原因主要有兩種:一種是由于周圍環境的影響或缺乏所需要的酶和輔助因子,另一種是在超表達時由于折疊過快,未能及時進行正確的折疊所導致(Clark,2001)。本研究結果表明,通過降低誘導溫度和誘導劑濃度可降低P2X4R蛋白包涵體含量,但并未促使可溶性蛋白大量表達,后期仍需進行包涵體復性處理以獲得可溶性P2X4R蛋白。
通過對比NCBI數據庫中羅非魚P2X4R蛋白序列與本研究誘導表達獲得的尼羅羅非魚P2X4R蛋白,發現二者問的最大差異在于氨基酸數量和跨膜結構,其跨膜區分析結果表明,參考羅非魚P2X4R蛋白有5個片段結構,其中2個片段分布在細胞膜上,2個片段為跨膜區,1個片段分布在細胞內;而本研究誘導表達獲得的尼羅羅非魚P2X4R蛋白未見跨膜區,蛋白序列幾乎100%位于細胞膜內,推測該蛋白為完整羅非魚P2X4R蛋白的一部分,且是分布在細胞內的蛋白片段。理論上,誘導表達的尼羅羅非魚P2X4R蛋白條帶應略低于(Western blotting極性處理組)目的條帶,但該結果僅在IPTG 0.1 mmol/L、16℃過夜誘導的條件下出現,且出現一條分子量大于目的蛋白的條帶,即雙條帶現象。蛋白糖基化修飾是細胞內質網糖鏈添加到蛋白質上形成寡糖鏈的過程,研究表明細胞中有一半以上的蛋白質發生糖基化。糖基化作為一種主要的翻譯后修飾方式,對蛋白功能的正常發揮起重要作用,主要調控蛋白質在組織和細胞中的定位、功能、活性、壽命和多樣性。Gong等(2002)研究認為,具有糖基化位點的蛋白可通過糖基化位點基因誘變以去除糖基化位點的表達。本研究發現,兩種IPTG誘導條件下表達獲得的尼羅羅非魚P2X4R蛋白具有3個N-糖基化位點和1個O-糖基化位點,推測其存在糖基化現象,但尚需通過糖基化染色進一步驗證。
4結論
誘導表達獲得的尼羅羅非魚P2X4R蛋白具有3個N-糖基化位點和1個O-糖基化位點,推測其存在糖基化現象,可制備相應抗體用于揭示羅非魚巨噬細胞的抗原呈遞作用機制。

