基于對比實驗和創新實驗的化學教學
伍強+黃晶+杜金鈴
摘要:分析了教材中碳酸鈉和碳酸氫鈉相關的內容,認為應設計對比實驗來探究碳酸鈉和碳酸氫鈉的性質。分析了相關實驗的設計,認為實驗設計還有創新的空間。指出學生在學習中存在的困惑問題及教師在教學時遇到的困擾問題,認為教學環節的設計和相關實驗的創新必須解決教與學的問題。通過對比實驗教學,學生能較好地領悟物質化學反應原理、了解科學探究方法。通過學生實驗探究和教師創新實驗演示并進的多種實驗探究活動,培養學生的創新思維能力。
關鍵詞:碳酸鈉;碳酸氫鈉;對比實驗;創新實驗;實驗教學
文章編號:1005–6629(2017)4–0059–05 中圖分類號:G633.8 文獻標識碼:B
《化學教學》期刊設置了“實驗創新設計”的欄目,展示了豐碩的實驗創新成果。但從目前教學期刊上發表的“碳酸鈉和碳酸氫鈉”教學課例來看,將實驗創新成果融入課堂教學的現狀并不樂觀。如比較Na2CO3和NaHCO3的熱穩定性選用套管實驗,二者與酸反應仍用等質量的Na2CO3和NaHCO3粉末與稀鹽酸反應的實驗,CO2氣體與Na2CO3溶液反應采用CO2氣體通入飽和Na2CO3溶液實驗的剪輯視頻。目前部分教師還存在一種錯誤的認識,認為按照教科書上的實驗方案做了實驗探究,就能很好地完成了實驗教學。殊不知教科書編寫的意圖是“要有助于發揮化學教師的創造性,應留給教師較大的創造空間,使教師在實踐中充分發揮教學的主動性和創造性”[1]。為此,筆者嘗試將實驗創新成果融入課堂教學,試圖培養學生的創新思維能力。
1 課程標準和教材內容分析
課程標準指出:根據生產、生活中的應用實例或通過實驗探究,了解鈉等金屬及其重要化合物的主要性質[2]。Na2CO3和NaHCO3的性質是人教版《化學1》“科學探究”的內容,就二者的外觀、水溶性、溶解熱效應、溶液酸堿性和熱穩定性進行了實驗探究,二者與稀鹽酸的反應只要求寫出反應的離子方程式[3]。人教版強調對比實驗的設計,卻忽視了二者與稀鹽酸反應的實驗探究。同樣,蘇教版《化學1》“活動與探究”的內容,對澄清石灰水和CaCl2溶液分別與Na2CO3溶液反應、濃鹽酸與Na2CO3溶液反應、用pH試紙測定Na2CO3溶液pH和Na2CO3溶液去油污性能進行了實驗探究,同時教材提供了Na2CO3和NaHCO3的性質比較信息,要求設計實驗方案區別Na2CO3和NaHCO3的固體[4]。蘇教版強調Na2CO3性質的實驗探究,卻忽視了NaHCO3性質的實驗探究。從兩個版本的教材內容分析,在實施教學過程中,應增加設計對比實驗來探究Na2CO3和NaHCO3的性質。
2 相關實驗設計的分析
2.1 Na2CO3、NaHCO3的固體熱穩定性實驗
人教版方案是將Na2CO3和NaHCO3的固體分別裝在兩支試管中,用酒精燈加熱,將可能生成的氣體通入澄清石灰水中,實驗現象明顯。缺點是分別做兩次實驗,需兩次加熱,實驗加熱環境不同,因此實驗對比性差。為使實驗對比性強,已有套管實驗設計。實驗裝置如圖1所示,實驗現象明顯,且只需一次加熱。但此實驗把不易分解的Na2CO3固體放在溫度較高的外管,把易分解的NaHCO3固體放在溫度較低的內管。這是在NaHCO3比Na2CO3容易分解的前提下設計的,實驗預設性太強,缺乏探究性。
2.2 Na2CO3、NaHCO3與稀鹽酸反應的實驗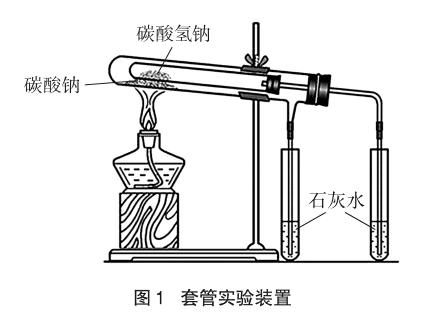
人教版全日制普通高級中學教科書設計了Na2CO3和NaHCO3粉末與稀鹽酸反應的對比實驗。實驗如下:“在兩支試管中分別加入3mL稀鹽酸,將兩個各裝0.3g Na2CO3或NaHCO3粉末的小氣球分別套在兩支試管口。將氣球內的Na2CO3和NaHCO3同時倒入試管中。[5]”通常觀察到NaHCO3固體與稀鹽酸反應速率比Na2CO3固體與稀鹽酸反應速率大。事實上,兩個反應速率大小與如下三個因素有關:一是Na2CO3與鹽酸發生分步反應;二是顆粒大小,無水Na2CO3固體顆粒較大,NaHCO3晶體顆粒較小;三是熱效應,Na2CO3固體溶解以及與鹽酸反應均是放熱,NaHCO3晶體溶解以及與鹽酸反應均是吸熱。兩個反應速率大小除了Na2CO3與鹽酸發生分步反應的影響因素外還有兩個影響因素,而對比實驗中只考慮一個影響因素,因此不符合對比實驗基本要求。現行人教版刪除了這個實驗,要求學生寫出Na2CO3、NaHCO3與稀鹽酸反應的離子方程式。蘇教版設計了Na2CO3溶液與濃鹽酸反應實驗,仍不能解決Na2CO3溶液和稀鹽酸發生分步反應的機理。
2.3 飽和Na2CO3溶液與CO2氣體反應的實驗
有教師認為,向飽和Na2CO3溶液中通入CO2氣體沒有什么好研究的,NaHCO3溶解度比Na2CO3小,通入CO2氣體后很快會析出白色晶體,教材沒有要求做此實驗就不做了。筆者用啟普發生器快速生成CO2氣體,通入飽和Na2CO3溶液中,20幾分鐘后才有微量晶體析出[6],做過此實驗的教師都認為不適宜作課堂演示實驗。有教師在課堂中演示了如下實驗:用大理石與稀鹽酸反應生成的CO2氣體和用雪碧(飲料)產生的CO2氣體,分別通入飽和Na2CO3溶液中,約3min均出現白色沉淀[7]。該教師將CO2氣體通入過飽和Na2CO3溶液中,析出的是碳酸鈉晶體。
從以上三個實驗設計分析可知,實驗設計還有創新的空間。
3 學生學習困惑和教師教學困擾
3.1 Na2CO3溶液與稀鹽酸分步反應
向Na2CO3溶液中滴加稀鹽酸發生分步反應的機理(Na2CO3+HCl=NaHCO3+NaCl;NaHCO3+HCl=H2O+CO2↑+NaCl)在高考和會考中時有出現。學生的困惑:受“鹽和酸反應生成新鹽和新酸”的定向思維影響,總認為向Na2CO3溶液中滴加稀鹽酸就會生成NaCl和CO2氣體。教師的困擾:向盛有Na2CO3溶液的試管中滴加稀鹽酸至過量,起初產生少量微小氣泡,隨后產生氣泡似乎增多,實驗現象不直觀,不能斷定是否生成了NaHCO3,只能在理論層面上給學生講述分步反應機理。
3.2 Na2CO3溶液與CO2氣體反應
用大理石與稀鹽酸反應生成的CO2氣體中含有HCl氣體,教師強調因CO2氣體會與Na2CO3溶液反應生成NaHCO3,則通過飽和NaHCO3溶液洗氣來除去HCl氣體,不能通過Na2CO3溶液洗氣。學生的困惑:教師沒有做過CO2氣體與Na2CO3溶液反應實驗,只是作了類比推理。教師的困擾:CO2氣體通入飽和Na2CO3溶液實驗不適宜作課堂演示實驗,只能作類比推理。CO2氣體能與CaCO3懸濁液反應生成Ca(HCO3)2溶液,則CO2氣體也能與Na2CO3溶液反應生成NaHCO3。
學生在學習中存在困惑問題,教師在教學時遇到的困擾問題,教學環節的設計和相關實驗的創新必須解決教與學的問題。
4 教學過程的設計
本節課設計了五個環節,一環扣一環,有效集中學生的注意力。
4.1 鈣化合物的轉化關系
[問題] Ca(OH)2微溶于水,澄清石灰水濃度小。向澄清石灰水中不斷通入CO2氣體將會出現什么現象?
[學生]澄清石灰水變渾濁。
[追問]后來呢?不知道(學生)。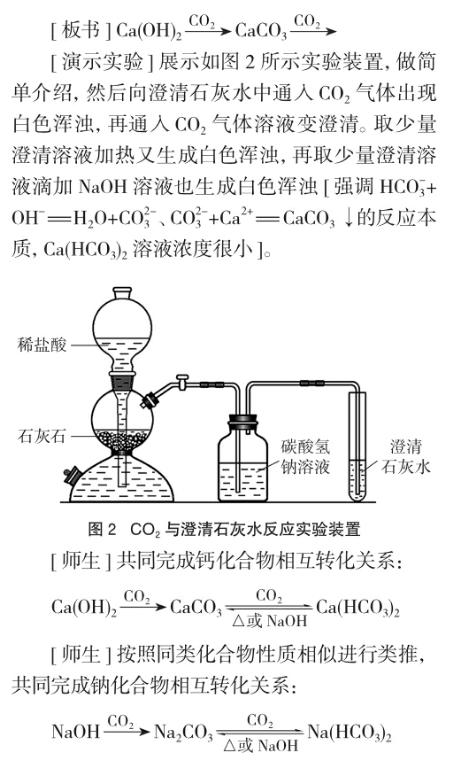
設計意圖:通過實驗再現鈣化合物性質,構建鈣化合物轉化關系,以此類推鈉化合物轉化關系。
4.2 溶解度、溶液酸堿性、熱穩定性
4.2.1 溶解度
[講述]固體物質在水中的溶解性分易溶(大于10g)、可溶(10~1g)、微溶(1~0.01g)、難溶(小于0.01g),在20℃時Na2CO3溶解度為21.5g、NaHCO3溶解度為9.6g。
[學生] Na2CO3屬易溶、NaHCO3屬可溶。
4.2.2 溶液酸堿性
[過渡] Na2CO3屬于鹽類,為什么俗稱純堿?
[學生] Na2CO3溶液可能呈堿性。
[學生實驗]取兩支試管分別加入少量1mol·L-1 Na2CO3、NaHCO3的溶液,請用pH試紙測定溶液pH,然后滴加酚酞溶液觀察顏色變化。
[實驗結果] Na2CO3、NaHCO3溶液pH分別為 12和8,滴加酚酞溶液分別呈現紅色和粉紅色。
4.2.3 熱穩定性
[過渡] CaCO3高溫分解,Ca(HCO3)2加熱分解,Na2CO3、NaHCO3固體熱穩定性如何?
[問題]請同學設計實驗,比較Na2CO3、NaHCO3固體的熱穩定性。
[學生實驗]取少量NaHCO3固體于試管中,并加熱,將可能產生的氣體通入澄清的石灰水中,以同樣的方法加熱Na2CO3固體實驗。
[實驗結果] NaHCO3固體易分解。
[演示實驗]展示如圖3所示的油浴法實驗裝置,做簡單的介紹,然后點燃酒精燈加熱約2分鐘,食用油溫度升高至130~140℃時,右側的澄清石灰水無明顯現象,左側的澄清石灰水變渾濁[8]。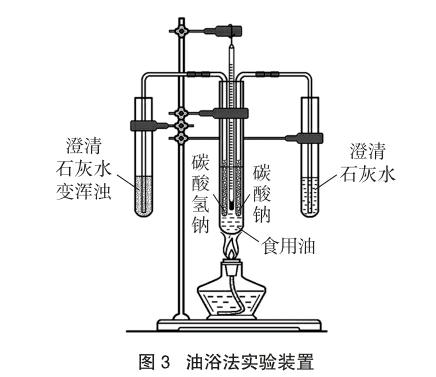
[實驗結果]NaHCO3固體易分解,Na2CO3難分解。
[學生] 2NaHCO3△=Na2CO3+CO2↑+H2O
設計意圖:掌握Na2CO3、NaHCO3溶解性和溶液酸堿性為以下實驗探究奠定基礎。油浴法實驗具有很好的對比性、探究性、直觀性和簡約性,可以粗略地測定NaHCO3分解的溫度,學生對其熱的不穩定性印象深刻。能拓展學生的知識面,培養學生的創新能力。
4.3 與酸反應
4.3.1 與稀鹽酸反應
[學生實驗]取兩支試管分別加入少量1mol·L-1 Na2CO3、NaHCO3的溶液,然后分別滴加1mol·L-1 鹽酸。
[實驗現象]向Na2CO3溶液中滴加稀鹽酸至過量,起初產生少量微小氣泡,隨后產生氣泡逐漸增多。向NaHCO3溶液中滴加稀鹽酸,立刻產生大量氣泡。
[教師]請寫出反應的化學方程式。
[學生] Na2CO3+2HCl(過量)=2NaCl+H2O+ CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑。
[設疑]向Na2CO3溶液中滴加稀鹽酸至過量,起初產生少量微小氣泡,隨后產生氣泡逐漸增多,可能還發生其他反應。
[教師]展示如圖4所示的恒壓式實驗裝置[9],作簡單介紹。
實驗1 向Na2CO3溶液中滴加稀鹽酸至過量
[演示實驗]如圖4裝置。在廣口瓶中加入1mol·L-1 Na2CO3溶液20mL,再滴入幾滴酚酞溶液,在分液漏斗中加入1mol·L-1鹽酸40mL。打開磁力攪拌器,攪拌待反應溶液。然后打開分液漏斗活塞,滴入約20mL稀鹽酸,關閉活塞。溶液由紅色變成粉紅色,反應沒有氣泡產生,氣球沒有增大。
[問題]反應沒有氣體生成,溶液變成粉紅色,反應生成了什么物質?
[學生]生成了NaHCO3。
[師生] Na2CO3+HCl(少量)=NaHCO3+NaCl。
[演示實驗]再次打開分液漏斗活塞,滴入剩余約20mL稀鹽酸。溶液由粉紅色變成無色,反應產生氣泡,氣球逐漸增大。
[教師] NaHCO3+HCl=NaCl+H2O+CO2↑(已寫出)。
實驗2 向稀鹽酸中滴加Na2CO3溶液至過量
[演示實驗]如圖4裝置。在廣口瓶中加入1mol·L-1鹽酸40mL,再滴入幾滴酚酞。在分液漏斗中加入1mol·L-1 Na2CO3溶液40mL。打開磁力攪拌器,攪拌待反應溶液。然后打開分液漏斗活塞,滴入Na2CO3溶液約20mL,關閉活塞。溶液保持無色,反應產生氣泡,氣球逐漸增大。
[教師] Na2CO3+2HCl(過量)=2NaCl+H2O+ CO2↑(已寫出)。
[演示實驗]再次打開分液漏斗活塞,滴入剩余約20mL Na2CO3溶液。溶液由無色變成紅色,氣球緩慢變小。Na2CO3溶液與CO2氣體反應速率很慢。
設計意圖:用恒壓式實驗裝置探究Na2CO3溶液與稀鹽酸互滴反應,實驗現象明顯、直觀,解決了向Na2CO3溶液中滴加稀鹽酸至過量發生分步反應的實驗教學難點問題。通過實驗探究,有助于學生更好地領悟Na2CO3溶液與稀鹽酸互滴反應的化學反應原理,理解Na2CO3與鹽酸分步反應的機理,領會化學反應中量變到質變的辯證思想,也讓學生了解某些化學反應的可控性。
4.3.2 飽和Na2CO3溶液與CO2氣體反應
[過渡] Na2CO3溶液能與稀鹽酸反應,Na2CO3溶液能不能與CO2氣體反應呢?
[師生實驗]取盛有CO2氣體的500mL普通礦泉水瓶,注入20mL飽和Na2CO3溶液,旋緊瓶蓋,劇烈振蕩礦泉水瓶1~2分鐘,礦泉水瓶變癟,再放置(或振蕩或將礦泉水瓶與桌面敲打幾下)1~3分鐘析出較多白色晶體并出現白色渾濁現象[10]。
[問題]白色晶體是什么物質?
[學生] NaHCO3晶體。
[師生] Na2CO3+CO2+H2O=2NaHCO3。
[教師]反應時水的量幾乎不變,為什么能析出NaHCO3晶體。
[學生]NaHCO3溶解度比Na2CO3小。
設計意圖:通過實驗探究,能讓學生深刻領悟Na2CO3溶液和CO2氣體反應的原理,NaHCO3溶解度比Na2CO3溶解度小的物理性質。說明:寒冷天氣實驗時,劇烈振蕩礦泉水瓶1~2分鐘,礦泉水瓶變癟,說明發生了反應,然后用溫水浸泡礦泉水瓶后再振蕩析出晶體;或者放置較長時間后自然析出晶體。

5.3 師生實驗探究并進,培養創新思維能力
對同一個化學反應,通過學生實驗探究和教師創新實驗演示并進的多種實驗探究活動,會引發學生認知的沖突,營造問題情境,激發學生探究的欲望。用油浴法實驗裝置探究Na2CO3、NaHCO3固體的熱穩定性,使學生感受到設計的實驗應具有科學性、可行性和簡約性。用恒壓式實驗裝置探究Na2CO3溶液與稀鹽酸互滴反應,使學生感受到某些化學反應的可控性。師生實驗探究并進,使學生體驗實驗探究的過程,激發學習化學的興趣,強化科學探究的意識,培養了學生的創新思維能力。
參考文獻:
[1][2]中華人民共和國教育部制定.普通高中化學課程標準(實驗)[S].北京:人民教育出版社,2003:40,11.
[3]宋心琦主編.普通高中課程標準實驗教科書·化學1(第3版)[M].北京:人民教育出版社,2007:56~57.
[4]王祖浩主編.普通高中課程標準實驗教科書·化學1(第6版)[M].南京:江蘇教育出版社,2014:50~52.
[5]人民教育出版社化學室.全日制普通高級中學教科書·化學(必修)(第一冊)[M].北京:人民教育出版社,2003:32.
[6][10]伍強.飽和碳酸鈉溶液和二氧化碳氣體反應實驗的研究[J].化學教學,2014,(11):56~57.
[7]游梅.一個大膽的猜想贏來的成功[J].中學化學教學參考,2014,(7):37.
[8][11]伍強.碳酸鈉和碳酸氫鈉性質對比實驗的研究[J].化學教學,2015,(12):48~50.
[9]伍強.碳酸鈉和碳酸氫鈉與稀鹽酸反應實驗的創新設計[J].化學教學2016,(8):64.

