QuEChERS-超高效液相色譜串聯質譜法測定水產品中紅霉素殘留
嚴忠雍,張小軍*,李佩佩,方益,喻亮,張帥,祝銀,李強
(1. 浙江省海洋水產研究所,浙江 舟山 316021; 2. 浙江省海洋漁業資源可持續利用技術研究重點實驗室,浙江 舟山 316021;3. 中國水產科學研究院,北京 100141)
QuEChERS-超高效液相色譜串聯質譜法測定水產品中紅霉素殘留
嚴忠雍1,2,張小軍1,2*,李佩佩1,2,方益1,2,喻亮1,2,張帥1,2,祝銀1,2,李強3
(1. 浙江省海洋水產研究所,浙江 舟山 316021; 2. 浙江省海洋漁業資源可持續利用技術研究重點實驗室,浙江 舟山 316021;3. 中國水產科學研究院,北京 100141)
建立了超高效液相色譜串聯質譜法測定水產品中的紅霉素殘留量.樣品用改進的QuEChERS(快速、簡單、廉價、高效、靈活和安全)進行提取凈化,經乙腈快速提取,無水硫酸鎂和氯化鈉除水后,用N-丙基乙二胺(PSA)凈化,液相色譜串聯質譜分析測定.在ACQUITY UPLC BEH C18色譜柱上進行分離,采用梯度洗脫,以0.1%甲酸水溶液和甲醇為流動相,電噴霧正離子電離,多反應監測模式,內標法定量.結果表明:紅霉素濃度在0.5~50 μg·L-1時具有良好的線性關系,相關系數為0.997 6,定量限為0.3 μg·kg-1,回收率為87.6%~96.1%,相對標準偏差為2.2%~5.3%.本方法操作簡易、應用性強,適合水產品中紅霉素的常規檢測.
QuEChERS;液相色譜串聯質譜;水產品;紅霉素
紅霉素(Erythromycin)是由紅霉素鏈霉菌產生的一種廣譜大環內酯類抗生素,對革蘭陽性桿菌、葡萄球菌和鏈球菌屬都具有良好的抑制作用,廣泛應用于臨床和養殖領域[1].紅霉素能與敏感細菌的50S核蛋白體亞基可逆性結合,通過抑制新合成的肽基tRNA分子從核蛋白體受體部位移至肽酰基結合部位,從而抑制細菌蛋白質的合成[2].然而,紅霉素在生物體內代謝時間長,且過量使用會引起人體過敏,造成胃腸道、肝臟損傷等危害.鑒于紅霉素的嚴重危害性,為更好地保障食品安全,歐美EC 1181/2002[3]和我國農業部235號公告規定,動物源性組織中紅霉素的最大殘留量為200 μg·kg-1.
目前測定動物源性組織中紅霉素殘留的方法主要有薄層色譜法(TLC)[4]、液相色譜-二極管陣列檢測法(LC-DAD)[5]、液相色譜-電噴霧法(LC-CAD)[6]和液相色譜-質譜法(LC-MS/MS)[7].液相色譜-串聯質譜法靈敏度高、精確度好,是目前檢測紅霉素殘留的主要方法.由于水產品的成分和基質較復雜,目標分析物易被基質干擾遮蔽,故開發一種能有效提取凈化的前處理方法是水產品藥物殘留分析測定的關鍵.目前,紅霉素殘留檢測的前處理方法主要有傳統液液萃取、在線固相萃取和分子印跡固相萃取等,但這些方法存在試劑量消耗大、操作步驟煩瑣、需使用特殊設備或需要特定的實驗環境等問題.QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe)是一種快速、簡單、便宜、高效、耐用和安全的新興提取凈化技術,所需實驗設備簡單、試劑消耗量少、操作步驟簡單、處理時間短、提取凈化效率高、可控性強,為解決上述問題提供了新途徑[8-10].本研究改進了QuEChERS提取凈化方法,并結合超高效液相色譜串聯質譜定量分析高靈敏度的優勢,建立QuEChERS-超高效液相色譜串聯質譜法以測定水產品中的紅霉素殘留.
1 實驗部分
1.1 儀器和試劑
ACQUITYTMUPLC-Quattro Premier XE質譜儀(美國Waters公司);Centrifuge5810高速離心機(德國Eppendorf公司);N-EVAP-112氮吹儀(美國Organomation公司);MS2漩渦混合器(德國IKA公司).甲醇、乙腈(均為色譜純,德國Merck公司);氯化鈉、甲酸、無水硫酸鎂均來自美國Sigma公司;石墨化炭黑(GCB,37~125 μm)、N-丙基乙二胺(PSA,40~63 μm)、十八烷基硅烷鍵合硅膠(C18,40~63 μm);實驗用水為Millipore-Q系統制備的超純水.
紅霉素標準品(純度≥97.0%,德國Dr. Ehrenstorfer公司);紅霉素同位素標記物標準品(純度≥99.0%,美國Sigma公司).準確稱取5 mg紅霉素和紅霉素同位素標記物,用甲醇溶解并分別定容至50 mL,-20 ℃保存,保存期3個月;使用時分別用甲醇逐級稀釋成100 ng·mL-1的紅霉素標準工作液和紅霉素內標工作液.
1.2 前處理方法
稱取已均質樣品(5.00±0.02) g于50 mL離心管中,添加100 μL濃度為100 ng·mL-1的紅霉素內標工作液和10 mL乙腈,渦旋提取2 min,加入4.00 g無水硫酸鎂和1.00 g氯化鈉,渦旋振蕩2 min,6 000 r·min-1離心5 min;取5 mL上清液至15 mL離心管,50 ℃氮吹至干,用1 mL 30%甲醇水溶液溶解殘留物,稱取100 mg PSA添加到離心管,振蕩渦旋1 min,8 000 r·min-1離心5 min,再用0.22 μm濾膜過濾,供儀器測定分析.
1.3 儀器條件
液相色譜柱:ACQUITYTMUPLC BEH C18柱(50 mm×2.1 mm,1.7 μm);樣品室溫度10 ℃;柱溫40 ℃;流速0.3 mL·min-1;進樣量10 μL;流動相A為甲醇,B為0.1%甲酸溶液,梯度洗脫:0~1.0 min,70% B;1.0~1.2 min,70%~10% B;1.2~3.0 min,10% B;3.0~3.5 min,10%~70% B;3.5~5.0 min,70% B.
質譜條件:電噴霧正離子源(ESI+);檢測模式:多反應監測模式(MRM);毛細管電壓:3.5 kV;離子源溫度:110 ℃;脫溶劑溫度:360 ℃;脫溶劑氣流量:800 L·h-1;錐孔氣流量:50 L·h-1.紅霉素及紅霉素內標物的質譜多反應監測采集參數如表1所示.

表1 紅霉素和紅霉素內標物的質譜采集參數
注 “*”為定量離子(Quantitative ion).
2 結果與討論
2.1 色譜和質譜條件優化
實驗以0.1%甲酸-甲醇為紅霉素和紅霉素內標物的色譜分離流動相,一方面分析物在甲醇中的離子化效率和分析靈敏度較乙腈高;另一方面0.1%體積分數的甲酸溶液能改善分析物的色譜峰形,提高分析物的響應值.在保證高靈敏度的同時,實驗開發的洗脫條件能在2 min內完全洗脫分析物,大大縮短了分析時間,提高了色譜分離的效率,且峰形尖銳對稱,無出現拖尾和雙頭峰等現象.
為獲得分析物的質譜采集參數和質譜的儀器分析條件,比較了ESI+和ESI-掃描模式下紅霉素及其內標物的響應,并對錐孔電壓、碰撞能量等參數進行優化.結果表明,ESI+掃描模式下分析物的響應值較ESI-掃描模式高.在正離子一級全掃描下,發現特征離子峰[C37H67NO13+H]+(m/z=734.5)豐度最高,將其選擇為紅霉素的母離子,并進行二級質譜裂解分析.從裂解得到的離子碎片信息中發現,紅霉素特征離子峰m/z=734.5在二級碰撞能量不斷增大時,離子碎片逐漸增多,其中離子碎片峰m/z為158.1和576.4時,豐度較高,依次將其選為定量離子和定性離子.紅霉素的離子碎片信息及二級裂解質譜圖如圖1所示.
液相色譜串聯質譜法通常依據色譜峰面積進行定量,為確保儀器的穩定性和重現性,根據單個離子色譜峰需有12~20個掃描點數的原則,采用質譜多反應監測模式(MRM),并將單個通道內的3種監測離子對滯留時間(Dwell time)都設為0.18 s.在有效保證色譜峰寬為0.15 min的同時,使每個離子色譜峰掃描點數達到15個,提高了液相色譜串聯質譜分析的重現性.

圖1 紅霉素質譜圖Fig.1 Mass spectra of erythromycin
2.2 前處理方法改進
QuEChERS技術分為提取、鹽析和凈化3個步驟,通常將純乙腈或酸化乙腈作為萃取劑.由于紅霉素對酸較敏感,在酸性條件下不穩定,故選擇10 mL純乙腈作為萃取劑,既能有效提取樣品中殘留的紅霉素,也能保持目標物的穩定性;而氮吹后的殘留物不采用初始流動相溶解,因此,便于樣品液保存.水產品本身含有大量水分,需在萃取過程中加入無水MgSO4、NaCl以去除水分.NaCl的飽和水溶液對混合液起分層作用;無水MgSO4能吸水發熱,且能促使分析物從水相轉移至有機相,提高萃取效率.為縮短前處理時間,減少吸附劑的消耗量,同時保證有足夠的樣品提取液,本實驗將樣品提取液稀釋1倍,并氮吹濃縮至干,用30%體積分數甲醇水溶液復溶殘留物.結果表明,改進后方法的檢出限、回收率和重復性并無顯著變化,但縮短了前處理時間,符合實際檢測需求.
2.3 吸附劑的選擇
QuEChERS方法是利用萃取液中的吸附劑與樣品基質中的雜質相互作用,實現分析物的提取和凈化.選擇適合的吸附劑是開發QuEChERS方法的核心,只有適合的吸附劑才能在高效吸附雜質的同時,不干擾分析物的測定.吸附劑的選擇主要依據樣品基質中蛋白、脂肪酸及色素等雜質的分布,其中C18能通過非極性相互作用去除樣品中的脂肪和糖類物質;GCB是具有陰離子交換作用的吸附劑,能有效吸附平面分子結構的雜質;PSA帶有2個氨基,通過氫鍵相互作用吸附極性色素、極性有機酸等雜質.為考察3種吸附劑對分析物的影響,分別將100 mg的3種吸附劑加入到1 mL濃度為20 μg·L-1的紅霉素標準溶液中,比較相對應的紅霉素色譜峰面積,結果如圖2所示.GCB和C18對紅霉素具有很強的吸附能力,而PSA對紅霉素無明顯吸附作用,因此選擇PSA作為凈化吸附劑.
為確定吸附劑PSA的合適用量,實驗分別稱取50,75,100,125,150 mg PSA凈化添加濃度為10 μg·kg-1的草魚樣品.通過比較分析物的響應值、峰面積,計算分析物的信噪比,從樣品回收率、樣品凈化液的實際澄清度及吸附劑消耗量等角度評價PSA的合適用量.綜合評價結果如圖3所示,75,100 mg PSA都有較高的響應值和回收率,但75 mg PSA在實際使用過程中復溶液透明度不高,仍有部分雜質存在,影響過膜及儀器分析.因此,最終選定100 mg PSA為本實驗的合適用量,其對應白蝦樣品的MRM圖如圖4所示.

圖3 不同用量PSA對實驗結果的影響Fig.3 Effects of different amounts of PSA on the experimental results
2.4 基質效應、線性關系和檢出限
內標的使用能部分抵消基質效應及前處理過程中產生的實驗誤差.為進一步檢測基質效應,將提取液作為基質溶液,分別用基質溶液與30%甲醇水溶液各配制2和5 μg·L-1紅霉素溶液,比較對應的平均峰面積.計算可得基質效應(ME)為3.6%,表明基質效應對定量分析影響較小.
在優化的實驗條件下,用30%甲醇水溶液配制0.5~50 μg·L-1系列標準工作液,內標濃度均為10 μg·L-1,以峰面積對應的濃度繪制標準曲線.結果表明,紅霉素濃度在0.5~50 μg·L-1時具有良好的線性關系(R2=0.997 6),能夠滿足定量分析的需求;分別以3倍信噪比計算紅霉素的檢出限(LOD)、10倍信噪比計算定量限(LOQ),得到檢出限和定量限分別為0.1和0.3 μg·kg-1.
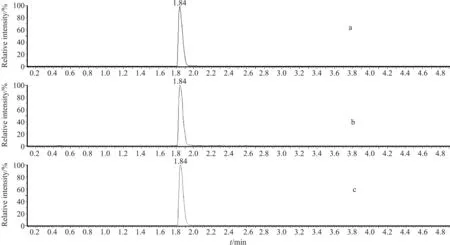
圖4 100 mg PSA凈化后的白蝦樣品(紅霉素加標濃度為2 μg·kg-1)MRM圖Fig.4 MRM ion chromatograms of white prawn containing 2 μg·kg-1 erythromycin purified with 100 mg PSAa—定量離子對(quantitative ion pair);b—定性離子對(qualitative ion pair);c—內標離子對(internal standard ion pair).
2.5 方法的精密度與準確度
稱取5.00 g陰性白蝦和草魚樣品,添加0.50,2.00和10.0 μg·kg-13種紅霉素加標濃度,每個加標濃度重復測定6次,計算對應的精密度和準確率,結果如表2所示.紅霉素的平均回收率為87.6%~96.1%;相對標準偏差為2.2%~5.3%;符合紅霉素殘留檢測的要求.
2.6 樣品分析
為了驗證方法的實用性和適用性,對市售20份水產品進行檢測分析,被測樣品中紅霉素的濃度均低于0.1 μg·kg-1.表明此批次抽檢樣品均未有紅霉素檢出,紅霉素濫用、亂用的情況在水產品行業中得到了有效的控制.
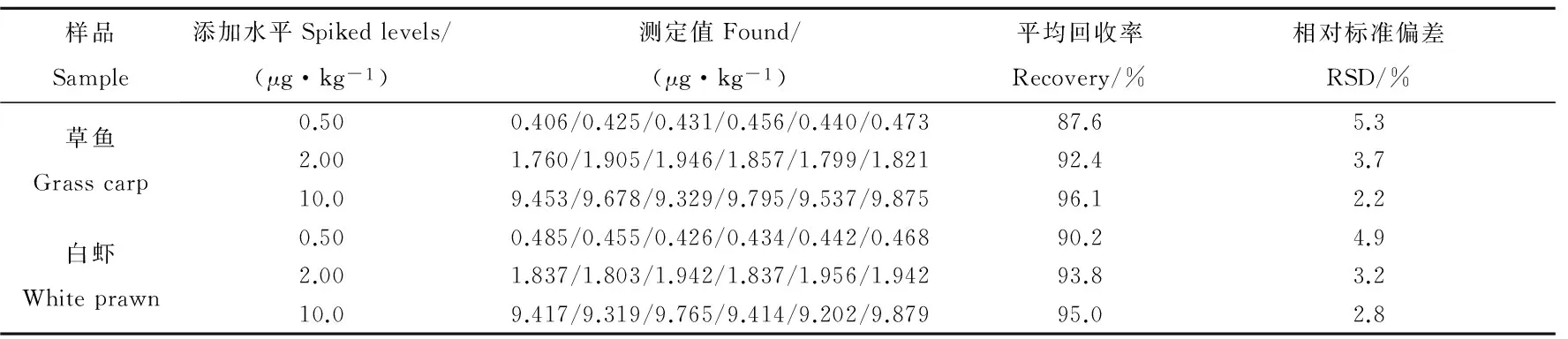
表2 紅霉素在陰性樣品中的加標回收率和相對標準偏差(n=6)
3 結 論
實驗建立了QuEChERS凈化-超高效液相色譜串聯質譜測定水產品中紅霉素殘留的分析方法.以乙腈為提取劑,QuEChERS法凈化,結合超高效液相色譜串聯質譜定量分析水產品中的紅霉素殘留,重復性好,回收率高,簡便高效,能夠滿足紅霉素檢測分析的要求,具有實際應用價值,為保障水產品的質量安全提供了技術支撐.
[1] 于慧娟,蔡友瓊,惠蕓華,等.高效液相色譜-電噴霧串聯質譜法測定水產品中紅霉素的殘留[J].分析化學,2009,37(1):91-94. YU H J, CAI Y Q, HUI Y H, et al. Determination of erythromycin residue in fishery products by high performance liquid chromatography-electrospray ionization tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry,2009,37(1):91-94.
[2] 周玲,吳黎明,周金慧.高效液相色譜-串聯質譜檢測巢脾中紅霉素殘留[J].中國食品學報,2013,13(6):198-202. ZHOU L, WU L M, ZHOU J H. Determination of erythromycin residue in honeycomb by high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chinese Institute of Food Science and Technology,2013,13(6):198-202.
[3] Official Journal of the European Communities Commission Regulation(EC) NO.1181/2002[EB/OL][2002-06-01].http://ec.europa.eu/health/sites/health/files/files/mrl/regpdf/2002_07_01_1181_en.pdf.
[4] 韓南銀,周婷.蜂蜜中紅霉素殘留量的檢測[J].食品科學,2003,24(2):118-120. HAN N Y, ZHOU T. Determination of erythromycin residue in honey[J]. Food Science,2003,24(2):118-119.
[5] KAMAREI F, ATTAR H, NIKJAH S, et al. Determination of erythromycins in fermentation broth using liquid phase extraction with back extraction combined with high performance liquid chromatography[J]. Arabian Journal of Chemistry,2014,7(3):292-296.
[6] 周茜,陳滿堂,朱麗華,等.在線固相萃取結合高效液相色譜-電噴霧式檢測器測定雞糞中紅霉素殘留[J].分析化學,2014,42(12):1838-1841. ZHOU Q, CHEN M T, ZHU L H, et al. Determination of erythromycin in chicken manure by high performance liquid chromatography-corona-charged aerosol detection coupled with on-line solid phase extraction[J]. Chinese Journal of Analytical Chemistry,2014,42(12):1838-1841.
[7] PENDELA M, VAN DEN BOSSCHE L, HOOGMARTENS J, et al. Combination of a liquid chromatography-ultraviolet method with a non-volatile eluent, peak trapping and a liquid chromatography-mass spectrometry method with a volatile eluent to characterise erythromycin related substances[J]. Journal of Chromatography A,2008,1180(1/2):108-121.
[8] FERNANDES P J, BARROS N, CAMARA J S. A survey of the occurrence of ochratoxin A in Madeira wines based on a modified QuEChERS extraction procedure combined with liquid chromatography-triple quadrupole tandem mass spectrometry[J]. Food Research International,2013,54(1):293-301.
[9] FASANO E, CIRILLO T, ESPOSITO F, et al. Migration of monomers and plasticizers from packed foods and heated microwave foods using QuEChERS sample preparation and gas chromatography/mass spectrometry[J]. LWT-Food Science and Technology,2015,64(2):1015-1021.
[10] 劉玉,張同來,楊利,等.QuEChERS-超高效液相色譜串聯質譜法測定土壤中三硝基酚類物質[J].分析化學,2014,42(8):1183-1188. LIU Y, ZHANG T L, YANG L, et al. QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry for determination of 2,4,6-trinitrophenol, 2,4,6-trinitroresorcinate and 2,4,6-trinitrophloroglucinol in soil [J]. Chinese Journal of Analytical Chemistry,2014,42(8):1183-1188.
QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry for the determination of erythromycin in fishy products.
YAN Zhongyong1,2, ZHANG Xiaojun1,2, LI Peipei1,2, FANG Yi1,2, YU Liang1,2, ZHANG Shuai1,2, ZHU Yin1,2, LI Qiang3
(1.MarineFisheriesResearchInstituteofZhejiang,Zhoushan316021,ZhejiangProvince,China; 2.KeyLabofSustainableUtilizationofTechnologyResearchforFisheryResourceofZhejiang,Zhoushan316021,ZhejiangProvince,China; 3.ChineseAcademyofFisherySciences,Beijing100141,China)
Journal of Zhejiang University(Science Edition), 2017,44(3):339-344
A method has been developed for the determination of erythromycin in fishery products by ultra performance liquid chromatography-tandem mass spectrometry. The samples were pretreated using the modified QuEChERS (Quick, Easy, Cheap, Effective, Rugged, Safe) method that completed the extraction and clean-up steps in one procedure. The samples were extracted with acetonitrile, dehydrated with sodium chloride and anhydrous magnesium sulfate, and cleaned up by dispersive solid phase extraction on primary secondary amine, and then were detected by HPLC-MS/MS. The chromatographic separation was performed on an ACQUITY UPLC BEH C18column by gradient elution using methanol and 0.1% formic acid solution as mobile phase. Internal standard method was used for quantification, and the positive electrospray ionization source was applied under the multiple reaction monitoring mode. Linear ranges of erythromycin was in the range of 0.5 to 50.0 μg·L-1with correlation coefficient of 0.997 6. The quantification limit of the method was 0.3 μg·kg-1. The recoveries of erythromycin were from 87.6% to 96.1%, and the relative standard deviation was from 2.2% to 5.3%. The method was simple, fast and sensitive for the analysis of erythromycin in fishy products.
QuEChERS; high performance liquid chromatography-tandem mass spectrometry; fishy products; erythromycin

2016-01-29.
公益性行業(農業)科研專項(201503108);浙江省公益性技術研究項目(2014C32087).
嚴忠雍(1990-),ORCID:http://orcid.org/0000-0002-3147-3738,男,學士,主要從事水產品質量安全與漁業環境監測.
*通信作者,ORCID:http://orcid.org/0000-0001-8807-5450,E-mail: xiaojun3627@163.com.
10.3785/j.issn.1008-9497.2017.03.015
O 657.6;P 76
A
1008-9497(2017)03-339-06

