對完善藥品生產企業數據完整性的思考
馮 功,梁 毅(中國藥科大學國際醫藥商學院,南京 211100)
對完善藥品生產企業數據完整性的思考
馮 功*,梁 毅#(中國藥科大學國際醫藥商學院,南京 211100)
目的:為藥品生產企業數據完整性管理體系的完善提供參考。方法:根據美國FDA與國家食品藥品監督管理總局的相關報道,分析數據完整性問題來源,歸納數據完整性問題的原因并提出解決措施。結果與結論:企業出現數據完整性問題的原因可歸結于員工、硬件/軟件系統和質量管理體系三方面,各方面與現行標準存在較大差距。建議企業采取差距分析的方法評估現有體系,組建數據完整性管理項目團隊并加強人員培訓,升級硬件/軟件系統保證其安全性、穩定性和有效性,通過建立良好文件規范、數據完整性專項監管體系來優化質量管理體系;此外,企業應建立質量文化、實時關注行業與法規動態,以有效保證數據的完整性。
藥品生產企業;數據完整性;員工;硬件;軟件;質量管理體系
#通信作者:教授,博士。研究方向:藥品質量管理與國內外注冊。E-mail:3083318949@qq.com
數據完整性是藥品生產企業質量體系的關鍵要素和基本要求。隨著計算機化系統在藥品生產、檢驗、倉儲、流通等各個環節的廣泛應用[1],數據記錄形式從紙質記錄轉化為電子記錄。雖然電子記錄有成本高、技術難度大等風險,但是其處理數據量大,保存和檢索方便,能將各部門、各工序之間,以及產品生命周期內各階段的數據聯系起來形成信息流,從而更好地發掘數據價值。此外,紙質記錄的造假成本和技術難度相對較低,檢查時難以發現,而電子記錄則更容易發現隱藏在數據背后的造假行為[2]。
目前,FDA開始加大對中國藥品生產企業的檢查力度,國內很多企業收到有關數據完整性問題的警告信,企業面臨懲罰和巨大損失[3]。針對頻繁出現的數據完整性問題,英國、美國、中國以及世界衛生組織(WHO)、國際藥品認證合作組織(Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme,PIC/S)制定了相關的指南[4]。在本研究中,筆者整理匯總了FDA、國家食品藥品監督管理總局(CFDA)報道的與數據完整性相關的問題,分析歸納其出現的原因,并依據法規指南的要求提出對策建議。
1 數據完整性概述
1.1 數據完整性概念
2015年3月,英國藥品與保健品管理局(Medicines and Healthcare ProductsRegulatory Agency,MHRA)發布的《關于藥品生產質量管理規范(GMP)數據完整性的行業指南》中首次給出數據完整性的定義,即所有數據在整個數據生命周期中的全面性、一致性和準確性的程度[5]。
數據生命周期是數據(包括原始數據)自初始產生和記錄,到處理(包括轉化或移植)、使用、保留、存檔/恢復和銷毀的整個生命階段。原始數據是指初始記錄和文檔,以初始生成的格式(電子或紙質形式)或以正確的副本進行保留。數據包含元數據才是有意義的記錄,否則將變成無意義的數字。元數據是描述其他數據的特性,并提供背景信息和含義的數據,比如數據的單位,數據的記錄日期以及記錄人等[5]。
根據藥品生產企業的實際情況,數據可以劃分為文件、記錄和報告[6]。文件是藥品企業內的管理文件和指令文件,如標準操作規程、驗證方案等;記錄是在實際的生產檢測管理活動中產生的數據,如生產記錄、包裝記錄等;報告是對數據進行分析得出的結論性文件,如驗證報告、年度回顧分析報告等。文件、記錄、報告均可以紙質記錄和電子記錄的形式表現。
1.2 數據完整性基本原則
雖然數據有不同分類,但在監管上的基本要求是一致的,需要滿足數據ALCOA原則:A(Attributable)——可追溯,可追蹤至產生數據的人、可追溯至數據源本身;L(Legible)——清晰,在數據的整個生命周期內均可以獲得,必要時能永久保存,可以在記錄保留期內任何時間點再現GMP步驟或活動的排序;C(Contemporaneous)——同步,應在活動發生時予以記錄;O(Original)——原始(或真實復制),記錄須是首次采集;A(Accurate)——準確,數據正確真實、有效可靠[5]。
1.3 數據完整性相關法規
在有關監管部門頒布GMP時,就已經明確了GMP最基本的原則:有章可循、照章辦事、有據可查。因此,數據完整性并非法規對藥品生產企業的新要求。歐盟、美國、中國等均在GMP中對藥品生產的數據管理提出了基本要求,同時還頒布了相關法規、指南等,用以具體詳解數據管理規定。
2003年8月,FDA頒布《電子記錄和電子簽名》,對電子記錄和電子簽名的管理和適用范圍作出詳細要求;2016年4月出臺的《數據完整性及其現行藥品生產管理規范符合性行業指南》對企業需要解決的數據完整性問題提出了相應建議,如控制空白表格和審計追蹤審核的周期以及負責人等[7];2015年3月,MHRA發布《關于GMP數據完整性的行業指南》,提出在建立數據關鍵程度和內在完整性風險的基礎上,系統化設計以保證數據完整性的理念。藥品生產企業在數據完整性管理投入的資源應與風險相對應,不是刻板地進行常規的數據核對,而是要設計并合理運行管理體系,降低數據完整性的風險[4]。
2015年9月,WHO頒布《數據與記錄管理規范指南》(Guidance on Good Data and Record Management Dractices)草案,對數據管理提出了建議:采用風險管理方式,對企業管理方針、供應商管理、數據與記錄培訓、文件管理規范等方面進行完善,從而完善管理系統以保證數據完整性[8]。2016年8月,PIC/S出臺《GMP和良好文件規范環境中數據管理和數據完整性良好規范》,該規范介紹了風險管理在數據完整性管理中的應用,并提出在質量文化、質量管理體系和計算機化系統等方面的數據完整性管理的要求[9]。
2016年7月,我國出臺了《藥品數據管理規范》(征求意見稿),介紹了數據管理相關的基本概念,并對企業在人員、質量體系、計算機化系統等方面的數據管理提出了基本要求[10]。
2 數據完整性問題
筆者通過對FDA警告信和CFDA飛行檢查中發現的問題進行總結,分析問題出現后缺失的數據屬性,并將問題產生的原因按照員工、硬件/軟件、質量管理體系三方面進行分類,發現問題根源并制訂相關應對措施,以幫助企業完善數據完整性管理。
2.1 員工方面
從物料采購到成品發貨,一系列活動都有員工參與,第一線的員工是數據收集者,是數據完整性的保障。由員工導致的數據完整性問題見表1[11]。

表1 員工導致的數據完整性問題Tab 1 Data integrity problem s caused by the staff
2.2 硬件/軟件系統方面
數據記錄形式的發展趨勢是電子記錄,在藥品生產企業中推廣計算機化系統管理,不是簡單的按照供應商的標準去核查系統,而是按照嚴格的驗證流程對系統的功能進行驗證,確認計算機化系統可以保證數據的完整性。在硬件/軟件系統中常見數據完整性問題見表2[11]。
2.3 質量管理體系方面
藥品生產企業需要嚴格按照GMP管理要求,對生產、檢測、文件、設備等各方面產生的記錄進行管理,否則無法保證數據的完整性。質量管理體系中常見的數據完整性問題見表3[11](手動積分指數據用戶在使用色譜軟件時,手動設置基線對峰高或峰面積進行積分數據處理的行為)。

表2 硬件/軟件系統中的數據完整性問題Tab 2 Data integrity problem s in hardware/software system

表3 質量管理體系中的數據完整性問題Tab 3 Data integrity problem s in quality managementsystem
3 解決措施
數據完整性管理體系的建立需要與GMP質量管理系統相結合,且數據管理的精力和資源應與產品的風險等級相適應[3]。筆者從人員、軟件/硬件系統、質量管理體系、企業文化等方面提出解決數據完整性問題的措施。
3.1 人員的配備與培訓
首先,藥品生產企業需要認識數據完整性的重要性,并組建數據完整性管理項目團隊。根據行業動態和企業硬件及系統的實際情況,項目團隊設計優化數據完整性管理體系,負責數據完整性承諾目標的實施,并負責定期回顧數據完整性、改進計劃進度等工作。
其次,對藥品生產企業人員進行數據完整性培訓并確保可按照規范進行操作。數據完整性管理項目團隊應確保藥品生產企業人員通過培訓后,能夠理解并區分正確的和不正確的行為、蓄意偽造數據及潛在后果。此外,關鍵人員(包括各部門管理者和質量部門員工)應接受如何預防和發現數據問題的培訓,如查看用于數據生成、處理和報告的個人計算機化系統的審計追蹤。藥品生產企業質量管理部門還須具備識別數據變更,以及如何進行數據完整性調查的能力[8]。
3.2 硬件/軟件系統配置與驗證
在數據完整性存在問題時,有些情況無法通過完善的質量管理體系來保證數據完整性(如計算機化系統可以修改系統時間,原始數據可以隨意刪除),這時就需要通過升級硬件/軟件系統來保證數據的完整性。
藥品生產企業根據實際情況對硬件/軟件系統進行升級,升級的計算機化系統需要進行驗證。計算機系統將人員的活動限制在較低的水平,為了確保數據完整性,需對系統的安全性、穩定性和有效性進行驗證,即對安全啟停、輸入邊界(收集信息的對象或范圍)、控制和操作功能、報警和聯鎖功能(由多部分組成的儀器,當其中一部分儀器啟動或停機后,計算機系統會控制其他部分啟動或停機)、儀表校準、各種操作和維護標準操作規程、斷電恢復、用戶功能權限、審計追蹤、報告打印、數據存儲/備份/檢索/恢復等功能進行確認[12]。
3.3 質量管理體系建設
3.3.1 建立良好文件規范 藥品生產企業應對現有文件規范進行風險評估,并與相關法規進行對比,進行差距分析找出主要缺陷,參照相關法規和指南,結合實際情況進行完善,建立良好的文件規范。
3.3.2 建立數據完整性專項監管體系 在質量管理體系中應增加數據完整性專項審計。數據完整性專項審計有外審和內審兩種方法,兩者結合可更好地實現對數據完整性的監管。內審需要藥品生產企業建立數據完整性專項審計體系,通過風險評估的方法對數據完整性問題進行分類,決定哪些問題是需要立即關注并整改的,哪些是可以次要關注的。藥品生產企業的質量管理部門定期評估審計報告,從而驗證建立監管體系的有效性,并不斷優化數據質量管理體系。外審需要藥品生產企業根據內部的實際情況,定期聘請外部機構進行審計,發現問題并進行整改。
質量管理體系完善流程見圖1[13]。
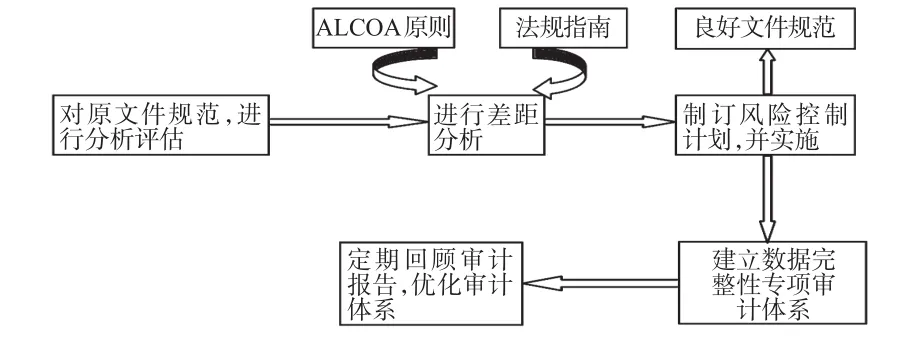
圖1 質量管理體系建設流程Fig 1 Construction process of quality m anagem ent system
此外,數據完整性問題涉及企業管理戰略與理念,藥品生產企業需要營造質量文化環境,以建立不合規記錄、錯誤記錄和數據風險最小化的工作環境,使這一理念在企業內部得到重視,尤其要加強企業關鍵人員的數據完整性意識。藥品生產企業應鼓勵報告問題,重視解決問題,尊重科學,建立意見反饋機制,鼓勵勇于承擔問題的責任并致力于解決問題。
藥品生產企業在質量文化理念建立的同時,應實時關注行業法規的動態。監管部門會逐漸完善數據完整性法規管理,藥品生產企業需要時時關注并掌握數據完整性監管的方向,根據政策要求及時發現體系問題,并加以改進。
4 結語
數據完整性是藥品質量體系的基本要求之一,數據完整性問題不是企業某個系統、某一個過程的問題,而是涉及到整個體系、企業全部人員以及企業管理的問題。在基于風險的基礎上合理分配資源,培訓員工養成良好習慣,升級軟件/硬件系統并經過驗證、建立良好文件規范和數據完整性專項審計;同時,企業需要從上而下樹立意識、營造質量文化氛圍,以切實保證數據的完整性。
[1] 梁毅,焦蒙.試論《良好自動化生產實踐指南(第5版)》指導下藥品生產與流通企業計算機化系統的驗證[J].中國藥房,2015,26(13):1736-1739.
[2] 王劍,張怡,丁藝釗.制藥行業實驗室GxP電子數據規范化管理[J].中國科技信息,2014(21):119-120.
[3] 董笑非.數據完整性:是痛點也是轉折點[N].中國醫藥報,2016-02-02(007).
[4] 柯爭先.數據和記錄管理終現行業標桿指南[N].中國醫藥報,2015-11-04(004).
[5]Medicines&Healthcare Products Regulatory Agency.GMP data integrity definitions and guidance for industrymarch 2015[EB/OL].[2016-06-13].https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/412735/ Data_integrity_definitions_and_guidance_v2.pdf.
[6] 劉禹.GMP環境下的記錄管理方法[J].醫藥工程設計,2012(3):22-27.
[7] FDA.Data integrity and compliance with cGMP guidance for industry[EB/OL].[2016-04].http://www.fda.gov/ downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm495891.pdf.
[8] WHO.Guidance on good data and recordmanagementpractices[EB/OL].[2016-09-24].http://www.who.int/medicines/publications/pharmprep/WHO_TRS_996_annex05. pdf.
[9] PIC/S.Good practices for datamanagementand integrity in regulated GMP/GDP environments[EB/OL].[2016-06-10].https://picscheme.org/en/publications?tri=all.
[10] 國家食品藥品監督管理總局.藥品數據管理規范:征求意見稿[EB/OL].[2016-10-10].http://www.sda.gov.cn/WS01/ CL0778/165110.htm l.
[11] FDA.Warning letters[EB/OL].[2016-06-20].http://www. fda.gov/ICECI/EnforcementActions/WarningLetters/default.htm.
[12] 秦垚,梁毅.基于GAMP5的我國制藥企業計算機化系統驗證的應用研究[J].機電信息,2016(17):1-11.
[13] FDA.Data integrity column in ISPE China[EB/OL]. [2016-06-30].https://www.ispe.org/china-affiliate/di-column.
(編輯:劉明偉)
Thoughts on Improving Data Integrity of Pharmaceutical Production Enterprises
FENG Gong,LIANG Yi(School of International Pharmaceutical Business,China Pharmaceutical University,Nanjing 211100,China)
OBJECTIVE:To provide reference for improving the data integrity management system of pharmaceutical production enterprises.METHODS:According to related reports in US Food and Drug Adm inistration(FDA)and China Food and Drug Administration(CFDA),the source of data integrity problems was analyzed,its reasons were summarized and solutions were put forward.RESULTS&CONCLUSIONS:The reasonswhy there were data integrity problems in enterprises can be attributed to 3 aspects(staff,hardware/software system and quality management),and the 3 aspects showed large gap w ith current standards.It is suggested that enterprises evaluate the existing system by adopting the gap analysis,establish a data integrity management project team,strengthen personnel training,upgrade hardware/software system to ensure its safety,stability and effectiveness;and optimize the quality management system by developing good ducument specification,special regulation system of data integrity.In addition,the enterprise should establish quality culture,pay attention to industry and regulatory trends in real time to guarantee the data integrity effectively.
Pharmaceutical production enterprise;Data integrity;Staff;Hardware;Software;Qualitymanagement system
R591
A
1001-0408(2017)13-1732-04
2016-08-23
2017-03-04)
DOI10.6039/j.issn.1001-0408.2017.13.02
*碩士研究生。研究方向:藥品質量管理與國內外注冊。E-mail:331598539@qq.com

