p28GANK在食管胃交界部癌中的表達研究
許洪寶 潘杰 汪偉民 蔡煒龍 韓春蕃
p28GANK在食管胃交界部癌中的表達研究
許洪寶 潘杰 汪偉民 蔡煒龍 韓春蕃
目的 探討p28GANK在食管胃交界部(EGJ)癌中表達的臨床意義。 方法 選取66例患者手術切除的EGJ癌及對應切緣癌旁組織標本,采用HE染色進行組織病理學觀察,免疫組化染色檢測p28GANK在EGJ癌及癌旁組織中的表達,對結果進行分析。 結果 鱗狀細胞癌、腺癌分別占19.7%(13/66)、80.3%(53/66);腫瘤組織侵犯淋巴管或血管的占28.2%(19/66);腫瘤淋巴結轉移的占45.5%(30/66)。p28GANK在鱗狀細胞癌與腺癌中的陽性表達率比較差異無統計學意義(P>0.05);p28GANK在EGJ癌組織中的陽性表達率明顯高于其在對應癌旁組織中的陽性表達率(P<0.05);p28GANK在EGJ癌中陽性表達與腫瘤淋巴結轉移及較晚的TNM分期有關(P<0.05)。 結論 p28GANK在EGJ癌中高表達,可能是EGJ癌重要的分子標志物。
食管胃交界癌 p28GANK 病理分析 臨床意義
食管胃交界部(esophagogastric junction,EGJ)癌為食管胃交界處黏膜發生癌變,有其獨特的生物學特點,與食管癌及胃癌不盡相同,其起源有可能是食管鱗狀上皮或胃腺上皮細胞。EGJ癌發病率逐年升高,雖然在全球范圍內有一定的報道[1],但其研究報道不多,尤其是其分子標志物研究報道較少,制約了EGJ癌臨床診治水平的提高。本研究分析EGJ癌的病理特征,并應用免疫組化染色方法研究消化道腫瘤惡性進展重要分子p28GANK[2]在EGJ癌中表達的臨床意義,現報道如下。
1 對象和方法
1.1 對象 選取2008年5月至2014年6月在本院普外科行手術切除治療的EGJ癌患者66例,年齡38~74(52.6±10.2)歲。患者術前均未接受任何抗腫瘤治療。其中42例患者因進食后有梗阻感首次就診,24例患者因劍突下或胸骨后疼痛、燒灼感等首次就診。患者術前均行胃鏡檢查,并取組織病理活檢確診EGJ癌后進行手術。手術切除標本經石蠟包埋后保存于本院病理科,對應的癌旁組織分別取自標本上切緣及下切緣。每例標本由病理科醫師閱片并記錄癌組織學類型、TNM分期、是否脈管侵犯及淋巴結轉移等病理資料。
1.2 HE染色及免疫組化染色 將癌組織進行切片,烘烤12h后待用。HE染色由本院病理科完成,免疫組化染色方法參考文獻[3]進行。切片經二甲苯(杭州永星五交化有限公司,貨號1330-20-7)脫蠟、濃度梯度乙醇水化后,再經檸檬酸緩沖液中煮沸抗原修復、正常山羊血清抗原封閉30min及3%H2O2去除內源性氧化酶活性后,在切片上滴加p28GANK抗體(美國Santa Cruz公司,1∶50),室溫下孵育3h后,PBS沖洗3次(每次5min)后,滴加山羊抗兔二抗(北京百奧萊博科技有限公司,貨號WK364,1∶1 000),室溫靜置40min后,PBS沖洗3次,DAB顯色(北京索萊寶科技有限公司)、蘇木精(美國Sigma公司)復染及封片。
1.3 評判標準 依據腫瘤中心部位將EGJ癌分為4型[4]:Ⅰ型為腫瘤中心位于EGJ以上5cm的食管鱗狀細胞癌;Ⅱ型為腫瘤中心位于EGJ以上5cm的食管腺癌;Ⅲ型為腫瘤中心位于EGJ以下5cm內累及EGJ;Ⅳ型為腫瘤中心位于EGJ以下5cm內未累及EGJ。免疫組化結果由2位病理科醫師閱片后按照以下標準評判結果:細胞染色呈黃色或棕黃色的為陽性細胞,將染色強度分為無、弱、中等、強4檔,分別計為0、1、2、3分;將陽性細胞比例按0%、1%~25%、26%~50%、51%~75%、76%~ 100%5檔分別計為0、1、2、3、4分;兩項得分之和<3分作為p28GANK免疫組化陰性,≥3分作為p28GANK免疫組化陽性。
1.4 統計學處理 應用SPSS 19.0統計軟件;計數資料以頻數和構成比表示,組間比較采用χ2檢驗。
2 結果
2.1 病理檢查結果 Ⅰ、Ⅱ、Ⅲ、Ⅳ型EGJ癌患者分別占19.7%(13/66)、31.8%(21/66)、48.5%(32/66)、0.00%(0/ 66);鱗狀細胞癌、腺癌患者分別占19.7%(13/66)、80.3%(53/66);28.2%(19/66)的患者腫瘤侵犯淋巴管或血管;TNM分期Ⅰ+Ⅱ期患者占30.3%(20/66),Ⅲ+Ⅳ期患者占69.7%(46/66);腫瘤淋巴結轉移患者占45.5%(30/66)。
2.2 p28GANK在EGJ癌與癌旁組織中的表達情況比較 p28GANK在EGJ癌組織中陰性、陽性表達率分別為21.2%(14/66)、78.8%(52/66);在上切緣癌旁組織中陰性、陽性表達率分別為93.9%(62/66)、6.1%(4/66),在下切切緣癌旁組織中陰性、陽性表達率分別為95.2%(63/66)、4.8%(3/66),無上、下切緣癌旁組織均陽性表達病例,即p28GANK在癌旁組織中陰性、陽性表達率分別為89.4%(59/66)、10.6%(7/66)。p28GANK在EGJ癌組織與癌旁組織中的陽性表達率比較差異有統計學意義(P<0.05)。
2.3 p28GANK在EGJ癌中的表達情況 p28GANK在EGJ癌中的免疫組化染色所見見圖1。
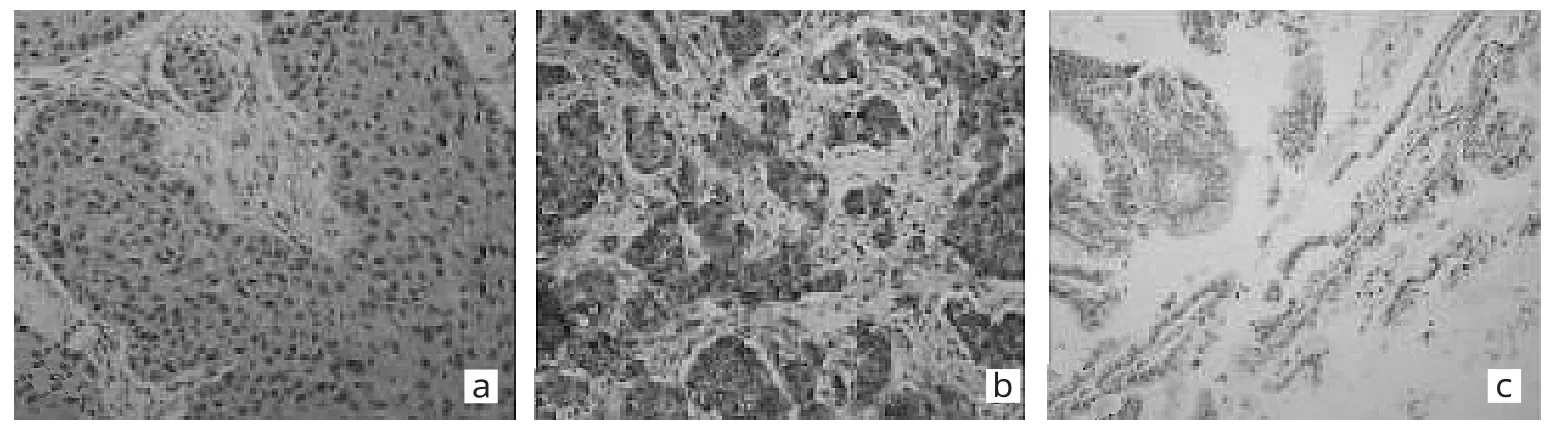
圖1 p 2 8 G A N K在E G J癌中的免疫組化染色所見(a:鱗狀細胞癌中陽性表達;b:腺癌中陽性表達;c腺癌中陰性表達;×2 0 0)
由圖1可見,p28GANK在鱗狀細胞癌、腺癌的細胞核與細胞質中呈陽性表達。p28GANK在鱗狀細胞癌中細胞核染色較強,其陰性、陽性表達率分別為23.1%(3/13)、76.9%(10/13);p28GANK在腺癌細胞質陽性染色強度大于細胞核,其陰性、陽性表達率分別為20.8%(11/53)、79.2%(42/53);p28GANK在鱗狀細胞癌與腺癌中的陽性表達率比較差異無統計學意義(P>0.05)。
2.4 p28GANK在EGJ癌中表達的臨床因素分析 見表1。
由表1可見,p28GANK在EGJ癌中的表達與患者性別、年齡、腫瘤分型、是否侵及脈管等臨床因素均無關(均P>0.05),與腫瘤淋巴結轉移、TNM分期均有關(均P<0.05),即p28GANK陽性表達與EGJ癌惡性進展程度密切相關。
3 討論
EGJ是位于胸腔和腹腔交界處的上消化道重要解剖部位,具有抗胃內容物反流等多種重要生理功能,為食管鱗狀上皮與胃柱狀上皮細胞交界的地方。此處發生癌變,有可能為鱗狀上皮起源,也可能為腺癌。隨著內鏡技術進步及普及,EGJ癌變率在歐美國家逐年升高[5],目前有關其上皮細胞組織起源、病理特點、生物學差別、分子生物學特點及臨床診治的報道越來越多,但仍缺乏有效的生物標志物。據報道,腫瘤惡性進展重要分子p28GANK在食管鱗狀上皮癌[3]、腸上皮起源的腺癌[6]等多種腫瘤中呈高表達,但其在EGJ癌中的表達及臨床意義研究報道少見。
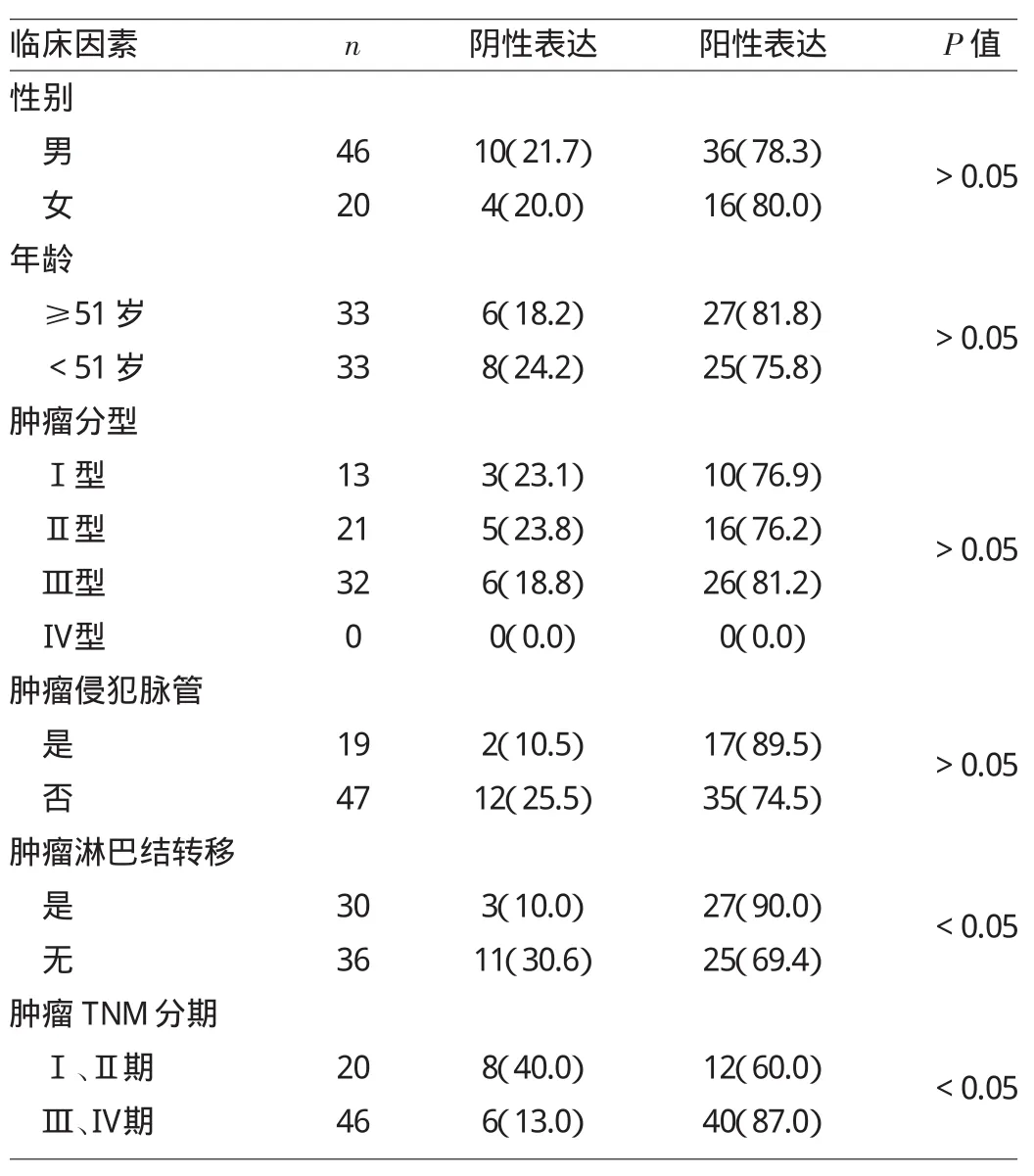
表1 p 2 8 G A N K在E G J癌中表達的臨床因素分析[例(%)]
本研究納入EGJ癌患者66例,主要以男性患者為主,可能與男性抽煙、飲酒等不良生活習慣有關,具體因素尚需進一步深入研究;病理分型上以腺癌為主,這些特點與文獻報道基本一致。這一現象可能是由于胃食管反流,長期的酸刺激誘導食管黏膜上皮向腸腺上皮化生,易發生食管腺癌變。但有報道EGJ癌病理分型還包括神經內分泌瘤和未分化癌等[7],本組患者中未見該類腫瘤。
本研究結果顯示,p28GANK表達于鱗狀細胞及腺細胞的細胞質與細胞核中,其在癌組織中的陽性表達率顯著高于對應的癌旁組織;進一步分析發現p28GANK陽性表達與較晚的腫瘤TNM分期及淋巴結轉移有關。這一結果與p28GANK在乳腺癌[8]、肝癌[9]等腫瘤中的表達情況相符,提示其為EGJ癌的重要標志物。近期的薈萃分析發現,p28GANK與腫瘤惡性進展密切相關,是較好的預后評估指標[10]。目前腫瘤生物靶向治療是研究的熱點,已經有多個分子靶向藥物應用于臨床,但尚未見針對p28GANK的生物靶向治療藥物。本研究進一步證實其在惡性腫瘤中高表達,可作為生物靶向治療的關鍵位點。p28GANK在EGJ癌中的表達與腫瘤的復發、轉移及患者預后是否有關,可作為今后研究的方向。
p28GANK作為一個消化道腫瘤中重要的分子標志物,可通過調節β-catenin/cyclinD1通路來促進結直腸癌的惡性增殖[6];也可與MDM2結合增強其活性,降解p53,使p53下游調控腫瘤相關基因轉錄活性改變[11];還可對抑癌基因pRb磷酸化,促進其核外排及降解[12],從而導致腫瘤惡性增殖。在肝癌中,p28GANK可通過Nrf2負反饋調節抗氧化作用,促進肝癌發生[13];在結腸癌中,其可激活TSC2來調節mTORC1信號轉導通路[14]。關于p28GANK的調控機制研究較少,目前只發現非編碼小RNA MiR-605可降解p28GANK,從而抑制膽管癌的惡性進展[15]。本研究結果進一步說明p28GANK對于消化道腫瘤生長、增殖、侵襲及轉移的重要性,但其調控EGJ癌惡性進展的信號轉導通路尚不清楚。
綜上所述,p28GANK在EGJ癌中高表達,可能是EGJ癌重要的分子標志物。由于本研究沒有納入神經內分泌瘤及未分化癌等其他病理類型EGJ癌,p28GANK在這些類型腫瘤中的表達及臨床意義還需大樣本深入研究。
[1]Huang L,Xu A,Peng Q.CD147 and MMP-9 expressions in type II/III adenocarcinoma of esophagogastric junction and their clinicopathological significances[J].Int J ClinExpPathol,2015,8(2): 1929-1937.
[2]Li J,Tian F,Li D,et al.MiR-605 represses PSMD10/Gankyrinand inhibits intrahepatic cholangiocarcinoma cellprogression[J].FEBS Lett,2014,588(18):3491-3500.
[3]Ortiz C M,Ito T,Tanaka E,et al.Gankyrinoncoprotein overexpression as a criticalfactor for tumor growth in human esophageal squamous cell carcinoma and its clinical significance[J].Int J Cancer,2008,122(2):325-332.
[4]Ito H,Inoue H,Odaka N,et al.Clinicopathological characteristicsand optimal management for esophagogastricjunctional cancer;a single center retrospective cohort study[J].J ExpClin Cancer Res,2013,32(1):2.
[5]Chung J W,Lee G H,Choi K S,et al.Unchanging trend of esophagogastric junction adenocarcinoma in Korea:experience at a single institution based on Siewert's classification[J].Dis Esophagus,2009,22(8):676-681.
[6]Tang S,Yang G,Meng Y,et al.Overexpression of a novel gene gankyrin correlates with the malignant phenotype of colorectal cancer[J].Cancer BiolTher,2010,9(2):88-95.
[7]何宏濤,楊杰,王占東.食管胃交界部癌527例臨床病理分析[J].診斷病理學雜志,2014,21(12):777-779.
[8]Zhen C,Chen L,Zhao Q,et al.Gankyrin promotes breast cancer cell metastasis by regulating Rac1 activity[J].Oncogene,2013,32(29):3452-3460.
[9]Fu J,Chen Y,Cao J,et al.Gankyrin overexpression accelerates hepatocellular carcinoma invasiveness and metastasis via phosphoinositol 3-kinase/AKT/hypoxia-inducible factor-1α pathways[J].Hepatology,2011,53(1):181-192.
[10]Zhao X,Liu F,Zhang Y,et al.Prognostic and clinicopathologicalsignificance of Gankyrin overexpression in cancers:evidence from a meta-analysis[J].Onco Targets Ther,2016,4(9): 1961-1968.
[11]Higashitsuji H,Itoh K,Sakurai T,et al.The oncoproteinGankyrin binds to MDM2/HDM2,enhancing ubiquitylation and degradation of p53[J].Cancer Cell,2005,8(1):75-87.
[12]Higashitsuji H,Itoh K,Nagao T,et al.Reduced stability of retinoblastoma protein by p28GANK,an oncogenic ankyrin-repeat protein overexpressed in hepatomas[J].Nat Med,2000,6 (1):96-99.
[13]Yang C,Tan YX,Yang G Z,et al.Gankyrin has an antioxidative role through the feedback regulation of Nrf2 in hepatocellular carcinoma[J].J Exp Med,2016,213(5):859-875.
[14]Qin X,Wang X,Liu F,et al.Gankyrin activates mTORC1 signaling by accelerating TSC2 degradation in colorectal cancer[J]. Cancer Lett,2016,376(1):83-94.
[15]Li J,Tian F,Li D,et al.MiR-605 represses PSMD10/Gankyrin and inhibits intrahepatic cholangiocarcinoma cell progression [J].FEBS Lett,2014,588(18):3491-3500.
Expression of p28GANK in gastroesophageal junction cancer and its clinicopathological significance
XU Hongbao,PAN Jie,WANG
Weimin,et al.Department of General Surgery,Huzhou Central Hospital,Huzhou 313000,China
Objective To investigate the expression of p28GANK in gastroesophageal junction(EGJ)cancer and its clinicopathological significance. Methods The expression of p28GANK was detected with immunohistochemical staining in 66 cases of EGJ cancer and corresponding normal tissue in the resection edge.The correlation of p28GANK expression with clinicopathological features was analyzed. Results Among 66 cases of EGJ cancer,13 were squamous cell carcinoma(19.7%) and 53 were denocarcinoma(80.3%).Postoperative pathology showed that 28.2%patients (19/66)had lymphatic or vascular invasion;and 45.5%(30/66)had lymph node metastasis.There was no difference in p28GANK expression between squamous cell carcinoma and adenocarcinoma (P>0.05).P28GANK expression was significantly stronger in cancer tissues than that in the corresponding non-cancerous tissue(P<0.05).The expression of p28GANK was correlated with lymph node metastasis and advanced TNM stage of EGJ cancer(P<0.05). Conclusion P28GANK expression is upregulated in gastroesophageal junction cancer,indicating that it might be used as a tumor molecular marker for EGJ cancer.
Gastroesophageal junction cancer P28GANK Pathology analysis Clinical significance
2 0 1 6-0 6-2 1)
(本文編輯:李媚)
10.12056/j.issn.1006- 2785.2017.39.8.2016- 511
313000湖州市中心醫院普外科
許洪寶,E- m ail:1457380065@ qq.com

