CHK1和RAD51蛋白在食管胃結合部腺癌組織中的表達及意義
衛茹,閆靜波
(1邢臺醫學高等專科學校,河北邢臺054000;2河北醫科大學附屬邢臺市人民醫院)
CHK1和RAD51蛋白在食管胃結合部腺癌組織中的表達及意義
衛茹1,閆靜波2
(1邢臺醫學高等專科學校,河北邢臺054000;2河北醫科大學附屬邢臺市人民醫院)
目的 探討細胞周期檢驗點激酶1(CHK1)和RAD51蛋白在食管胃結合部腺癌組織中的表達及意義。方法 選取食管胃結合部腺癌組織141例份(腺癌組)及距腫物≥5 cm的胃黏膜組織作為正常胃黏膜組;同期胃黏膜上皮內瘤變組織112例份,其中低級別上皮內瘤變44例(低級別瘤變組),高級別上皮內瘤變68例(高級別瘤變組)。用免疫組化法和Western blotting法檢測CHK1和RAD51蛋白在各組中的表達,并分析其與食管胃結合部腺癌患者臨床病理征特的關系。Spearman 法分析RAD51與CHK1蛋白表達的相關性。結果 CHK1和RAD51蛋白在正常胃黏膜組、低級別瘤變組、高級別瘤變組和腺癌組中表達依次升高(P均<0.05)。CHK1蛋白表達與食管胃結合部腺癌患者病理分化程度及lauren分型有關(P均<0.05);RAD51蛋白表達與患者病理分化程度、lauren分型及有無淋巴結轉移有關(P均<0.05);CHK1和RAD51蛋白表達呈正相關(r=0.342,P<0.05)。結論 CHK1和RAD51蛋白在食管胃結合部腺癌組織中呈高表達,二者在食管胃結合部腺癌發生發展和轉移中起協同作用。
食管胃結合部腺癌;上皮內瘤變;細胞周期檢驗點激酶蛋白;RAD51蛋白
食管胃結合部腺癌是腫瘤中心位于胃食管交界(EGJ)及上下各5 cm 范圍內的腺癌[1],在我國河北省南部發病率較高,發病率約49.71/10萬。細胞周期檢驗點激酶1(CHK1)是細胞檢驗點的轉導因子,在多種腫瘤細胞中呈高表達,與腫瘤發生發展、腫瘤耐藥性等密切相關[2]。DNA雙鏈斷裂修復蛋白RAD51是一種DNA雙鏈斷裂修復蛋白,能影響腫瘤發生發展,RAD51蛋白低表達,會造成胚胎死亡;RAD51蛋白適量表達,能修復自發性的DNA損傷;RAD51蛋白過量表達,能促進腫瘤的發生發展,增強腫瘤對放化療的耐受性[3]。2015年2月~2016年8月,我們采用免疫組化和Western blotting法檢測CHK1及RAD51蛋白在食管胃結合部腺癌組織中的表達,探討二者在食管胃結合部腺癌發生發展中的作用。
1 資料與方法
1.1 臨床資料 收集2005~2015年在河北醫科大學附屬邢臺市人民醫院病理科食管胃結合部腺癌組織標本,且經過1位病理副主任醫師診斷,1位病理主任醫師復診。食管胃結合部腺癌組織141例份(腺癌組),患者術前均無放化療,其中男93例、女48例,年齡<50歲56例,≥50歲85例。腫瘤最大直徑<4 cm 78例,≥4 cm 63例;組織學分化程度:高分化50例,中低分化91例;lauren分型:腸型85例,彌漫型56例;癌組織侵犯黏膜層或黏膜下層(早期胃癌)32例,侵及肌層或漿膜層(中晚期胃癌)109例;無淋巴結轉移81例,淋巴結轉移60例;Siewert Ⅰ型6例,Siewert Ⅱ型71例,Siewert Ⅲ型64例。取141例食管胃結合部腺癌患者距腫物≥5 cm的胃黏膜組織作為正常胃黏膜組。選取同期胃黏膜上皮內瘤變患者112例胃黏膜上皮內瘤變組織,患者男62例、女50例,年齡38~71歲,其中低級別上皮內瘤變44例(低級別瘤變組),高級別上皮內瘤變68例(高級別瘤變組)。以上四組標本分為兩份:1份經甲醛固定,做HE和免疫組化染色;另1份放入液氮凍存,做Western blotting免疫印跡檢測。
1.2 CHK1及RAD51蛋白表達檢測方法 ①免疫組化法:CHK1及RAD51染色采用En Vision TM二步免疫組化染色方法。CHK1及RAD51蛋白在胞漿和胞核表達。根據著色強度的分值:無著色、著淡黃色、著棕黃色、著棕褐色分別計為0、1、2、3分。根據陽性細胞占總細胞數百分比的分值:陽性細胞<10%、10%~24%、25%~49%、50%~74%、≥75%分別為0、1、2、3、4分。著色強度分值×陽性細胞百分數分值計為免疫組化總分值,0~1分為陰性(-),≥2分為陽性(+)。②Western blotting法:提取正常胃黏膜組、低級別瘤變組、高級別瘤變組和腺癌組蛋白,參照蛋白標準曲線測定蛋白含量,做SDS聚丙烯酰胺凝膠電泳,凝膠內的樣品蛋白轉移至硝酸纖維膜上,5% BSA常溫振蕩封閉1 h。一抗體(CHK1及RAD51抗體),4 ℃過夜,二抗,室溫1 h。然后加入堿性磷酸酶顯色劑顯色20 min。用掃描儀掃描NC膜上蛋白表達條帶的灰度,用自動圖像分析系統進行定量分析,正常胃黏膜組的平均光密度值(OD值)取值為1,其他各組與正常胃黏膜組相比取值。
2 結果
2.1 各組CHK1、RAD51蛋白表達比較 免疫組化檢測結果顯示,正常胃黏膜組、低級別瘤變組、高級別瘤變組和腺癌組CHK1蛋白陽性表達率分別為9.22%(13/142)、22.73%(10/44)、48.53%(33/68)、79.43%(112/141),RAD51蛋白陽性表達率分別為8.51%(12/142)、20.45%(9/44)、44.12%(30/68)、72.34%(102/141),四組間CHK1、RAD51蛋白陽性表達率比較,P均<0.05。
Western blotting法檢測結果顯示正常胃黏膜組、低級別瘤變組、高級別瘤變組和腺癌組CHK1蛋白相對表達量分別為1、2.40±0.11、5.39±0.37、9.01±1.52,RAD51蛋白相對表達量分別為1、2.29±0.08、4.97±0.24、8.13±1.03,四組間CHK1、RAD51蛋白表達比較,P均<0.05。
2.2 CHK1及RAD51蛋白表達與食管胃結合部腺癌患者臨床病理特征的關系 CHK1蛋白表達與食管胃結合部腺癌患者病理分化程度及lauren分型有關(P均<0.05)。RAD51蛋白表達與食管胃結合部腺癌患者病理分化程度、lauren分型及有無淋巴結轉移有關(P均<0.05)。見表1。
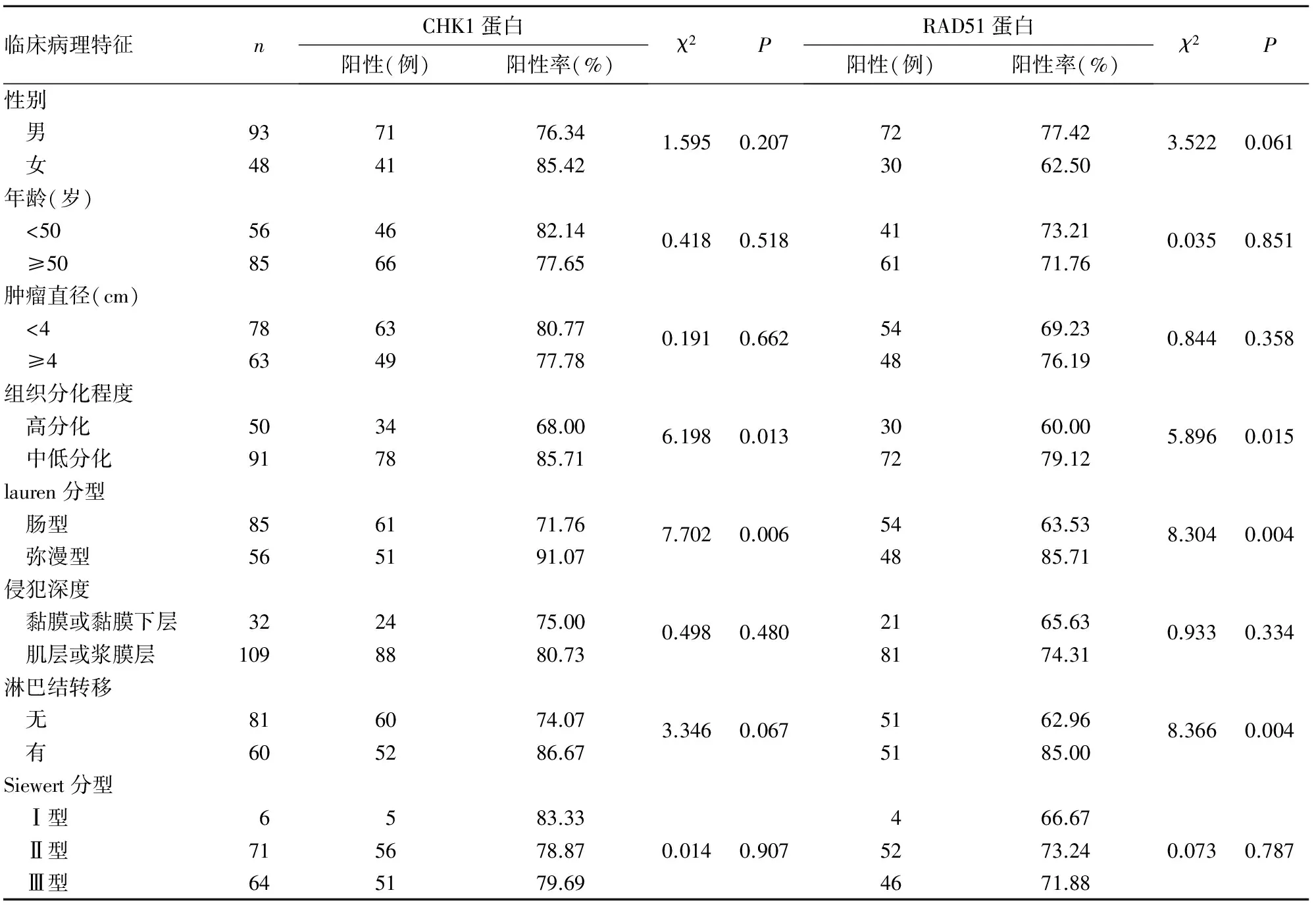
表1 CHK1、RAD51蛋白表達與食管胃結合部腺癌患者臨床病理特征的關系
2.3 RAD51與CHK1蛋白表達的相關性 食管胃結合部癌患者癌組織中CHK1與RAD51蛋白表達呈正相關(r=0.342,P<0.05)。
3 討論
近年來,食管胃結合部腺癌發病率持續升高,進展快,約80%的患者發現已進入晚期,5年生存率低于30%[4]。與胃竇癌相比,食管胃結合部腺癌較早深層胃壁浸潤、轉移[5,6]。食管胃結合部腺癌最常用的分型為Siewer分型[7]。SiewertⅠ型預后最好,SiewertⅡ型次之,SiewertⅢ型最差。在我國,SiewertⅠ型少見,而SiewertⅡ和Ⅲ型多見。肖文光等[8]研究顯示,我國的SiewertⅠ、Ⅱ、Ⅲ型分別為3.9%、53.1%和43.0%;楊宏等[9]研究顯示,我國的SiewertⅠ、Ⅱ、Ⅲ型分別為4.7%、50.3%和45.0%。本研究收集食管胃結合部腺癌標本141例,SiewertⅠ、Ⅱ、Ⅲ型所占比例分別為4.3%、50.3%、45.4%,與文獻報道基本一致。機體細胞周期的調控是復雜精密的程序,細胞周期檢測點蛋白質缺失會引起細胞周期紊亂,造成基因組不穩定,與腫瘤關系密切[10]。研究顯示,在多種腫瘤細胞中CHK1高表達,其在腫瘤發生發展、腫瘤耐藥性等方面發揮作用[2],CHK1異常表達會造成細胞周期檢測點對DNA損傷失去修復作用,增加機體腫瘤易感性,引起腫瘤發生。
RAD51蛋白是一種DNA雙鏈斷裂修復蛋白,在同源重組修復中起重要作用,參與DNA損傷感應和細胞周期關卡的復雜信號通路,通過同源重組修復,Rad 51蛋白可保護細胞免受DNA損傷[11]。然而,過多的RAD51蛋白又會過量引起姐妹染色體交換和同源重組,結果會引起遺傳的差異性和基因的不穩定性,造成腫瘤細胞過多增殖和不能分化成熟,引起腫瘤發生,并造成腫瘤細胞對放化療耐藥和預后不良[12]。Rad51蛋白的關鍵肽段發生突變,會引起該基因的失活,結果引起腫瘤形成。
本研究結果顯示,CHK1和RAD51蛋白在正常胃黏膜組、低級別瘤變組、高級別瘤變組和腺癌組表達逐漸升高;CHK1和RAD51蛋白在中低分化胃腺癌的表達強于高分化胃腺癌。說明CHK1和RAD51蛋白可能促進了食管胃結合部黏膜的癌變及其發生發展。在食管胃結合部腺癌的臨床病理因素中,CHK1蛋白表達與患者的病理分化程度和lauren分型有關,說明CHK1可能與食管胃結合部腺癌的惡性程度有關。隨著腫瘤的進展,惡性程度的增高,CHK1蛋白表達升高,提示CHK1蛋白可能促進了食管胃結合部腺癌的發生發展。lauren分型彌漫型胃腺癌CHK1蛋白表達高于腸型胃腺癌,彌漫型胃腺癌主要包括低分化腺癌及印戒細胞癌,惡性程度較高;腸型胃腺癌主要指高分化腺癌,惡性程度較低,提示CHK1蛋白在低分化食管胃結合部腺癌中表達高,CHK1蛋白可能促進了腫瘤的發生發展,CHK1蛋白升高,患者預后差。本研究結果還顯示,CHK1蛋白在有淋巴結轉移者中的表達高于無淋巴結轉移者,但差異無統計學意義。在食管胃結合部腺癌的臨床病理因素中,RAD51蛋白表達與食管胃結合部腺癌的病理分化程度、lauren分型及有無淋巴結轉移有關,說明RAD51可能是判斷腫瘤惡性程度高低及分級、分期的重要標志。隨著腫瘤進展,惡性程度增高,RAD51蛋白表達升高,提示RAD51蛋白可能促進了食管胃結合部腺癌的發生發展。RAD51蛋白在有淋巴結轉移者中的表達升高,提示RAD51蛋白可能促進了食管胃結合部腺癌的淋巴結轉移,RAD51蛋白表達可作為判斷食管胃結合部腺癌患者預后的參考指標。食管胃結合部癌組織中CHK1和RAD51蛋白表達正相關,說明二者在食管胃結合部腺癌發生發展中起協同作用。
綜上所述,食管胃結合部癌組織中CHK1和RAD51蛋白呈高表達,二者可能共同促進了食管胃結合部腺癌的發生發展。
[1] Hasegawa S, Yoshikawa T, Cho H, et al. Is Adenocarcinoma of the esophagogastric junction different between Japan and western countries?The incidence and clinicopathological features at a Japanese high-volume cancer center[J]. World J Surg, 2009,33(1):95-103.
[2]Russell MR, Levin K, Rader J, et al. Combination therapy targeting the Chk1 and Wee1 kinases shows therapeutic efficacy in neuroblastoma[J]. Cancer Res, 2013,73(2):776-784.
[3] Wang Z, Dong H, Fu Y, et al. RAD51 135G>C polymorphism contributes to breast cancer susceptibility:a meta-analysis involving 26,444 subjects[J]. Breast Cancer Res Treat, 2010,124(3):765-769.
[4] Siewert JR, Feith M, Stein HJ. Biologic and clinical variations of adenocarcinoma at the esophago-gastric junction:Relevance of a topographic-anatomic subclassification[J]. J Surg Oncol, 2005,90(3):139-146.
[5] Ohno S, Tomisaki S, Oiwa H, et al. Clinicopathologic characteristics and outcome of adenocarcinoma of the human gastric cardia in comparison with carcinoma of other regions of the stomach[J]. J Am Coll Surg, 1995,180(5):577-582.
[6] Saito H, Fukumoto Y, Osaki T, et al. Distinct recurrence pattern and outcome of adenocarcinoma of the gastric cardia in comparison with carcinoma of other regions of the stomach[J]. World J Surg, 2006,30(10):1864-1869.
[7] 薛英威,于雪峰.提高對食管胃結合部腫瘤的認識[J].中華胃腸外科雜志,2013,16(6):125-127.
[8] 肖文光,馬可,彭林,等.食管胃交界部腺癌淋巴結轉移特點及手術方式選擇[J].中華胃腸外科雜志,2012,15(9):897-900.
[9] 楊宏,武愛文,季加孚,等.食管胃結合部腺癌471例Siewert分型臨床研究[J].中國實用外科雜志,2012,32(4):310-315.
[10]Ahmed A, Yang J, Maya-Mendoza A, et al. Pharmacological activation of a novel p53-dependent S-phase chechpoint involving CHK-1[J]. Cell Dedth Dis, 2011,19(2):160.
[11] Schild D, Wiese C. Overexpression of RAD51 suppresses recombination defects:a possible mechanism to reverse genomic instability[J]. Nucleic Acids Res, 2010,38(4):1061-1070.
[12] Shi S, Qin L, Tian M, et al. The effect of RAD51 135 G>C and XRCC2 G>A (rs3218536) polymorphisms on ovarian cancer risk among Caucasians:a meta-anlysis[J]. Tumor Biology, 2014,3(4):1-8.
10.3969/j.issn.1002-266X.2017.09.020
R735.2
B
1002-266X(2017)09-0061-03
2016-12-07)

