阿司匹林對人宮頸癌Hela細胞BCL—6mRNA表達的影響
張潔+石小風+諶新興+賈靜
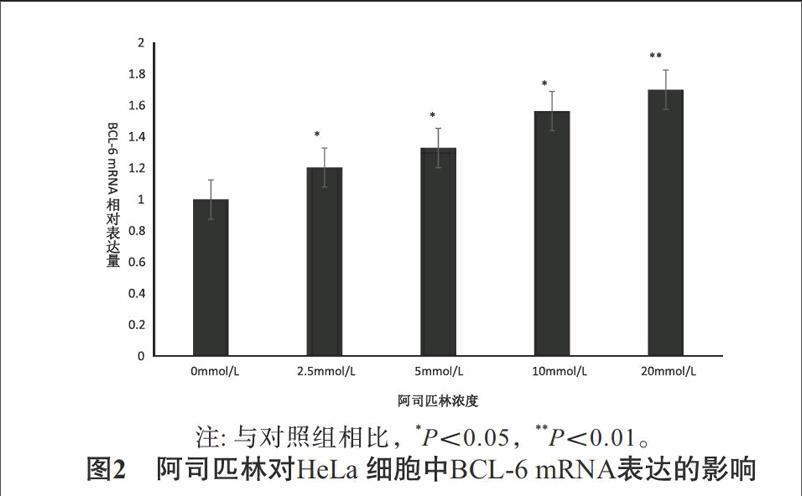
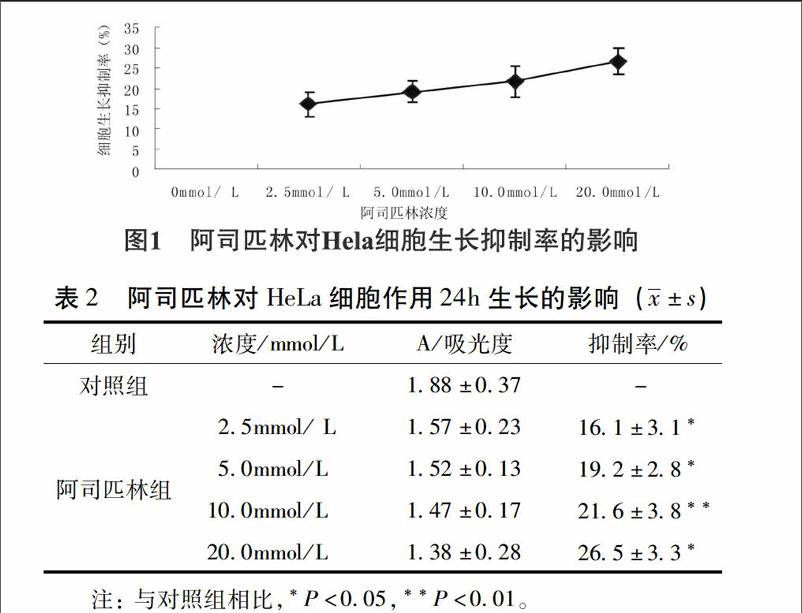
【摘要】目的:研究阿司匹林對人宮頸癌Hela細胞增殖及BCL-6 mRNA 表達量的影響。方法:不同劑量的阿司匹林干預人宮頸癌 Hela細胞24h后,用MTS法觀察其對人宮頸癌 Hela細胞增殖狀態的影響及采用逆轉錄-聚合酶鏈反應(qRT-PCR) 檢測阿司匹林作用后 Hela 細胞 BCL-6 mRNA 量的變化。結果:阿司匹林能抑制Hela細胞增殖及促進細胞中 BCL-6 mRNA 的表達,且促進強度隨阿司匹林的濃度的增加而增加。結論:阿司匹林能夠抑制人宮頸癌Hela細胞的生長,并從 mRNA 水平促進 BCL-6 蛋白的表達。
【關鍵詞】 阿司匹林;人宮頸癌 Hela 細胞;BCL-6
【中圖分類號】R73-36+1【文獻標志碼】 A【文章編號】1007-8517(2017)05-0049-03
阿司匹林屬于非甾體抗炎藥的代表藥,是臨床上常用的解熱鎮痛藥。研究發現長期低劑量服用阿司匹林具有預防腫瘤的作用[1],對腸癌細胞系、乳腺癌、胰島瘤NIT-1細胞、宮頸癌Hela細胞等均有抑制作用[2-4]。宮頸癌是最常見的婦科惡性腫瘤之一,其全球發病率位居女性惡性腫瘤中第2位[5]。其發病是一個多因素、多步驟級連的過程[6],發病機制尚未完全闡明。BCL-6基因(B cell lymphoma 6,簡稱 BCL-6)是Ye等[7]在 1993年研究非霍奇金淋巴瘤免疫基因圖譜時發現的一種原癌基因。在生理條件下,BCL-6 主要表達于生發中心 B 細胞和 CD4T 細胞,調節B細胞活化及分化相關基因如 blimp-1、CD4等[8]、細胞周期調控基因如p27kip1、cyclinD2、炎癥有關的趨化因子基因如MIP-1a 和 IP-10[9]的表達。大量研究發現[10-12]發現BCL-6 在多種腫瘤中表達量增加,并且與腫瘤的增殖、侵襲和遷移密切相關。由于BCL-6與腫瘤密切相關,所以我們推測阿司匹林可能通過促進BCL-6的轉錄表達來抑制宮頸癌Hela細胞的增殖。本研究通過觀察阿司匹林對人宮頸癌 Hela 細胞 BCL-6 mRNA 表達的影響來探究宮頸癌的發病機制。
1儀器與材料
11細胞人宮頸癌 Hela 細胞株,購于武漢博士德生物工程有限公司。
12試劑和藥品RPMI-1640培養基(Gibco公司);青霉素-鏈霉素混合溶液(100×雙抗,Gibco公司);胎牛血清 (FBS,Gibco公司);二甲基亞砜 (DMSO,Sigma公司); 0 02% EDTA/0 25% 胰蛋白酶(Gibco公司);Trizol (Invitrogen公司);CellTiter 96 AQueous One Solution Cell Proliferation Assay(promega公司);GoTaq 2-Step RT-qPCR System (Promaga公司);其它試劑均為國產分析純。
13儀器二氧化碳培養箱(美國thermo公司);BX51倒置顯微鏡(日本奧林巴斯公司); NanoDrop 2000超微量分光光度計(美國賽默飛世爾科技公司);T100 Thermal Cycler PCR儀(美國Bio-Rad公司);Eco熒光定量PCR系統(美國Illumina公司)。
14藥物Aspirin(貨號:A2093,SIGMA公司)。
2方法
21阿司匹林溶液的配制與人宮頸癌 Hela 細胞培養
211阿司匹林溶液的配制將40mL完全培養基放至 50mL的離心管中備用;再用電子天平準確稱取72064g的阿司匹林粉末(分子量為 18016),溶于準備好的 40mL完全血清培養基中,用震蕩混勻器充震蕩使其完全溶解,再將pH值調至 71~72,即得 1mol/L 的阿司匹林母液,隨后轉移至超凈臺用 022μm 的微孔過濾器過濾除菌,分裝至小離心管中,置于-20℃冰箱保存,使用時予完全培養基稀釋至不同濃度的阿司匹林25、50、100、200mmol/L。
212人宮頸癌 Hela 細胞培養人宮頸癌 Hela細胞于37℃、飽和濕度、 5% CO2條件下貼壁培養,經025%的胰蛋白酶常規消化后按一定量接種至RPMI-1640培養基(含10% FBS,1%雙抗)中吹散均勻,移入新細胞培養皿,于培養箱中繼續培養,每3~4d傳代1次,每日于倒置顯微鏡下觀察細胞生長狀況。
22MTS法檢測不同濃度阿司匹林對HeLa細胞的生長抑制率取處于對數生長期的人宮頸癌 Hela細胞經025%的胰蛋白酶常規消化后按按1×104個/孔接種于96孔板內,每孔200μL,接種完畢后,將板置于37℃,含5% CO2的培養箱中貼壁過夜,24h 后,更換培養基為無血清培養基培養24h 后開始進行分組加藥,空白組及對照組再分別加入200μL完全培養基,加藥組分別加入不同濃度阿司匹林的完全培養基各200μL,每組設5個復孔,加藥完畢繼續于培養箱中培養;培養24h后,將板取出,每孔加入40μL MTS溶液,繼續培養1~4h取出96孔板,用酶標儀測定490nm波長處的吸光度,實驗重復3次。計算細胞的生長抑制率=(1-實驗組OD值/對照組OD 值)×100%。
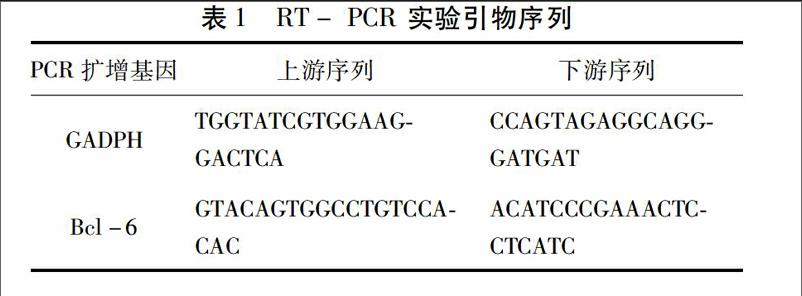
23qRT-PCR 檢測阿司匹林對HeLa細胞中BCL-6 mRNA表達的影響 取處于對數生長期的細胞如前常規消化后按1×106個/孔接種于6孔板內,每孔2mL,接種完畢后,將板置于37℃,含 5%CO2的培養箱中貼壁過夜。次日,分別加藥入不同濃度阿司匹林的完全培養基各2mL,對照組加入2mL完全培養基,加藥完畢繼續于培養箱中培養。取出細胞提取總RNA,NanoDrop 2000超微量分光光度計測定的RNA的濃度與純度。按GoTaq 2-Step RT-qPCR System說明書進行逆轉錄(反應體系20μL,逆轉錄反應條件:25℃×10min,42℃×60min,70℃×15min,4℃×5min)以及qPCR(反應體系20μL,反應條件:擴增反應條件:95℃×2min,95℃×15sec,60℃×60sec,總共45個循環),實驗重復3次。qPCR引物由北京市金瑞斯生物技術有限公司設計并合成,基因引物見表1。采用相對定量法(2-ΔΔCT法)計算目的mRNA相對表達量。
24統計學方法數據用 SPSS210統計軟件進行統計,采用均數加減標準差(x±s)表示,單因素方差分析,P<005表示差異有統計學意義。
3結果
31阿司匹林對HeLa細胞生長抑制率的影響MTS結果顯示,不同濃度的阿司匹林(25、50、100、200mmol/L)作用HeLa細胞24h后能抑制HeLa細胞的增殖,與對照組相比差異具有統計學意義(P<005),且呈劑量依賴性,即其抑制率隨濃度的增大而逐漸增加。見圖1、表2。
32阿司匹林對HeLa細胞中BCL-6 mRNA表達的影響qRT-PCR結果顯示,不同濃度的阿司匹林(0、25、50、100、200mmol/L)作用HeLa細胞24h后能促進HeLa 細胞中BCL-6 mRNA表達,與對照組相比差異具有統計學意義(P<005),且呈劑量依賴性,即其促進程度隨濃度的增大而逐漸增加。見圖2。
4討論
原癌基因BCL-6屬于抗細胞凋亡家族,編碼核轉錄抑制蛋白,在生發中心B細胞和具有生發中心B細胞表型的淋巴瘤中高表達。BCL-6的主要功能是轉錄抑制作用,受BCL-6調控的靶基因主要與細胞活化、分化和增生相關。研究發現BCL-6在多種腫瘤中有高表達,且與腫瘤的增殖、侵襲等密切相關[10-12]。BCL-6在彌漫性大B細胞淋巴瘤、濾泡性淋巴瘤、Burkitt淋巴瘤等淋巴瘤中顯著高表達,且已成為彌漫大B細胞淋巴瘤的診斷標志物之一[13-14]。
宮頸癌是發生在全球婦女中僅次于乳腺癌的第二常見的惡性腫瘤。我國宮頸癌發病率已高居世界第二位,僅次于智利,且發病年輕化趨勢明顯,因此研究宮頸癌的發病機制、治療、預防是一大熱點。目前認為宮頸癌的發病主要與HPV感染引起機體內源性因素產生影響,如相關癌基因激活、抑癌基因失活、端粒酶活性高表達和機體免疫調節機制失衡等一系列病理改變,引起細胞增殖與凋亡調節異常,導致組織癌變。阿司匹林是非甾體抗炎藥 (NSAIDs),可以通過抑制COX和NOS-2激活等途徑來預防和抑制腫瘤的作用[15]。實驗研究[16-18]也確實證明了阿司匹林能夠抑制宮頸癌細胞的增殖與凋亡,但具體機制不詳。
基于原癌基因BCL-6與宮頸癌發生發展的相關性,本項目組進行了此次實驗,實驗結果表明阿司匹林具有明確的抗宮頸癌的作用,并且該作用可能與其促進BCL-6的表達有關。其促進作用于阿司匹林的濃度呈正相關,但是阿司匹林是如何通過促進BCL-6表達來抑制宮頸癌的還需進一步的深入研究。
參考文獻
[1]Peter M Rothwell,F Gerald R Fowkes,Jill FF Belch,et al.Effect of daily aspirin on long-term risk of death due to cancer: analysis of individual patient data from randomised trials[J]. The Lancet,2011(59):31.
[2]Goel A,Chang KD,Ricciardiello L,et al.A novel mechanism for aspirin-mediated growth inhibition of human colon cancer cells[J]. Clinical Cancer Reaearch,2003(91):383.
[3]孫情,馮喬,熊毅,等.阿司匹林對胰島瘤細胞株NIT-1細胞增殖及NF-κB表達的影響[J]. 中國糖尿病雜志,2012(11):862.
[4]李盛,嚴浩,黃志琨.阿司匹林誘導人宮頸癌HeLa細胞凋亡及機制[J]. 中國醫院藥學雜志,2012(9):675.
[5]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2) : 69.
[6]曾康康,莫祥蘭,劉斐,等.宮頸癌及癌前病變阻滯中 microRNAs 的差異表達[J].腫瘤防治研究,2014,41(7) : 789.
[7]Ohtani M, Miyadai T. Functional analysis of fish BCL-6 and Blimp-1 in vitro: transcriptional repressorsfor B-cell terminal differentiation in fugu (Takifugu rubripes)[J]. Mol Immunol, 2011, 48(7): 818.
[8]Shaffer AL, Yu X, He Y, et al. BCL-6 represses genes that function in lymphocyte differentiation, inflammation, and cell cycle control[J]. Immunity, 2000, 13(2): 199–212.
[9]Salamon D, Adori M, He M, et al. Type I interferons directly down-regulate BCL-6 in primary and transformed germinal center B cells: differential regulation in B cell lines derived from endemic or sporadic Burkitt's lymphoma[J]. Cytokine, 2012, 57(3): 360-371.
[10]馮慧琳,譚明子,朱連成,等.BCL6與Lewis y在卵巢漿液性腫瘤中的表達及其臨床意義[J].現代腫瘤醫學,2016(13):2127-2132.
[11]劉雪,吳正升,吳強. 乳腺癌細胞中miR-339-5p對BCL-6表達的調節[J]. 臨床與實驗病理學,2013(3):244-246.
[12]朱琳,鄭胡鏞,劉瀟,等. BCL6、KLF5、NCL基因在兒童急性淋巴細胞白血病中異常表達的特點[J]. 中國腫瘤生物治療雜志,2011(4):362-367.
[13]Salamon D, Adori M, He M, et al. Type I interferons directly down-regulate BCL-6 in primary and transformed germinal center B cells: differential regulation in B cell lines derived from endemic or sporadic Burkitts lymphoma[J]. Cytokine, 2012, 57(3): 360.
[14]Cerchietti L C, Hatzi K, Caldas-Lopes E, et al. BCL6 repression of EP300 in human diffuse large B cell lymphoma cells provides a basis for rational combinatorial therapy[J]. J Clin Invest, 2010, 120(12):4569.
[15]Coyle C, Cafferty FH, Langley RE. Aspirin and Colorectal Cancer Prevention and Treatment: Is It for Everyone[J]. Curr Colorectal ancer Rep,2016(12):27.
[16]王蓓,王曉,李建立,等. 阿司匹林對宮頸癌Hela細胞的增殖抑制作用[J]. 中國老年學雜志,2013(9):2081.
[17]鄭秀娟,李淞漪. 阿司匹林對宮頸癌Hela細胞COX-2 mRNA表達的抑制作用[J]. 浙江臨床醫學,2007,11:1461.
[18]王蓓,邢邯英,李建立,等. 阿司匹林對宮頸癌Hela細胞凋亡及增殖的影響[J]. 中國老年學雜志,2014(9):2459.

