NADPH氧化酶NOX1、NOX2和DUOX2在潰瘍性結腸炎中的表達分析
軒青霞 戴發亮 陳 攀 馮丹丹 金建軍 高 強,2*
(1.河南科技大學臨床醫學院,河南科技大學第一附屬醫院消化內科,河南洛陽 471023; 2.首都醫科大學附屬北京康復醫院消化內科, 北京 100144)
·基礎研究 ·
NADPH氧化酶NOX1、NOX2和DUOX2在潰瘍性結腸炎中的表達分析
軒青霞1戴發亮1陳 攀1馮丹丹1金建軍1高 強1,2*
(1.河南科技大學臨床醫學院,河南科技大學第一附屬醫院消化內科,河南洛陽 471023; 2.首都醫科大學附屬北京康復醫院消化內科, 北京 100144)
目的 探討NADPH氧化酶家族(nicotinamide adenine dinucleotide phosphate oxidases, NOXs)的主要成員NOX1、NOX2和雙氧化物酶(dual oxidase, DUOX)2 (人:NOX1、NOX2和DUOX2;小鼠:Nox1、Nox2 和Duox2)在人炎癥性腸病和小鼠腸炎模型結腸中的表達。方法 人結腸標本選自于通過結腸鏡活檢或手術切除的炎癥性腸病組織及距離病變組織邊緣5 cm以上正常組織; 同時選用8~10周齡的C57BL/6雌性小鼠建立結腸炎模型,采用擲硬幣法將其隨機分為對照組和慢性腸炎組,慢性腸炎組先自由飲用1.0%(質量分數)葡聚糖硫酸鈉7 d,然后自由飲水14 d,循環3次;通過體質量變化和HE染色方法評估腸道炎性反應程度。采用實時定量PCR技術和免疫組織化學方法分別檢測結腸組織中NOX1、NOX2及DUOX2 mRNA和蛋白表達情況,并分析在人炎癥性腸病中三者表達情況與臨床特征之間的關系。結果 NOX1、NOX2和DUOX2 mRNA在人炎癥性腸病結腸組織中的表達量均顯著高于自身正常對照組織,分別增高2.8、2.0和3.3倍(P均<0.01);與人不同,Nox1和Duox2 mRNA在小鼠慢性腸炎結腸組織中的表達量差異無統計學意義,Nox2 mRNA增加2.4倍 (P<0.01)。Nox1蛋白在正常結腸上皮細胞刷狀緣和胞質中表達;Nox2蛋白主要表達于浸潤的吞噬細胞和中性粒細胞;Duox2蛋白在正常結腸黏膜組織中低表達;三者在人炎癥性腸病結腸組織中表達均上調(均P<0.01);在小鼠慢性腸炎模型中,Nox2和Duox2蛋白上調(均P<0.01),而Nox1無變化。除了NOX2 mRNA在男性病人表達高于女性病人外,未發現這些氧化酶與病人臨床特征之間有關聯。結論 NOX1、NOX2和DUOX2不但在維持機體正常生理功能過程中發揮重要作用,而且在炎癥性腸病初期階段的發病中也起一定的作用。
NADPH氧化酶;NOX1;NOX2;DUOX2;炎癥性腸病
炎癥性腸病 (inflammatory bowel disease, IBD) 是一種慢性非特異性腸道炎性反應性疾病,包括潰瘍性結腸炎 (ulcerative colitis, UC) 和克羅恩病 (Crohn’s disease, CD)。目前其發病機制及病因尚未明確,多認為是免疫、腸道菌群、遺傳和環境等多因素相互作用的結果[1]。在炎癥性腸病發生發展過程中,多種因素可導致易感個體腸道內環境破壞,引起腸道黏膜免疫功能失調,從而造成黏膜屏障的損傷[2]。氧化應激 (oxidative stress) 被認為是導致腸道損傷的關鍵因素[3-4]。氧化應激是指機體內活性氧類 (reactive oxygen species, ROS) 和活性氮類 (reactive nitrogen species, RNS) 產生過多,超出機體對氧化產物的清除能力,進而導致組織細胞損傷的病理生理過程[4]。NADPH氧化酶 (nicotinamide adenine dinucleotide phosphate oxidases, NOXs) 是腸道黏膜ROS的重要來源,正常生理情況下ROS在腸道抵御病原微生物中發揮重要作用[5-6]。作為NADPH氧化酶家族的成員,NOX1、NOX2和雙氧化物酶 (dual oxidase, DUOX)2(人:NOX1、NOX2和DUOX2;小鼠:Nox1、Nox2和Duox2)均能產生ROS,其中DUOX2可產生H2O2[7]。NOX1和 DUOX2在消化道黏膜上皮表達,而NOX2主要在巨噬細胞和中性粒細胞中表達[8]。研究[9]顯示NADPH氧化酶在IBD疾病發生和發展過程中發揮作用,但國內外研究有限。本研究通過檢測潰瘍性結腸炎病人結腸組織和與潰瘍性結腸炎相似的小鼠葡聚糖硫酸鈉 (dextran sulfate sodium,DSS) 慢性結腸炎模型結腸中NOX1、NOX2和DUOX2的表達情況,探討NADPH氧化酶NOX1、NOX2和DUOX2在IBD發生和發展中的作用,尤其是小鼠慢性結腸炎模型結腸中NADPH氧化酶的研究目前國內外尚未見報道。
1 材料與方法
1.1 材料
1.1.1 臨床資料
取自28例2013年11月至2015年11月在河南科技大學第一附屬醫院就診的復發的活動期潰瘍性結腸炎病人,其中,男性病人18例,女性病人10例,年齡16~76歲,平均年齡 (46.5±14.7) 歲;病變部位位于結腸12例,直腸16例;活檢伴不典型增生者21例,不伴不典型增生者7例。
1.1.2 實驗動物
選取健康清潔級8~10周齡(體質量20~23 g)C57BL/6雌性小鼠[購于北京維通利華公司,實驗動物許可證號:SYKK(豫)2016-0001],飼養于河南科技大學第一附屬醫院動物實驗中心,室內溫度保持 20 ℃~22 ℃,濕度50%左右,明暗交替周期12 h。各組小鼠均給予Co60輻照滅菌混合配方顆粒飼料(北京華阜康生物科技股份有限公司)飼養。
1.1.3 主要試劑
DSS(相對分子質量為36 000~50 000)購于美國MP Biomedicals公司。總RNA提取試劑TRIzol Reagent產于美國Invitrogen公司,反轉錄和實時定量PCR試劑盒購于日本Takara公司,引物由生工生物工程(上海)有限公司合成(表1)。免疫組織化學檢測用NOX1和Nox1一抗分別購于武漢博士德生物公司和英國Abcam公司;NOX2/Nox2一抗購于美國Santa Cruz 公司;DUOX2和Duox2一抗分別購于北京博奧森和美國Gene Tex公司;SABC免疫組織化學檢測試劑盒購于武漢博士德生物公司;濃縮型DAB顯色試劑盒購于北京索萊寶公司。

表1 引物序列
F:forward; R:reverse.
1.2 方法
1.2.1 臨床取材
搜集結腸鏡活檢或手術切除并經病理證實的病變結腸組織標本與距病變組織邊緣5 cm以上的正常組織,預冷的PBS清洗,一部分組織甲醛固定,石蠟包埋,4μm厚度切片,備免疫組織化學使用,剩余的樣本在-80 ℃儲存,行實時定量PCR測定。
1.2.2 動物實驗設計與取材
將小鼠以個體為單位采用擲硬幣的方法(正、反面分別代表實驗組和對照組)隨機分配到對照組和實驗組(DSS組),每組8只,適應性喂養1周,對照組自由飲水;慢性腸炎組先給予含1.0%(質量分數)DSS飲用水自由飲用7 d,然后給予飲用水自由飲用14 d,循環3次。于造模第9周末脫頸椎處死所有小鼠,剖腹取結腸,PBS漂洗,自遠端結腸始取約0.5 cm,甲醛液固定,經脫水后石蠟包埋,4μm厚度切片,備免疫組織化學及HE染色使用。再取1.0 cm加入RNA later液,4 ℃放置24 h后轉移至-80 ℃保存,行實時定量PCR。
1.2.3 實時定量PCR檢測人和小鼠NOX1、NOX2和DUOX2 mRNA表達水平
取200 mg結腸組織,放到無RNase的1.5 mL離心管中,采用Trizol法提取總RNA,用核酸定量儀測定RNA純度和濃度。取總RNA 2μg,按照反轉錄試劑盒說明書反轉錄合成cDNA,-20 ℃保存備用。冰上配制PCR反應液,反應體系25μL:SYBR Premix EX Taq Ⅱ (2×) 12.5μL,DEPC水8.5μL,cDNA 2μL,上下游引物各1μL,于BIO-RAD Real-time PCR儀中進行PCR反應,反應條件為: 95 ℃預變性30 s,95 ℃ 5 s、59 ℃ 30 s、95 ℃ 15 s,共40個循環。結果以閾循環 (Ct) 值表示,β-actin作為內參基因,每個樣本3個復孔,各樣本的待測基因擴增量與β-actin基因擴增量采用Log10 (2-ΔΔCt) 法分析mRNA相對表達量。平均Ct值超過35,視為該目標基因無表達。
1.2.4 免疫組織化學方法檢測人和小鼠NOX1、NOX2和DUOX2的蛋白表達
免疫組織化學染色NOX1、NOX2和DUOX2一抗工作濃度分別為1∶100、1∶200和1∶300; Nox1、Nox2和Duox2一抗工作濃度分別為1∶250、1∶200和1∶300,陰性對照組均使用PBS溶液代替一抗。在光學顯微鏡下進行細胞計數,每張切片隨機選擇10個視野,每個視野觀察100個細胞。染色細胞比率評分標準:<5%計0分,5%~25%計1分,26%~50%計2分,51%~75%計3分,76%~100%計4分;染色強度評分標準:細胞無染色計0分,淡黃色計1分,棕色計2分,棕褐色計3分,根據兩項評分乘積進行免疫組織化學染色評分。
1.3 統計學方法
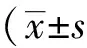
2 結果
2.1 人結腸組織中NOX1、NOX2和DUOX2 mRNA和蛋白的表達
與正常組織相比,NOX1、NOX2與DUOX2 mRNA在炎性反應組織的表達均顯著升高。炎癥性腸病組NOX1、NOX2與DUOX2 mRNA的表達量分別是正常組織中的2.8、2.0和3.3倍(P均<0.01)(圖1)。NOX1蛋白在正常結腸上皮細胞刷狀緣和胞質表達;NOX2蛋白主要表達于浸潤的吞噬細胞和中性粒細胞;DUOX2蛋白在正常結腸黏膜組織中低表達;這3種蛋白在炎癥性腸病結腸組織中的表達較正常對照組均顯著升高(P均<0.01),NOX2蛋白炎性反應區域可見炎性反應樣細胞呈陽性染色;NOX1和DUOX2在上皮細胞刷狀緣和胞質表達明顯增加(表2和圖2)。

圖1 炎癥性腸病結腸炎性反應組織與相應正常結腸組織中NOX1、NOX2和DUOX2 mRNA的比較
*P<0.01vsnormal;NADPH:nicotinamide adenine dinucleotide phosphate.
2.2 結腸炎性反應組織中NOX1、NOX2與DUOX2 mRNA和蛋白表達與臨床病理特征的關系
比較不同病人臨床病理特征與NOX1、NOX2及DUOX2 mRNA和蛋白表達量之間的關系,發現除結腸炎組織中NOX2 mRNA表達水平的升高與性別相關,男性病人NOX2 mRNA表達水平較女性高外 (P<0.05),而其他臨床特征如年齡、病程、病變部位以及吸煙飲酒史等與這3個基因的表達無相關性;發現NOX1、NOX2與DUOX2蛋白的表達與病人臨床病理特征之間沒有顯著的相關性。

表2 結腸組織中NOX1,NOX2和 DUOX2蛋白表達

圖2 結腸組織中NOX1、NOX2和DUOX2 蛋白的表達
In colitis tissue (B) NOX1 protein expression was significantly increased than normal tissue (A); NOX2 protein expression significantly increased in colitis tissue (D) than normal tissue (C), most expressed in the cytoplasm of inflammatory cell;DUOX2 protein had a little expression in brush border of epithelial cells of normal mucosa (E), the expression of DUOX2 was significantly increased in the cytoplasm of epithelial cells of colitis tissue (F).
2.3 動物實驗結果
2.3.1 小鼠一般情況和體質量變化
對照組小鼠攝食飲水正常,反應機警,生長發育良好,體質量增加;慢性腸炎組于第7 d開始飲用1.0%(質量分數)DSS,飲用6 d出現懶動,攝食飲水減少,體質量下降,稀便、肛周潮濕現象,部分小鼠出現肉眼血便,停止飲用1.0%(質量分數)DSS后的第4 d體質量開始回升,在第1個循環周期中平均體質量下降近10%,在第2、3循環中,上述癥狀反復出現,慢性腸炎組小鼠體質量自第2周起至造模結束均低于對照組 (P<0.05)(圖3)。造模結束時,兩組小鼠均無死亡。
2.3.2 組織病理學評分
對照組可見小鼠結腸黏膜腺體結構完整,無炎性反應表現;慢性腸炎組小鼠結腸黏膜呈慢性炎性反應改變,腺體結構不完整,隱窩結構遭到破壞,細胞結構排列紊亂,杯狀細胞減少或消失,局部伴有炎性反應細胞浸潤,并可見隱窩不規則增生;兩組相比炎性反應程度差異有統計學意義(P<0.01)(表3)。

圖3 兩組小鼠體質量變化
*P<0.05vscontrol.
2.3.3 小鼠結腸組織中Nox1、Nox2和Duox2 mRNA的表達
Nox1和Duox2 mRNA在對照組和慢性腸炎組結腸組織中沒有差別,而Nox2 mRNA在慢性腸炎組結腸組織的表達較對照組升高2.4倍 (P<0.01)(圖4)。
2.3.4 小鼠結腸組織中Nox1、Nox2和Duox2蛋白的表達
Nox1蛋白在正常結腸組織中表達,且主要表達在上皮細胞刷狀緣和胞質;Nox2蛋白主要表達在吞噬細胞和中性粒細胞胞質中;Duox2蛋白在正常的上皮細胞刷狀緣少量表達。Nox1蛋白在對照組和慢性腸炎組結腸組織中無差別,而Nox2和Duox2在慢性腸炎組結腸組織的表達較對照組均顯著升高 (P均<0.01)(表3和圖5)。

圖4 小鼠結腸組織中Nox1、Nox2和Duox2 mRNA表達
*P<0.05vscontrol;NADPH:nicotinamide adenine dinucleotide phosphate.
3 討論
IBD是西方國家的常見病,由于環境和飲食習慣的變化,我國IBD的總報道病例數量在近十余年內增加了2.5倍,尤其是CD增加了15.7倍[10-11]。NOX1、NOX2和DUOX2作為ROS的重要來源,正常情況下,NOX家族氧化酶產生的ROS參與維持細胞的正常生理活動,但當機體受到各種因素刺激時,引發NOX家族氧化酶過表達產生大量ROS,過多的ROS可激活核因子介導產生大量的細胞促炎因子,促進炎性反應[12]。但有關NOX1、NOX2和DUOX2在IBD疾病發生和發展過程中的研究仍有限。

表3 兩組小鼠組織病理學和免疫組化評分
HE staining showed that mucous membrane structure of control group was normal, the epithelial cells were unbroken (A); Mucous membrane structure of colitis group was broken, and has inflammatory cell infiltration (B); Immumohistochemical staining showed that Nox1 expression was undifferentiated between chronic colitis group (D) and control group (C); Nox2 expression in chronic colitis group (F) was significantly higher than control group (E); Duox2 expression in chronic colitis group (H) was also higher than control group (G).
本研究結果顯示,NOX1蛋白和mRNA在正常的結腸黏膜組織上皮細胞中表達,在炎性反應結腸組織中,NOX1表達明顯上調,提示NOX1除維持正常生理功能過程外,還在IBD病理過程中發揮重要作用,可能參與早期階段的炎癥性腸病的發生。生理狀態下NOX1源性ROS參與調節結腸上皮細胞生長和轉化,并維持杯狀細胞和吸收細胞功能的穩態[13]。當NOX1過度表達,增高的NOX1產生大量的ROS可以激活多種轉錄因子,活化的轉錄因子又能促進細胞因子類基因的轉錄,而細胞因子的轉錄又會進一步加劇炎性反應[14-15]。研究[16-18]表明Nox1參與細胞的增生、遷移和凋亡,并調控結腸上皮細胞的修復和宿主免疫防御功能,且與早期發生的炎癥性腸病有關。本研究中NOX1在人類炎癥性腸病的腸炎上皮細胞中表達,這與Szanto等[19]的研究結果一致;而慢性腸炎動物模型結果顯示,Nox1 mRNA和蛋白在慢性腸炎和對照組結腸組織中的表達差異無統計學意義,可能是由于Nox1主要在腸黏膜上皮表達,慢性炎性反應時腸黏膜上皮結構破壞嚴重,上皮細胞大量丟失所致。
本研究結果顯示NOX2 mRNA和蛋白在人和小鼠結腸黏膜炎性反應組織中的表達量較對照組明顯增高,這與炎性反應組織中炎性細胞增多有關,提示在IBD疾病的發生發展中,NOX2可能在宿主免疫中發揮重要作用。靜息狀態時,NOX2定位在細胞內,不產生ROS,當受到外界刺激,如:病原微生物和細胞因子等,NOX2可易位到細胞表面并被迅速激活,產生大量ROS;過量的ROS可與細胞大分子發生反應,使DNA、蛋白質和脂質受到嚴重的氧化損傷,從而使腸上皮細胞結構與功能受損最終可導致細胞壞死,甚至死亡;此外,細胞內產生的ROS還可以通過信號轉導通路激活NOX2[20]。NOX2不僅在抵御細菌入侵中起重要作用,而且還參與炎性反應的許多信號通路,如炎性反應因子反應、中性粒細胞的聚集和轉錄[21]。研究[22-23]顯示NOX2功能受損與小于6歲的IBD的發生發展有關。
DUOX2是腸道黏膜H2O2的主要產生者,在整個消化系均有表達[24-25],生理情況下,H2O2可抵御細菌侵入和調控腸道菌群,參與腸道黏膜固有免疫應答[26]。但H2O2產生過量時可導致氧化應激,引起組織損傷[3,27-28]。對GPX1/2雙敲小鼠的研究[22,29]顯示Duox2可能是結腸炎的候選易感基因,在小鼠和人炎性反應性腸病中均發現DUOX2和IBD有密切的聯系,并參與初期炎性反應性腸病的發生。本臨床研究結果顯示DUOX2 mRNA和蛋白在正常結腸組織中有一定量的表達,在炎性反應性結腸黏膜組織中的表達量明顯升高;慢性腸炎動物模型結果顯示,慢性腸炎時Duox2蛋白表達水平均上調,mRNA上調不明顯,提示DUOX2除維持結腸組織正常生理功能外,可能在炎性反應過程中也發揮作用。
總之,本研究結果顯示IBD病人病變組織中NOX1、NOX2和DUOX2基因或/和表達明顯高于對照組;并首次在慢性結腸炎動物模型中得到相似的結論,提示這些NADPH氧化酶不但在維持機體正常生理功能過程中發揮重要作用,而且在炎癥性腸病初期階段的發病中也起一定的作用,其具體機制有待進一步研究。
[1] Kaser A, Zeissig S, Blumberg R S. Inflammatory bowel disease[J]. Ann Rev Immunol,2010,28: 573-621.
[2] Maloy K J, Powrie F. Intestinal homeostasis and its breakdown in inflammatory bowel disease[J]. Nature,2011, 474(7351): 298-306.
[3] Biasi F, Leonarduzzi G, Oteiza P I, et al. Inflammatory bowel disease: mechanisms, redox considerations, and therapeutic targets[J]. Antioxid Redox Signal,2013, 19(14): 1711-1747.
[4] Circu M L, Aw T Y. Intestinal redox biology and oxidative stress[J]. Semin Cell Dev Biol, 2012, 23(7): 729-737.
[5] Rada B, Leto T L. Oxidative innate immune defenses by Nox/Duox family NADPH oxidases[J]. Contrib Microbiol,2008, 15: 164-187.
[6] Bhattacharyya A, Chattopadhyay R, Mitra S, et al. Oxidative stress: an essential factor in the pathogenesis of gastrointestinal mucosal diseases[J]. Physiol Rev,2014, 94(2): 329-354.
[7] Cifuentes-Pagano E, Csanyi G, Pagano P J. NADPH oxidase inhibitors: a decade of discovery from Nox2ds to HTS[J]. Cell Mol Life Sci: CMLS,2012, 69(14): 2315-2325.
[8] Katsuyama M, Matsuno K, Yabe-Nishimura C. Physiological roles of NOX/NADPH oxidase, the superoxide-generating enzyme[J]. J Clin Biochem Nutr, 2012, 50(1): 9-22.
[9] Lam G, Apostolopoulos V, Zulli A, et al. NADPH oxidases and inflammatory bowel disease[J]. Curr Med Chem,2015, 22(17): 2100-2109.
[10]Ouyang Q, Xue L Y. Inflammatory bowel disease in the 21(st) century in China: turning challenges into opportunities[J]. J Dig Dis,2012,13(4): 195-199.
[11]Jemal A, Bray F, Center M M, et al. Global cancer statistics[J]. CA: Cancer J Clin, 2011, 61(2): 69-90.
[12]Bedard K, Krause K H. The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology[J]. Physiol Rev,2007, 87(1): 245-313.
[13]韓曉燕, 高麗萍, 劉箐. NOX家族蛋白的研究進展[J]. 生命科學, 2012,24(6): 568-577.
[14]Reuter S, Gupta S C, Chaturvedi M M, et al. Oxidative stress, inflammation, and cancer: how are they linked? [J]. Free Radic Biol Med,2010, 49(11): 1603-1616.
[15]Jones R M, Luo L, Ardita C S, et al. Symbiotic lactobacilli stimulate gut epithelial proliferation via Nox-mediated generation of reactive oxygen species[J]. EMBO J,2013, 32(23): 3017-3028.
[16]楊茉莉, 李宏謙, 李小珍, 等. NADPH氧化酶Nox1和Duox2在小鼠腸炎中的表達和意義[J]. 世界華人消化雜志,2015,23(10): 1560-1567.
[17]Kato M, Marumo M, Nakayama J, et al. The ROS-generating oxidase Nox1 is required for epithelial restitution following colitis[J]. Exp Anim,2016,65(3): 197-205.
[18]Yokota H, Tsuzuki A, Shimada Y, et al. NOX1/NADPH oxidase expressed in colonic macrophages contributes to the pathogenesis of colonic inflammation in trinitrobenzene sulfonic acid-induced murine colitis[J]. J Pharmacol Exp Ther,2017,360(1): 192-200.
[19]Szanto I, Rubbia-Brandt L, Kiss P, et al. Expression of NOX1, a superoxide-generating NADPH oxidase, in colon cancer and inflammatory bowel disease[J]. J Pathol,2005, 207(2): 164-176.
[20]Chen L, Xu B, Liu L, et al. Cadmium induction of reactive oxygen species activates the mTOR pathway, leading to neuronal cell death[J]. Free Radic Biol Med, 2011, 50(5): 624-632.
[21]Singel K L, Segal B H. NOX2-dependent regulation of inflammation[J]. Clin Sci, 2016, 130(7): 479-490.
[22]Hayes P, Dhillon S, O’Neill K, et al. Defects in NADPH oxidase genes NOX1 and DUOX2 in very early onset inflammatory bowel disease[J]. Cell Mol Gastroenterol Hepatol,2015,1(5): 489-502.
[23]Dhillon S S, Fattouh R, Elkadri A, et al. Variants in nicotinamide adenine dinucleotide phosphate oxidase complex components determine susceptibility to very early onset inflammatory bowel disease[J]. Gastroenterol,2014, 147(3): 680-689. e2.
[24]Nauseef W M. Biological roles for the NOX family NADPH oxidases[J]. J Biol Chem, 2008, 283(25): 16961-16965.
[25]Brown D I, Griendling K K. Nox proteins in signal transduction[J]. Free Radic Biol Med, 2009, 47(9): 1239-1253.
[26]Lipinski S, Till A, Sina C, et al. DUOX2-derived reactive oxygen species are effectors of NOD2-mediated antibacterial responses[J]. J Cell Sci,2009, 122(Pt 19): 3522-3530.
[27]Achitei D, Ciobica A, Balan G, et al. Different profile of peripheral antioxidant enzymes and lipid peroxidation in active and non-active inflammatory bowel disease patients[J]. Dig Dis Sci, 2013, 58(5): 1244-1249.
[28]杜莉莉, 呂潤瀟,楊曉漪,等.胎盤間充質干細胞低氧培養液對腸黏膜上皮細胞氧化應激損傷的保護作用[J]. 中國醫科大學學報,2016 ,45(2) :131-135,140.
[29]Chu F F, Esworthy R S, Doroshow J H, et al. Deficiency in Duox2 activity alleviates ileitis in GPx1-and GPx2-knockout mice without affecting apoptosis incidence in the crypt epithelium[J]. Redox Biol,2016(11): 144-156.
編輯 陳瑞芳
Significance of NADPH oxidases NOX1, NOX2 and DUOX2 expression in inflammatory bowel disease
Xuan Qingxia1, Dai Faliang1,Chen Pan1, Feng Dandan1, Jin Jianjun1, Gao Qiang1,2*
(1.DepartmentofGastroenterologyandHepatology,TheFirstAffiliatedHospital,andCollegeofClinicalMedicineofHenanUniversityofScienceandTechnology,Luoyang471003,HenanProvince,China; 2.DepartmentofGastroenterologyandHepatology,BeijingRehabilitationHospital,CapitalMedicalUniversity,Beijing100114,China)
Objective To investigate the expression of NOX1, NOX2 and DUOX2, the members of nicotinamide adenine dinucleotide phosphate (NADPH) oxidase family, in large intestine of patients with inflammatory bowel disease (IBD) and mouse colitis and analyze the relationship between these enzymes and IBD. Methods The samples were collected from large intestine of patients with IBD. Mouse chronic colitis model was established by using eight to ten-week-old C57BL/6 mice treated with three cycles of drinking 1.0% dextran sulfate sodium (DSS) for 7 days plus drinking water for 14 days. Mouse body weight change and hematoxylin-eosin (HE) staining of colon sections were used to evaluate the severity of inflammatory lesions. The expression of NOX1, NOX2 and DUOX2 gene and protein were detected by real-time quantitative reverse transcription polymerase chain reaction (RT-PCR) and immunohistochemistry, respectively. Results The expression of NOX1, NOX2 and DUOX2 mRNA significantly increased in human inflamed tissues compared to paired normal tissues (allP<0.01). NOX2 mRNA higher in male patients than female. Unlike human, only Nox2 mRNA increased by 2.4 times in chronic colitis mice, Nox1 and Duox2 mRNA remained unchanged. These three proteins in IBD patients increased (allP<0.01); in chronic colitis mice Nox2 and Duox2 proteins increased (bothP<0.01), but Nox1 did not. Conclusion NOX1, NOX2 and DUOX2 not only play an important role in maintaining the normal physiological function, but also were associated with early onset IBD.
NADPH oxidases; NOX1; NOX2; DUOX2; inflammatory bowel disease (IBD)
國家自然科學基金(81370487)。This study was supported by National Natural Science Foundation of China (81370487).
時間:2017-04-13 19∶37
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.1937.010.html
10.3969/j.issn.1006-7795.2017.02.014]
R574
2016-12-07)
*Corresponding author, E-mail:gaoq@ccmu.edu.cn

