多因素與大腸桿菌蛋氨酸合成代徑的關系
孟青,高海軍
(北京理工大學生命學院,北京,100081)
多因素與大腸桿菌蛋氨酸合成代徑的關系
孟青,高海軍
(北京理工大學生命學院,北京,100081)
蛋氨酸是人體必需的8種基本氨基酸之一。蛋氨酸生物合成途徑受多因素作用,包括水解酶,維生素B12,硫供應平衡的調控,末端代謝產物對合成關鍵基因的阻遏及抑制,阻遏蛋白MetJ和乳酸對蛋氨酸代謝合成的阻遏及抑制,及蛋氨酸在菌體內的轉運等。本文介紹了與蛋氨酸生物合成相關的影響因素。
蛋氨酸;生物合成;調控機制;硫平衡;轉運機制
蛋氨酸又名甲硫氨酸,是8種必需氨基酸中的唯一含硫氨基酸。它在代謝過程中能維持機體氮平衡,促進肝內脂肪代謝,臨床被用于脂肪肝、慢性肝炎的預防和治療,還用于砷、苯中毒的輔助治療。蛋氨酸是家禽玉米一豆粕型飼糧中限制性氨基酸[1],添加適當蛋氨酸,能有效改善家禽的免疫狀況、生長性能、血液生化指標狀況及繁殖性能[2,3]。蛋氨酸被推廣了到飼料生產、食品、醫療、保健等多個行業。近年來,全球市場對蛋氨酸的需求量不斷增長。
蛋氨酸的主要生產方法為化學法:一是海因法,為日本曹達公司、住友化學公司、德國的迪高沙公司采用,產品為固態DL-氨基酸;另一種是氰醇法,為美國的NOVUS國際公司采用,產品為液體蛋氨酸羥基類似物(Methionine hydroxyl analogue,MHA)[4]。化學法生產蛋氨酸經濟指標低,排污大。微生物發酵法已廉價獲得了許多氨基酸,但蛋氨酸難以大量發酵合成,故研究微生物發酵法合成蛋氨酸具有巨大意義[5, 6, 7]。
1 蛋氨酸生物合成的基本途徑
蛋氨酸屬于天冬族氨基酸,它以草酰乙酸或天冬氨酸為原料(如圖1)合成。蛋氨酸的直接合成途徑涉及到的合成酶有MetL、MetA、MetB、MetC、MetE、MetH等,蛋氨酸合成的分支途徑賴氨酸合成途徑涉及的酶包括DapA、DapB、LysA,另一個分支途徑蘇氨酸合成途徑涉及的酶為ThrB、ThrC、IlvA、IlvB、IlvC、IlvD、IlvE,蛋氨酸合成的硫底物賴氨酸到胱硫醚涉及的酶為CysE、CysK、CysM。合成的蛋氨酸可經蛋氨酸甲基轉移酶(MetK)催化生成S-腺苷甲硫氨酸。

圖1 蛋氨酸合成途徑及相關基因
2 大腸桿菌中影響蛋氨酸合成的因素
2.1 蛋氨酸合成酶的穩定性
在大腸桿菌中,蛋氨酸生物合成途徑中發揮作用的第一個酶是高絲氨酸琥珀酰轉移酶(MetA)[8]。它不同于大多數穩定的細菌蛋白,對許多極端條件(高溫、強氧化、過酸)都很敏感[9,10]。溫度高于25℃時,MetA活性降低且蛋白結構趨向展開,大腸桿菌出現蛋氨酸營養缺陷型生長。溫度超過44℃時,MetA發生完全不可逆的聚集沉淀,導致菌體生長受限[11]。蛋白質的穩定性是由N端殘基決定的(即N端法則)[12]。Dvora Biran以纈氨酸代替MetA的N端殘基脯氨酸后,發現MetA的穩定性并無改變,證明了MetA的穩定性并不遵循N端法則[12]。Mordukhova報道了MetA蛋白的穩定性與它的兩個殘基——異亮氨酸299和天冬氨酸267有關,將這兩個殘基替換以后,MetA穩性增加[13]。化學分子伴侶氧化三甲胺也可增加MetA的穩定性并使菌體在較高的溫度下正常生長[14]。由于MetA極易傾向于聚集狀態,有學者建議將其歸納為分子伴侶的第三類底物,Mordukhova發現大腸桿菌突變菌株在去除分子伴侶或是ATP依賴蛋白后,其MetA在37℃(正常生理溫度條件下)出現異常構象而影響菌體生長,在突變菌株的培養基中加入蛋氨酸后,菌株恢復正常生長[15]。
2.2 蛋氨酸合成酶的分子的調控
MetJ是屬于ribbon-helix-helix家族蛋氨酸合成阻遏蛋白。它通過兩股反向β折疊與DNA的大溝結合[16],兩個外部的α螺旋和與DNA鄰近的蛋白質相互作用。MetJ以二聚體的形式識別并綁定到DNA上一段共有的8bp的DNA回文序列上[17],這段序列被稱為met-box。MetJ能通過協助擴散作用迅速找到作用靶位點[18],而S-腺苷蛋氨酸是蛋氨酸代謝途徑的最終產物,它作為MetJ的輔阻遏物能增強這種識別作用。S-腺苷蛋氨酸在與MetJ的結合過程中,能與DNA的磷酸骨架產生很強的靜電作用,從而使MetJ與DNA的作用增強100倍[19]。受MetJ調控的基因在自身的調控序列中一般含有2-5個連續的可與MetJ相互作用的met-box[20]。在蛋氨酸合成途徑中,受到MetJ調控作用的基因有ahpC, ahpF, folE, metA, metB, metC, metE, metF, metI, metK, metL, metN, metQ, metR, yeiB,另外,metJ基因自身也受到MetJ的阻遏作用。
MetR是蛋氨酸合成中的激活調節蛋白。Urbanowski1986年提出了MetR作為反式激活因子對MetE和MetH都具有調控作用[21]。在大腸桿菌中,metR經測序確定有317個氨基酸[22],包含一個與真核生物DNA結合蛋白特征相同的亮氨酸拉鏈。Maxon將MetR蛋白中亮氨酸拉鏈區域的兩個亮氨酸替換或是把其中一個用脯氨酸代替時MetR失去生物活性,并確定了MetR的一個區域與同型半胱氨酸共激活metE相關[23],在metE和metH轉錄過程中,需要依靠MetR激活蛋白的作用。MetR在溶解狀態下是一個二聚體,綁定DNA到共有序列5’-TGAANNTNNTTCA-3’上[24]。MetR以同型半胱氨酸作為共激活劑,可以使metE表達提高200倍。而metH的表達則不需要同型半胱氨酸的共激活作用。
2.3 維生素B12和鋅指在甲基轉移過程的作用
蛋氨酸的生物合成主要涉及兩條途徑,一條途徑形成同型半胱氨酸,另一條則形成甲基供體-N5-甲基四氫葉酸。蛋氨酸合成的最后一步是由N5-甲基四氫葉酸提供一碳單位轉移到同型半胱氨酸的甲基轉移作用[25]。在大腸桿菌中,存在兩種酶催化此反應,一種酶是metH的基因產物,被稱為B12依賴型的甲基轉移酶,包含一個與甲基轉移相關的鈷胺酰胺輔基;另一種酶是metE的基因產物,是一種B12非依賴型的甲基轉移酶,它主要是大腸桿菌在脫阻遏條件下表達[26]。metE基因表達的調控過程非常復雜,像其他met基因(除metH外)一樣,它也被生長培養基中高水平的蛋氨酸濃度抑制[27,28,29,]。編碼甲基四氫葉酸的基因metF間接調控metE,在維生素B12及其派生物存在時,metE和metF的基因表達受到抑制。B12抑制metE的原理是損耗了共激活劑同型半胱氨酸而降低了MetR的激活作用。在MetH全酶形成甲基-B12酶時,甲基四氫葉酸對于甲基轉移到B12是必須的,催化甲基化這一過程發生的MetH蛋白對metE的表達具有調控作用[30] 。YagD是鋅指依賴的甲基轉移酶,其催化機制與MetH相似,它催化S-甲基蛋氨酸或S-腺苷蛋氨酸與同型半胱氨酸合成蛋氨酸,YagD由MetJ-S-腺苷蛋氨酸系統調控[31]。
2.4 硫平衡
硫元素廣泛存在于蛋白質和其他重要的生物分子中,對生物機體非常重要。蛋氨酸作為甲基供體s-腺苷甲硫氨酸的前體,是生物體重要的含硫氨基酸。細菌、真菌和植物可以利用無機硫(SO4、H2S等)合成半胱氨酸進而合成蛋氨酸[32,33]。從化學基礎的角度分析,天冬氨酸直接合成蛋氨酸需要消耗1個ATP和2個NADPH,再結合被氧化的無機硫,需要另外消耗2個ATP,一個GTP和4個NADPH,由此可見硫底物影響很大。如果減少硫底物同化作用的耗能(如以氣態甲硫醇或是液態二甲基-二硫醚代替無機硫),極有可能提高蛋氨酸的產量[34]。同化硫的途徑和與之相關的酶已經在大腸桿菌中研究的較為清楚,其中CysZ是大腸桿菌內膜蛋白,負責轉運用于合成半胱氨酸的硫酸鹽[35],在硫酸鹽濃度較低的條件下,菌體尤其依賴cysZ基因。另外,CysZ與半胱氨酸生物合成的中間物亞硫酸鹽的相互作用比它與硫酸鹽的相互作用更為密切,當亞硫酸鹽存在時會抑制硫酸鹽的轉運,說明亞硫酸鹽可通過反饋調節機制通過CysZ調控硫酸鹽的攝入。硫酸鹽的攝入過程依靠質子梯度[36]。大多數與硫同化途徑相關的基因都被轉錄因子CysB調控,在細胞缺乏半胱氨酸時,該轉錄因子激活調節子使細胞產生應答[37]。YciW是cysB的調節子,近年來,有研究通過在大腸桿菌中對yciW過表達,成功的積累了同型半胱氨酸,也表明了yciW與蛋氨酸的生物合成途徑相關[38]。
2.5 蛋氨酸的轉運
盡管野生型大腸桿菌能從頭合成蛋氨酸,仍需要額外的蛋氨酸或是蛋氨酸類似物來滿足細胞生長。大腸桿菌的蛋氨酸轉運系統與蛋氨酸機體內部與外部的濃度有關[39]。細胞內部蛋氨酸聚集或是外部濃度偏高會使蛋氨酸攝取比率降低,相反,蛋氨酸匱乏的營養缺陷型菌會增加對外部蛋氨酸的運輸[39]。研究表明蛋氨酸進入大腸桿菌涉及兩種特殊的轉運蛋白-高親和力的MetD轉運系統和低親和力的MetP轉運系統[40](如圖2),他們都受到細胞內部蛋氨酸濃度的調控。D-蛋氨酸的轉運既依賴ATP又對滲透
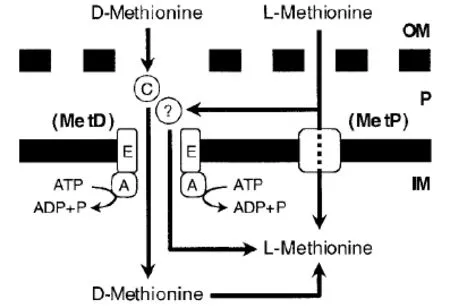
圖2[57]蛋氨酸轉運到大腸桿菌模式圖
壓敏感,對滲透壓的敏感與周質蛋白有關[41],這些屬性是典型的ABC轉運體的特征。盡管MetD和MetP都能轉運L-蛋氨酸,但只有MetD能轉運D-蛋氨酸[57]。MetD包括ATP酶、透性酶YaeE、底物結合蛋白YaeC,它的表達受L-蛋氨酸和MetJ的抑制作用。L型蛋氨酸阻遏D型的攝取,而D型對L型異構體的攝取無影響[42]。根據Kadner的實驗,MetD對于兩種蛋氨酸異構體擁有不同的基質綁定位點。蛋氨酸可在MetD的協助下,利用濃度梯度轉運(吸收過程屬于溫度敏感型),蛋氨酸的濃度梯度及溫度對蛋氨酸攝取的影響表明蛋氨酸進入細菌細胞的過程是需能的激活轉運過程。攝取系統均由菌體內蛋氨酸水平調控,不同情況下在親和力上至少相差400倍[40,42]。在大腸桿菌中,轉運至細胞的蛋氨酸以s-腺苷蛋氨酸的形式積累,主動運輸會在添加疊氮化物或氟化物時會受到抑制[40]。在L-蛋氨酸攝取初始時期,培養基中加入α-酮基-λ-甲基丁酸、D-蛋氨酸,或蛋氨酸亞砜時對L-蛋氨酸的攝入并無影響,而加入蛋氨酸類似物或蛋氨酸合成前體物質時,L-蛋氨酸的攝入量減少[39]。
2.6 蛋氨酸生物合成分支代謝產物的調控
蛋氨酸生物合成的分支代謝途徑主要終產物是賴氨酸、蘇氨酸和異亮氨酸。因此,賴氨酸營養缺陷型、蘇氨酸營養缺陷型和異亮氨酸營養缺陷型都可使蛋氨酸合成途徑去阻遏,并使碳流向蛋氨酸,有利于蛋氨酸的過表達[43]。天冬氨酸激酶是天冬氨酸族氨基酸合成代謝途徑的第一個酶,存在三個不同的天冬氨酸激酶,天冬氨酸激酶Ⅰ(ThrA) 受到蘇氨酸和異亮氨酸的阻遏和抑制作用;天冬氨酸激酶Ⅱ(MetL)受到蛋氨酸的阻遏和抑制作用而天冬氨酸激酶Ⅲ(LysC) 受到賴氨酸的阻遏和抑制作用。另外,高絲氨酸酰基轉移酶(MetA)同時受到蛋氨酸及S-腺苷蛋氨酸的抑制作用。
2.7 其他分子對蛋氨酸合成的影響
弱酸能抑制蛋氨酸的合成。幾千年前人們就開發利用了弱酸的防腐作用,其機理為:未解離的酸能自由穿過磷脂雙分子層,在胞質中釋放質子并積累,降低pH[44],從而抑制細胞的生長。細胞對弱酸的應答非常復雜。Pomposiello等用5 mM的水楊酸鹽處理細胞發現基因的轉錄受到影響[45]。Han在發酵過程中發現蛋氨酸能解除乙酸對大腸桿菌生長的抑制作用[46]。Roe 對此做了進一步研究,發現在乙酸環境中生長的大腸桿菌細胞體內的蛋氨酸生物合成代謝中間產物同型半胱氨酸含量大大增加,說明弱酸抑制了此中間產物的下游代謝過程,進而抑制了蛋氨酸合成,中間代謝物堆積造成的毒性及低pH也導致了細胞生長的抑制[47]。
3 蛋氨酸生產中相關問題的研究及展望
自然界中可以在植物或動物中存在少量L-蛋氨酸,高水平蛋氨酸在蛋(卵清蛋白,5%)和種子(巴西堅果,12%)中存在,動物蛋白如昆蟲及其幼蟲中也含較多蛋氨酸,但通過加工動物殘余物(肉粉、魚粉、骨粉、羽毛粉)來獲得蛋氨酸因安全原因(瘋牛病、禽流感)在許多國家是被嚴格控制的。1970年科研人員對利用單細胞蛋白生產蛋氨酸進行了廣泛的研究,研究的菌體大部分為酵母、藻類、甲基營養菌等,但是存在如一些污染物產生霉毒素,酵母中蛋氨酸含量不足等問題。考慮到環境及經濟原因,植物作為研究對象更加適合。葡萄糖胺也是一種非常有潛能的蛋氨酸發酵原材料,它是幾丁質(地球生最豐富的生物高聚物)的降解物[48]。還有許多出版物及專利嘗試利用代謝工程改造菌體,優化能量和氧化還原平衡、硫供應平衡,使用特殊的前體細胞,增加向胞外轉運產物或向胞內轉運基質產物的效率等辦法提高蛋氨酸的產量[49-53]。通過基因操作技術來改造蛋氨酸合成的途徑是一個非常熱門的課題,第一次嘗試是在植物中進行基因操作以提高種子蛋白中蛋氨酸含量[54]。在80年代中期開始對細菌和酵母菌實施改造,同時也出現了許多針對在大腸桿菌和谷氨酸棒桿菌中蛋氨酸生物合成相關的綜述[50,55]。Figge持有的許多專利成為法國邁陀保利克公司改造大腸桿菌發酵L-蛋氨酸的依據[52,56]。隨著生物工程代謝研究的深入,有望通過構建蛋氨酸的高產菌株實現普遍的蛋氨酸發酵的工業化。
[1] Bunchasak C. Role of dietary methionine in poultry production [J]. Journal of Poultry Science, 2009, 46(3):169-179.
[2] Rama Rao S V, Praharaj N K, Ramasubba R V,et al. Interaction between genotype and dietary concentrations of methionine for immune function in commercial broilers [J]. British Poultry Science, 2003, 44(1):104-112.
[3] Hickling D, Guenter W, Jackson M E. The effects of dietary methionine and lysine on broiler chicken performance and breast meat yield [J]. Canadian Journal of Animal Science, 1990, 70(2):673-678.
[4] 任少鋒, 閻淑萍 ,張士瑩等. 蛋氨酸的生產及其應用[J]. 河北化工,1996,(01):37-40.
[5] Pham C B, Galvez C F, Padolina W G. Methionine fermentation by batch fermentation from various carbohydrates [J]. ASEAN Food Journal,1992;7:34-7.
[6] Umerie S C, Ekwealor I A, Nawabo I O. Lysine production from various carbohydrates and seed meals [J]. Bioresour Technol ,2000;75:249-52.
[7] Odunfa S A, Adeniran S A, Teniola,et al. Evaluation of lysine and methionine production in some Lactobacilli and yeasts from ogi. [J]. International Journal of Food Microbiology, 2001, 63(1-2):159-163.
[8] Dvora B, Eyal G, Leora G,et al. Control of methionine biosynthesis in Escherichia coli by proteolysis [J]. Molecular Microbiology, 2000, 37(6):1436-1443.
[9] Price C M, Fazzio T G, Vallbona E I,et al. Polyphosphate kinase protects Salmonella enterica from weak organic acid stress[J]. Journal of Bacteriology, 2005, 187(9):3088-3099.
[10] Ron E Z, Davis B D. Growth rate of Escherichia coli at elevated temperatures: limitation by methionine.[J]. Journal of Bacteriology, 1971, 107(2):391-396.
[11] Gur E, Biran D, Gazit E,et al. In vivo aggregation of a single enzyme limits growth of Escherichia coli at elevated temperatures.[J]. Molecular Microbiology, 2002, 46(5):1391-1397.
[12] Tobias J W, Shrader T E, Rocap G,et al. The N-end rule in bacteria.[J]. Science, 1991, 254(5036):1374-7.
[13] Mordukhova E A, Lee H S, Pan J G. Improved thermostability and acetic acid tolerance of Escherichia coli via directed evolution of homoserine o-succinyltransferase.[J]. Applied & Environmental Microbiology, 2008, 74(74):7660-8.
[14] AmChem. The chemical chaperone trimethylamine oxide reduces insoluble MetA accumulation and improves E. coli growth at elevated temperatures Osborne TB Sulphur in protein bodies [J]. Soc, 1902,24:140-167
[15] Mordukhova E A, Kim D, Pan J G. Stabilized homoserine o-succinyltransferases (MetA) or L-methionine partially recovers the growth defect in Escherichia coli, lacking ATP-dependent proteases or the DnaK chaperone [J]. BMC Microbiology, 2013, 9(1):1-13.
[16] Somers W S. Crystal structures of methionine repressor of E. coli and its complex with operator.[J]. University of Leeds, 1990.
[17] Smith A A, Greene R C, Kirby T W,et al. Isolation and characterization of the product of the methionine-regulatory gene metJ of E.coli K12[J]. Proceedings of the National Academy of Sciences, 1985, 82(18):6104-6108.
[18] Augustus A M, Reardon P N, Spicer L D. MetJ repressor interactions with DNA probed by in-cell NMR.[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(13):5065-5069.
[19] Phillips K, Phillips S E. Electrostatic activation of Escherichia coli methionine repressor.[J]. Structure, 1994, 2(4):309-316.
[20] Old I G, Phillips S E, Stockley P G,et al. Regulation of methionine biosynthesis in the Enterobacteriaceae.[J]. Progress in Biophysics & Molecular Biology, 1991, 56(56):145-185.
[21] Urbanowski M L, Stauffer L T, Plamann L S,et al. A new methionine locus, metR, that encodes a trans-acting protein required for activation of metE and metH in Escherichia coli and Salmonella typhimurium.[J]. Journal of Bacteriology, 1987, 169(4):1391-1397.
[22] Plamann L S, Stauffer G V. Nucleotide sequence of the Salmonella typhimurium metR gene and the metR-metE control region.[J]. Journal of Bacteriology, 1987, 169(9):3932-3937.
[23] Maxon M E, Wigboldus J, Brot N,et al. Structure-functionstudies on Escherichia coli MetR protein, a putative prokaryotic leucine zipper protein.[J]. Proceedings of the National Academy of Sciences, 1990, 87(18):7076-7079.
[24] Urbanowski M L, Stauffer G V. Genetic and biochemical analysis of the MetR activator-binding site in the metE metR control region of[J]. Journal of Bacteriology, 1989, 171(10):5620-5629.
[25] Taylor R T, Weissbach H. 4 N 5 -Methyltetrahydrofolate-Homocysteine Meihyltransferases [J]. Enzymes, 1973, 9:121-165.
[26] Whitfield C D, Jr S E, Weissbach H. Purification and properties of 5-methyltetrahydropteroyltriglutamate-homocysteine transmethylase.[J]. Journal of Biological Chemistry, 1970, 245(2):390-401.
[27] Ahmed A. Mechanism of repression of methionine biosynthesis in Escherichia coli. I. The role of methionine, s-adenosylmethionine, and methionyl-transfer ribonucleic acid in repression.[J]. Molecular Genetics and Genomics, 1973, 123(4):325-331.
[28] Dawes J, Foster M A. Vitamin B 12, and methionine synthesis in Escherichia coli [J]. Biochimica et Biophysica Acta (BBA) -General Subjects, 1971, 237(3):455-464.
考慮到錫石多金屬硫化礦中黃鐵礦含量較高,下面以黃鐵礦與脈石為例分析微波加熱預處理微波選擇性加熱過程應力的產生機理,以及如何對微波助磨產生影響。
[29] Greene R C, Williams R D, Kung H F,et al. Effect of methionine and vitamin B-12 on the activities of methionine biosynthetic enzymes in metJ mutants of Escherichia coli K12.[J]. Archives of Biochemistry & Biophysics, 1973, 158(1):249-256.
[30] Cai X Y, Maxon M E, Redfield B,et al. Methionine synthesis in Escherichia coli: effect of the MetR protein on metE and metH expression.[J]. Proceedings of the National Academy of Sciences, 1989, 86(12):4407-4411.
[31] Thanbichler M, Neuhierl B, Bōck A. S-methylmethionine metabolism in Escherichia coli.[J]. Journal of Bacteriology, 1999, 181(2):662-665.
[32] Ravilious G E, Jez J M. Structural biology of plant sulfur metabolism: from assimilation to biosynthesis.[J]. Natural Product Reports, 2012, 29(10):1138-1152.
[33] Nakatani T. Enhancement of thioredoxin/glutaredoxinmediated L-cysteine synthesis from S -sulfocysteine increases L-cysteine production in Escherichia coli [J]. Microbial Cell Factories, 2012, 11(1):1-9.
[34] Bolten C J, Schrōder H, Dickschat J,et al. Towards methionine overproduction in Corynebacterium glutamicum--methanethiol and dimethyldisulfide as reduced sulfur sources.[J]. Journal of Microbiology & Biotechnology, 2010, 20(8):1196-1203.
[35] Parra F, Britton P, Castle C,et al. Two Separate Genes Involved In Sulphate Transport In Escherichia coli K12[J]. Journal of General Microbiology, 1983, 129(2):357-358.
[37] Kredich N M. The molecular basis for positive regulation of cys promoters in Salmonella typhimurium and Escherichia coli.[J]. Molecular Microbiology, 1992, 6(19):2747-2753.
[38] Kawano Y, Ohtsu I, Ai T,et al. Involvement of the yciW, gene in l -cysteine and l -methionine metabolism in Escherichia coli [J]. Journal of Bioscience & Bioengineering, 2014, 119(3):310-313.
[39] Kadner R J. Regulation of methionine transport activity in Escherichia coli.[J]. Journal of Bacteriology, 1975, 122(1):110-119.
[40] Kadner R J. Transport systems for L-methionine in Escherichia coli.[J]. Journal of Bacteriology, 1974, 117(1):232-241.
[41] Kadner R J, Winkler H H. Energy coupling for methionine transport in Escherichia coli.[J]. Journal of Bacteriology, 1975, 123(3):985-91.
[42] Kadner R J. Transport and utilization of D-methionine and other methionine sources in Escherichia coli.[J]. Journal of Bacteriology, 1977, 129(1):207-216.
[43] Gomes J, Kumar D. Production of l -methionine by submerged fermentation: A review[J]. Enzyme & Microbial Technology, 2005, 37(1):3-18.
[44] Russell J B, Diez G F. The Effects of Fermentation Acids on Bacterial Growth[J]. Advances in Microbial Physiology, 1998, 39: 205-234.
[45] Pomposiello P J, Bennik M H, Demple B. Genome-wide transcriptional profiling of the Escherichia coli responses to superoxide stress and sodium salicylate[J]. Journal of Bacteriology, 2001, 183(13): 3890-3902.
[46] Han k, Hong J, Lim H C. Relieving effects of glycine and methionine from acetic acid inhibition in Escherichia coli fermentation. Biotechnol Bioeng ,1993, 41: 316-324.
[47] Roe A J O, Byrne C, McLaggan D, Boot .I R. Inhibition of Escherichia coli growth by acetic acid:a problem with methionine biosynthesis and homocysteine toxicity. Microbiology, 2002, 148:2215-2222.
[48] Himmel M E, Ding S Y, Johnson D K,et al. Biomass recalcitrance: engineering plants and enzymes for biofuels production[J]. Science, 2007, 315(5813): 804-807.
[49] Trōtschel C, Deutenberg D, Bathe B,et al. Characterization of methionine export in Corynebacterium glutamicum.[J]. Journal of Bacteriology, 2005, 187(11):3786-3794.
[50] Figge R M. Methionine Biosynthesis in Escherichia coli, and Corynebacterium glutamicum[J]. Microbiology Monographs, 2006, 5:163-193.
[51] Figge R, Soucaille P, Barbier G, Bestel-Corre G, Boisart C, Chateau M. Patent to MetabolicExplorer: Increasing methionine yield. 2009WO2009/043372(A1)
[52] Dischert W, Figge R (2013a). Patent to MetabolicExplorer: A microorganism for methionine production with enhanced glucose import.WO2013/001055(A1)
[33] Ikeda M, Takeno S. Amino Acid Production by Corynebacterium glutamicum [M]// Corynebacterium glutamicum. Springer Berlin Heidelberg, 2012:107-147.
[54] Altenbach S B, Pearson K W, Meeker G,et al. Enhancement of the methionine content of seed proteins by the expression of a chimeric gene encoding a methionine-rich protein in transgenic plants [J]. Plant Molecular Biology, 1989, 13(5): 513-522.
[50] Woo H M, Park J B. Recent progress in development of synthetic biology platforms and metabolic engineering of Corynebacterium glutamicum[J]. Journal of Biotechnology, 2014, 180(15): 43-51.
[56] Dischert W, Vasseur P, Boisart C,et al. Increasing NADPH availability for methionine production: US, US9034611[P]. 2015.
[57] Merlin C, Gardiner G, Durand S,et al. The Escherichia coli metD locus encodes an ABC transporter which includes Abc (MetN), YaeE (MetI), and YaeC (MetQ)[J]. Journal of Bacteriology, 2002, 184(19):5513-5517.
Relationship Between Multifactors and Metabolism of Methionine Synthesis in Escherichia Coli
Meng Qing, Gao Haijun
(School of Life Science, Beijing Institute of Technology, Beijing 100081)
methionine is one of the eight basic amino acids necessary for human body. Methionine biosynthesis pathway is a ff ected by many factors including hydrolase, vitamin B12, regulation of sulfur supply balance, repression and inhibition of key metabolites by synthetic metabolites, repression and inhibition of methionine metabolism by MetJ and lactate, and methionine transport in bacteria. The factors associated with methionine biosynthesis is des cribed in this paper.
methionine; biosynthesis; regulation mechanism; Sulfur balance; transport mechanism
Q815
A
10. 11967/2017150102
Q815
A DOI:10. 11967/201715010102
孟青,女,理學碩士,Email:wanyanhaianxian@163.com
高海軍,男,副教授,碩士生導師,Email:hj_gao@bit.edu.cn

