某地區(qū)CFDA藥品說(shuō)明書修訂通知落實(shí)情況的調(diào)查與分析
李廣瑞,邱素民,高蒙蒙,畢繼宏,孫成鎮(zhèn)
(濟(jì)寧醫(yī)學(xué)院附屬金鄉(xiāng)人民醫(yī)院,山東 濟(jì)寧 272200)
某地區(qū)CFDA藥品說(shuō)明書修訂通知落實(shí)情況的調(diào)查與分析
李廣瑞,邱素民,高蒙蒙,畢繼宏,孫成鎮(zhèn)
(濟(jì)寧醫(yī)學(xué)院附屬金鄉(xiāng)人民醫(yī)院,山東 濟(jì)寧 272200)
目的:了解上市后藥品說(shuō)明書修訂情況,為加強(qiáng)藥品說(shuō)明書監(jiān)管提供參考。方法:根據(jù)國(guó)家食品藥品監(jiān)督管理總局(CFDA)網(wǎng)站2011 - 2013年發(fā)布的藥品說(shuō)明書修訂通知,對(duì)某縣區(qū)各級(jí)醫(yī)療機(jī)構(gòu)使用的相關(guān)藥品說(shuō)明書修訂情況進(jìn)行核對(duì)、分析。結(jié)果:涉及70個(gè)品規(guī)的藥品說(shuō)明書中,57個(gè)品規(guī)的藥品說(shuō)明書進(jìn)行了規(guī)范修訂(81.43%);中成藥和化學(xué)藥品說(shuō)明書均存在未按通知規(guī)范修訂的情況。結(jié)論:國(guó)家有關(guān)管理部門、藥品生產(chǎn)企業(yè)及醫(yī)療機(jī)構(gòu)應(yīng)重視上市后藥品說(shuō)明書修訂工作,以便更好地實(shí)現(xiàn)安全、合理用藥的目的。
藥品說(shuō)明書;上市后;修訂;調(diào)查
藥品說(shuō)明書是由藥品生產(chǎn)企業(yè)提供的,經(jīng)CFDA批準(zhǔn)的,包含藥品安全性、有效性等重要信息,是用于指導(dǎo)醫(yī)師、藥師和患者安全用藥的重要技術(shù)性資料[1],是判斷用藥行為是否得當(dāng)最具法律效力的依據(jù),同時(shí)也代表著政府的公信力[2]。近年來(lái)CFDA根據(jù)藥品不良反應(yīng)監(jiān)測(cè)、藥品再評(píng)價(jià)結(jié)果,陸續(xù)發(fā)布了許多上市藥品說(shuō)明書修訂的通知,以完善上市后藥品監(jiān)管,確保患者用藥安全。本文整理2011 - 2013年CFDA網(wǎng)站發(fā)布的有關(guān)通知,收集某地區(qū)各級(jí)醫(yī)療機(jī)構(gòu)正在使用的相關(guān)藥品說(shuō)明書,旨在了解有關(guān)藥品說(shuō)明書修訂情況,為進(jìn)一步加強(qiáng)藥品說(shuō)明書監(jiān)管、保障患者用藥安全提供參考。
1 資料來(lái)源
根據(jù)CFDA網(wǎng)站2011 - 2013年發(fā)布的修訂藥品說(shuō)明書通知,收集某縣區(qū)所有一級(jí)以上(含一級(jí))醫(yī)院目前正在使用的相關(guān)藥品說(shuō)明書,對(duì)說(shuō)明書修訂情況進(jìn)行核對(duì)、分析。
2 結(jié)果
2.1 抽查地區(qū)基本情況
該縣區(qū)人口64萬(wàn)余人,衛(wèi)生事業(yè)發(fā)展良好,各級(jí)醫(yī)療機(jī)構(gòu)較為齊全,一級(jí)以上(含一級(jí))醫(yī)療機(jī)構(gòu)16家,具有較好的代表性。見表1。
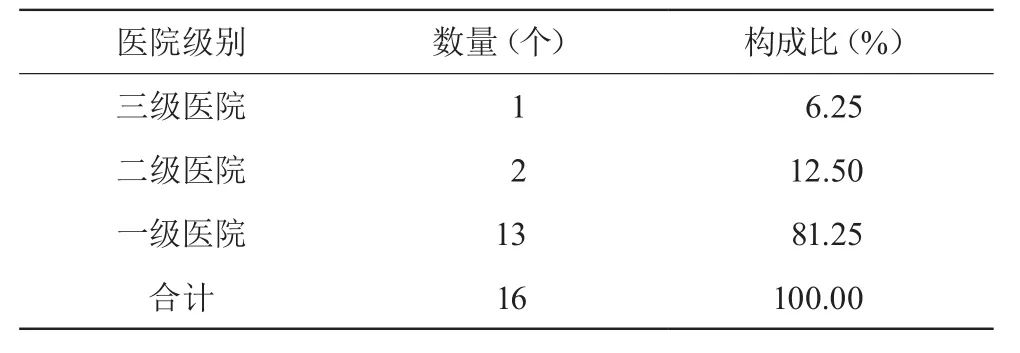
表1 醫(yī)院構(gòu)成情況
2.2 藥品說(shuō)明書修訂情況
CFDA網(wǎng)站2011年 - 2013年發(fā)布藥品說(shuō)明書修訂通知共計(jì)41條,涉及藥品41種(含相同主要成分),該地區(qū)在用相關(guān)藥品31種,占發(fā)布修訂藥品的75.61%;收集有關(guān)藥品信息,該地區(qū)正在使用的品種共計(jì)70個(gè)品規(guī),其中中成藥23個(gè)(32.86%),化學(xué)藥品47個(gè)(67.14%)。見表2。
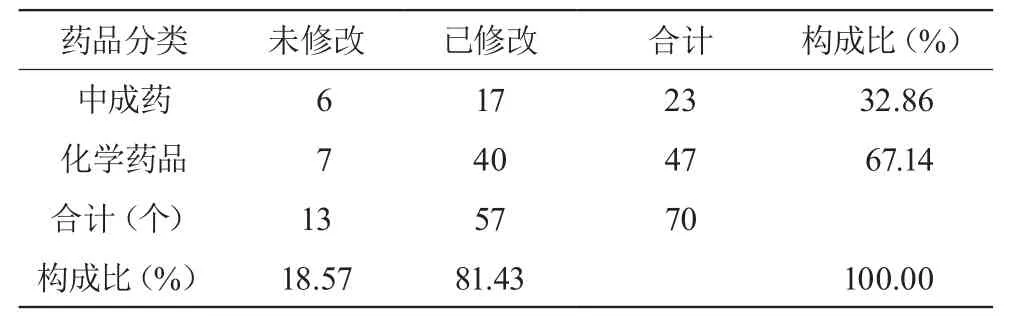
表2 涉及藥品種類
2.3 說(shuō)明書未修訂藥品情況
分析CFDA發(fā)布的藥品說(shuō)明書修訂通知,修訂內(nèi)容主要涉及增加警示語(yǔ),修訂藥品不良反應(yīng)、注意事項(xiàng)或禁忌等內(nèi)容。未按照有關(guān)通知規(guī)范修訂的藥品信息見表3。
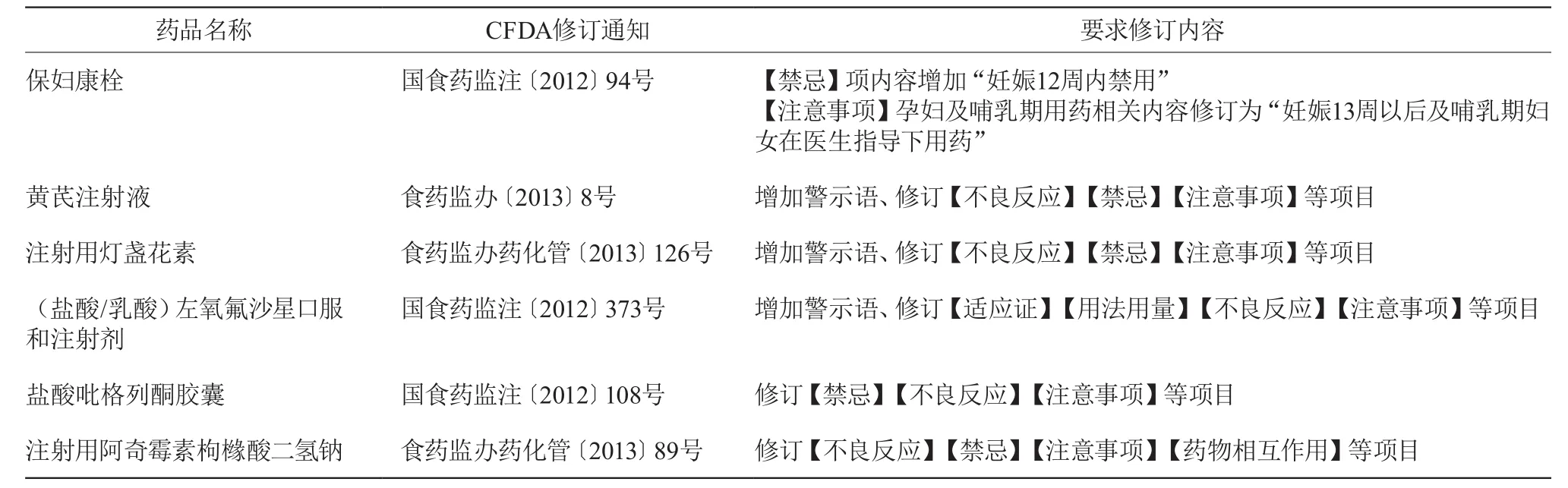
表3 未修訂藥品情況
藥品說(shuō)明書未及時(shí)規(guī)范修訂有以下幾種情況:①藥品上市后說(shuō)明書從未進(jìn)行過(guò)修訂,如鹽酸吡格列酮膠囊;②藥品上市后說(shuō)明書進(jìn)行過(guò)修訂,但在CFDA發(fā)布修訂通知后未重新修訂,如注射用燈盞花素;③在CFDA發(fā)布修訂通知后進(jìn)行過(guò)修訂,但未按照通知規(guī)范修訂;如保婦康栓、黃芪注射液、(鹽酸/乳酸)左氧氟沙星口服和注射劑、注射用阿奇霉素枸櫞酸二氫鈉等;另外還存在同一廠家生產(chǎn)的不同規(guī)格的同種藥品,僅對(duì)其中一種規(guī)格的藥品說(shuō)明書進(jìn)行規(guī)范修訂的現(xiàn)象;如湖南某制藥有限公司生產(chǎn)的注射用燈盞花素(規(guī)格為20 mg的藥品說(shuō)明書按照規(guī)定進(jìn)行了修訂、而規(guī)格為50 mg的說(shuō)明書未修訂)。
3 討論
3.1 近年來(lái),隨著該地區(qū)經(jīng)濟(jì)的快速發(fā)展,醫(yī)藥衛(wèi)生事業(yè)也得到了較好發(fā)展。醫(yī)療資源配置形成了以一家三級(jí)綜合醫(yī)院為龍頭,中醫(yī)院、社會(huì)辦醫(yī)療機(jī)構(gòu)(二級(jí)醫(yī)院)及鄉(xiāng)鎮(zhèn)衛(wèi)生院為補(bǔ)充的、較為合理的醫(yī)療機(jī)構(gòu)布局。該地區(qū)藥品配備、使用情況,具有一定的代表性,能反映出藥品流通市場(chǎng)中藥品說(shuō)明書修訂情況的現(xiàn)狀。
3.2 由表2可見,70個(gè)品規(guī)的藥品說(shuō)明書中,57個(gè)品規(guī)的藥品說(shuō)明書進(jìn)行了規(guī)范修訂,占總數(shù)的81.43%;其中中成藥規(guī)范修訂17例,占所調(diào)查中成藥比例的73.91%;化學(xué)藥品規(guī)范修訂40例,占所調(diào)查化學(xué)藥品比例的85.11%;中成藥和化學(xué)藥品說(shuō)明書均不同程度的存在未按通知規(guī)范修訂的情況。
3.3 通過(guò)對(duì)相關(guān)藥品說(shuō)明書修訂情況分析發(fā)現(xiàn),不同廠家對(duì)上市后藥品說(shuō)明書修訂情況差距較大,最多的修訂8次(如氫溴酸西酞普蘭片),最少的一次未修訂(如鹽酸吡格列酮膠囊);上市時(shí)間基本相同的同一成分的藥品(如左氧氟沙星制劑),不同廠家對(duì)上市后藥品說(shuō)明書修訂的次數(shù)也存在明顯差異。
CFDA所發(fā)布藥品說(shuō)明書修訂通知是根據(jù)藥品不良反應(yīng)評(píng)估結(jié)果,為控制藥品使用風(fēng)險(xiǎn)而采取的積極應(yīng)對(duì)措施。由表3可見,說(shuō)明書修訂內(nèi)容主要涉及增加警示語(yǔ)、完善藥品不良反應(yīng)、注意事項(xiàng)及禁忌等項(xiàng)目,意義非常重大。本次調(diào)查表明,部分廠家對(duì)藥品說(shuō)明書的修訂工作不重視應(yīng)該引起有關(guān)管理部門的足夠關(guān)注,確保這項(xiàng)保障患者用藥安全的民生工程得到持續(xù)、健康發(fā)展。
另外,《藥品說(shuō)明書和標(biāo)簽管理規(guī)定》[1]明確指出:藥品生產(chǎn)企業(yè)應(yīng)主動(dòng)跟蹤藥品上市后的安全性、有效性;如果藥品生產(chǎn)企業(yè)未及時(shí)修訂說(shuō)明書或未將藥品不良反應(yīng)在說(shuō)明書中充分說(shuō)明的,應(yīng)承擔(dān)由此引發(fā)的不良后果;而且藥品生產(chǎn)企業(yè)有責(zé)任將修改的內(nèi)容通知相關(guān)藥品經(jīng)營(yíng)企業(yè)及使用單位。本次調(diào)查還對(duì)多名醫(yī)務(wù)人員對(duì)藥品說(shuō)明書修訂工作的知曉情況進(jìn)行調(diào)查,參與調(diào)查的醫(yī)務(wù)人員均表示未收到過(guò)生產(chǎn)企業(yè)藥品說(shuō)明書修訂的通知及有關(guān)信息提醒;當(dāng)然,也就很難起到及時(shí)提醒醫(yī)務(wù)人員指導(dǎo)患者安全用藥的目的。
4 建議
上市藥品說(shuō)明書受醫(yī)學(xué)倫理學(xué)的限制,以及藥品臨床研究階段研究對(duì)象數(shù)量少、時(shí)間短、目的單一的局限,再加上科技發(fā)展水平和人們認(rèn)知的時(shí)限性以及生產(chǎn)企業(yè)的產(chǎn)品上市緊迫性等因素的影響,上市前的藥品研究不可能非常完整,說(shuō)明書信息也就不會(huì)非常完整[3-4],因此上市后藥品說(shuō)明書規(guī)范修訂意義重大。一方面,需要國(guó)家有關(guān)管理部門采取更加強(qiáng)有力的措施,加強(qiáng)上市后藥品說(shuō)明書修訂工作的監(jiān)管,以確保藥品說(shuō)明書內(nèi)容的完整性及科學(xué)性;另一方面,藥品生產(chǎn)企業(yè)應(yīng)提高對(duì)說(shuō)明書修訂工作的認(rèn)識(shí),自覺(jué)規(guī)范上市后藥品說(shuō)明書修訂工作,并積極做好宣傳,以對(duì)產(chǎn)品、對(duì)患者高度負(fù)責(zé)的態(tài)度,實(shí)現(xiàn)企業(yè)更好的持續(xù)發(fā)展。另外,各級(jí)醫(yī)療機(jī)構(gòu)及藥品零售企業(yè)作為藥品使用的主體,也應(yīng)高度重視上市后藥品說(shuō)明書修訂工作。尤其對(duì)直接接觸藥品的藥學(xué)人員,加強(qiáng)對(duì)上市后藥品說(shuō)明書修訂內(nèi)容的的收集和宣傳,也是藥師參與合理用藥,體現(xiàn)和提升自身價(jià)值的一個(gè)非常好的切入點(diǎn)。
[1] 國(guó)家食品藥品監(jiān)督管理局.藥品說(shuō)明書和標(biāo)簽管理規(guī)定[S].國(guó)家食品藥品監(jiān)督管理局第24號(hào).2006-03-15.
[2] 江俊,宋民憲,唐冬蕾.超藥品說(shuō)明書用藥的法律責(zé)任研究[J].中藥與臨床,2014,5(2):87-89.
[3] 呂水利,張艷利.門診306種藥品說(shuō)明書內(nèi)容調(diào)查分析[J].臨床合理用藥,2014,7(1):157-158.
[4] 唐蕾,韋炳華,何秋毅,等.超說(shuō)明書用藥的現(xiàn)狀及其法律風(fēng)險(xiǎn)[J].中國(guó)藥房,2014,25(45):4225-4228.
本文編輯:魯守琴
Investigation and Analysis on Implementation of Revision of Package Inserts Informed by CFDA in a County in Shandong Province, China
Li Guang-rui, Qiu Su-min, Gao Meng-meng, Bi Ji-hong, Sun Cheng-zhen
(Jinxiang People’s Hospital Aff liated to Jining Medical College, Shandong Jining, 272200, China)
Objective:To investigate the revision of post-marketing package inserts so as to provide a reference for strengthening the supervision of package inserts.Methods:According to the relevant notifications about the revisions of package inserts issued on the CFDA website from 2011 to 2013, the package inserts used in medical institutions at various levels in a county in Shandong Province, China were checked and analyzed.Results:Of the 70 package inserts, 57 (81.43%) were revised based on CFDA standard. Unrevised package inserts were existed in both Chinese patent drugs and chemical drugs.Conclusion:The relevant departments, pharmaceutical manufacturers and medical institutions should attach great importance to the revision and implementation of post-marketing package inserts so as to achieve the goal of safe and rational drug use.
Package insert; Post-marketing; Revision; Investigation
R926
A
10.3969/j.issn.2096-3327.2017.02.016
2016 - 10 - 18
李廣瑞,男,碩士,主管藥師。研究方向:醫(yī)院藥事管理。通訊作者E-mail:lgr0537@126.com

