HOXA3在乳腺癌組織中的表達及其對患者預后、細胞生物學特性的影響
房德芳,石微,房新建,蘇瓊
(1江蘇省連云港中醫藥高等職業技術學校,江蘇連云港222006;2連云港市第二人民醫院)
HOXA3在乳腺癌組織中的表達及其對患者預后、細胞生物學特性的影響
房德芳1,石微1,房新建2,蘇瓊1
(1江蘇省連云港中醫藥高等職業技術學校,江蘇連云港222006;2連云港市第二人民醫院)
目的研究同源盒基因3(HOXA3)在乳腺癌組織中的表達及其對患者預后、乳腺癌細胞生物學的影響。方法用qPCR法檢測30例乳腺癌組織、癌旁組織中HOXA3 mRNA,同時對TCGA數據庫中的患者根據HOXA3平均值分為HOXA3高表達與低表達,并通過生存分析比較生存率與轉移率的差異。乳腺癌細胞系MCF-7隨后分為CON、siRNA1、siRNA2組,分別轉染無效siRNA、HOXA3 siRNA1、HOXA3 siRNA2小干擾RNA,48 h后通過qPCR、Western blotting法檢測HOXA3 RNA和蛋白表達,篩選出干擾能力較強的siRNA后,將siRNA轉染至MCF-7細胞中,以轉染無效siRNA為CON組,使用Transwell與CCK8檢測細胞遷移與增殖變化,并使用Western blotting法檢測EMT標記物Snail、N-cadherin、Vimentin、E-cadherin蛋白。結果HOXA3 mRNA在癌及癌旁組織中的相對表達量分別為17.50±1.44、1.0±0.05,二者比較,P<0.05。HOXA3蛋白在癌及癌旁組織中的相對表達量分別為13.42±0.18、2.57±0.04,二者比較,P<0.05。HOXA3高表達者整體生存率與轉移率均降低(P均<0.05)。轉染48 h后,CON組、siRNA1組、siRNA2組HOXA3 RNA相對表達量分別為1.0±0.12、0.62±0.01、0.16±0.03,三組比較,P均<0.05。CON組、siRNA2組遷移細胞數量分別為40.57±1.68、18.33±1.01,兩組比較,P<0.05;與CON組比較,siRNA2組增殖能力減弱,P<0.05。與CON組比較,siRNA2組E-cadherin蛋白表達升高(P<0.05),Vimentin、N-cadherin、Snail蛋白表達降低(P均<0.05)。結論HOXA3在乳腺癌患者癌組織中高表達,且與患者預后、轉移相關,同時HOXA3表達可減弱乳腺癌細胞遷移與增殖,這一作用可能與EMT有關。
乳腺癌;同源盒基因3;上皮-間質轉化;細胞轉移
乳腺癌是女性最為常見的癌癥之一,占新發病例的23%及致死病例的14%[1],目前來說,盡管對于乳腺癌的早期預防、對敏感基因如BRCA1的缺失進行檢測大大提高了乳腺癌患者的5年生存時間,乳腺癌的轉移依然成為一個亟待解決的問題[2]。乳腺癌轉移是一個極其復雜的過程,基本步驟包括癌細胞侵襲周圍組織,并通過內滲進入到循環系統,癌細胞隨后堵塞于毛細血管中,并通過外滲進入到遠隔器官中[3],在這一過程中,主要的3個步驟內滲、外滲、遠隔器官的生長均需癌細胞能適應相應的微環境,同時能通過上皮-間質(EMT)、間質-上皮(MET)轉換實現侵襲與增殖能力的增加,EMT指細胞具有極性的上皮細胞轉變為間質細胞的過程,EMT后的類間質細胞侵襲、遷移能力明顯增強,同時侵入性偽足形成增多,使得細胞對細胞外基質(ECM)降解能力增強形成[4],因此EMT過程亦被視為乳腺癌、卵巢癌等癌癥細胞侵襲的重要環節,因此尋找EMT中的關鍵蛋白,并開發特異的抑制劑,從而達到靶向治療的效果已成為研究熱點。同源盒(HOX)基因是一類高度保守并在胚胎發育中發揮重要作用的蛋白,HOX基因共有39種,分為A、B、C、D四類,HOX的主要功能為調控細胞分裂、黏附、增殖與分化[5],HOX基因的異常表達已在多種腫瘤中如前列腺癌[6]、結腸癌[7]、肺癌[8]等癌癥中得到證實,在乳腺癌中,HOXA5、HOXA9與p53、BRCA1的調節相關[9],而HOXA1則與乳腺癌細胞的遷移、他莫昔芬治療抵抗相關[10],而HOXA3在乳腺癌細胞中的表達及作用則尚未見報道。
1 材料與方法
1.1 材料 30例人乳腺癌樣本及其相應癌旁組織來自連云港市第二人民醫院,樣本收集過程得到連云港市第二人民醫院倫理委員會批準,人乳腺癌細胞系MCF-7購自北京協和醫學院實驗中心,siRNA由美國Invitrogen公司合成,脂質體購自美國Invitrogen公司,TRIzol購自美國Invitrogen公司,RNA反轉錄試劑盒與Takara SYBR Premix Ex Taq檢測試劑盒購自大連寶生生物公司(Takara),Transwell小室購自美國Corning公司,HOXA3一抗購自美國Abcam公司,EMT標記物Snail、N-cadherin、Vimentin、 E-cadherin一抗購自美國Cell Signal Technology公司,二抗均購自北京中杉金橋公司,CCK8試劑盒購自日本Dojindo公司。
1.2 細胞培養 人乳腺癌細胞系MCF-7培養于37 ℃、5%CO2孵箱中,培養基為DMEM+10%FBS,將細胞分為CON、siRNA1、siRNA2組,分別使用脂質體轉染無效siRNA、siRNA1、siRNA2小干擾RNA,CON序列為5′-AAUUCUCCGAACGUGUCACGU-3′ ,siRNA1序列為GCATCTTGGCTGTCTGCTAAA,siRNA2序列為GTGTCAAACCCCTGTCAGAGT,脂質體轉染步驟根據Invitrogen公司說明書進行。
1.3 HOXA3 mRNA表達檢測 采用Q-RT-PCR法。細胞總RNA提取使用酚-氯仿抽提法。細胞使用TRIzol裂解后,加入0.5倍體積氯仿,劇烈震蕩后15 000 r/min、離心15 min,取上清。加入等體積異丙醇,冰上沉淀20 min后,12 000 r/min離心10 min,取沉淀。沉淀用75%乙醇洗2次,即得到細胞總RNA。細胞總RNA隨后使用Takara 反轉錄試劑盒反轉錄為cDNA,操作步驟根據Takara反轉錄試劑盒說明書進行,cDNA使用Takara SYBR Premix Ex Taq檢測試劑盒檢測,HOXA3引物序列: 5′-TGCTTTGTGTTTTGTCGAGACTC-3′,5′-CAACCCTACCCCTGCCAAC-3′,內參引物GAPDH:5′-TATGCTCTCCTCATGCATTG-3′,5′-GGGACGACCTTCGATCTACC-3′。使用2-ΔΔCt表示HOXA3 mRNA的表達。
1.4 HOXA3蛋白表達檢測 采用免疫印跡法。細胞經RIPA裂解液裂解后,加入相應體積的Loading buffer,煮沸10 min后,加入到聚丙烯酰胺膠中,濃縮膠80 V,電泳20 min,分離膠100 V電泳40 min,待溴酚藍跑至膠板底側時,裝配轉膜三明治,依次為黑板-濾紙-聚丙烯酰胺膠-活化的PVDF膜-濾紙-白板,濕法轉膜1 h后,5%脫脂奶粉封閉2 h,加入相應一抗(1∶1 000),4 ℃孵育過夜,并加入HRP耦聯的二抗,以GAPDH為內參,使用ECL發光液檢測蛋白的表達,蛋白的相對表達量=目的蛋白表達量/GAPDH表達量。
1.5 生存曲線繪制 乳腺癌患者生存曲線數據來源于TCGA公共數據庫,以患者基因表達水平的平均值分組,并使用R語言中survival 包進行生存分析,ggplot2包繪制生存曲線。
1.6 細胞遷移數檢測 采用Transwell 小室檢測細胞遷移能力,Transwell下室加入600 μL完全培養基(DMEM+10%FBS),上室加入含有1×106細胞的200 μL細胞懸液,14 h后,除去小室上方細胞,下方細胞使用結晶紫染色,顯微鏡20倍視野下對穿過小室的細胞進行計數,實驗重復3次并取平均值。
1.7 細胞增殖能力檢測 采用CCK8法,將MCF-7 CON、siRNA2細胞鋪于96孔板中,5 000/孔,同時設立復孔,待細胞貼壁后,加入0.1體積的CCK8試劑,避光37 ℃ 孵育 3 h后,使用酶標儀檢測OD450,以第0 h的度數為基準,計算24、48、72 h與0 h的比值,即細胞增殖系數。在確定乳腺癌患者HOXA3高表達且與預后相關后,將HOXA3 siRNA轉染至人乳腺癌細胞系MCF-7中,48 h后使用QPCR與Western blotting法檢測HOXA3 RNA與蛋白表達。
1.8 EMT標記物表達檢測 在乳腺癌細胞系MCF-7轉染CON(CON組)與HOXA3(HOXA3組)質粒48 h后,使用Western blotting法檢測EMT標記物Snail、N-cadherin、Vimentin、E-cadherin蛋白。
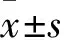
2 結果
2.1 HOXA3在乳腺癌及癌旁組織中表達比較 HOXA3 mRNA在癌及癌旁組織中的相對表達量分別為17.50±1.44、1.0±0.05,二者比較,P<0.05。HOXA3 蛋白在癌及癌旁組織中的相對表達量分別為13.42±0.18、2.57±0.04,二者比較,P<0.05。
2.2 HOXA3表達與預后間的關系 HOXA3高表達者總體生存率為79.35%、轉移生存率為62.38%,HOXA3低表達者總體生存率為89.63%、轉移生存率為73.26%,兩者比較,P均<0.05。
2.3 HOXA3高表達與乳腺癌細胞系MCF-7遷移和增殖的關系 48 h后CON組、siRNA1組、siRNA2組HOXA3 RNA相對表達量分別為1.0±0.12、0.62±0.01、0.16±0.03,三組比較,P均<0.05。在HOXA3蛋白水平上siRNA1、CON組比較無統計學差異,siRNA2組降低(P<0.05),因此僅使用siRNA2進行后續實驗。siRNA2轉染至MCF-7 48 h后,使用Transwell檢測遷移的變化,結果顯示CON組、siRNA2組遷移細胞數分別為40.57±1.68、18.33±1.01,兩組比較,P<0.05;而在轉染48 h后使用CCK8檢測增殖能力變化,siRNA2組增殖減弱,且在48、72 h時差異均有統計學意義,P均<0.05。
2.4 EMT標記物表達比較 與CON相比,E-cadherin表達升高,Vimentin、N-cadherin、Snail表達均降低,P均<0.05。
3 討論
乳腺癌的轉移能顯著降低患者生存率、影響患者預后,而多項研究均表明乳腺癌的轉移與EMT密切相關,因此尋找EMT中的關鍵基因并給予靶向治療成為研究熱點。HOX是一類保守的蛋白,盡管如此,HOX對于EMT的作用已有證實,在神經性膠質瘤中,HOXA13被證實能通過激活wnt與TGF-β通路從而促進EMT的發生和影響患者的預后[11],以往對乳腺癌中HOX家族的研究包括HOXA3、HOXA9、HOXB5、HOXB9等,其中HOXB5與乳腺癌細胞的EMT特性和侵襲、增殖能力密切相關[12],HOXA3在結腸癌[13]、膠質瘤[14]及惡性淋巴瘤中[15]已被證實表達增高且與疾病的預后相關,而HOXA3在乳腺癌中表達情況鮮有報道。
在本研究中,首先檢測30例乳腺癌患者中癌組織、癌旁組織的HOXA3表達水平,證實了HOXA3在乳腺癌組織中的表達顯著升高,隨后調取TCGA數據庫中乳腺癌患者信息,使用平均值將患者分為HOXA3高表達與低表達組,在對患者總體生存率以及轉移率進行生存分析后發現,HOXA3的高表達使得患者總體生存率、轉移生存率均降低,初步證實了HOXA3的高表達與患者的預后、轉移密切相關。在確定了HOXA3的異常表達后,構建了HOXA3特異性的siRNA,通過QOCR、Western blotting確定HOXA3 siRNA在RNA和蛋白水平的敲低效果,結果表明siRNA2在RNA和蛋白水平均具有更好的敲低效果,因此隨后將siRNA2轉染至乳腺癌細胞系MCF-7中,48 h后使用Transwell與CCK8檢測細胞增殖的變化,結果表明HOXA3的抑制使得MCF-7細胞遷移能力降低、增殖受限,進一步證實了HOXA3對于乳腺癌細胞的遷移、增殖起到重要作用,而隨后檢測EMT相關標記物Snail、N-cadherin、Vimentin、E-cadherin的變化后發現,E-cadherin表達升高,Snail、N-cadherin、Vimentin表達降低,表明HOXA3對乳腺癌細胞增殖、遷移能力的影響與對EMT的作用相關,Knight等[13]研究結果表明,HOXA3在結腸癌中表達增高,與結腸癌細胞的EMT特性和侵襲、增殖能力密切相關,與本研究結果相似。
綜上所述,HOXA3在乳腺癌患者癌組織中高表達,且與患者預后、轉移相關,同時HOXA3可減弱乳腺癌細胞遷移、增殖,而這一作用可能與EMT有關。
[1] Narod SA, Iqbal J, Giannakeas V. Breast cancer mortality after a diagnosis of ductal carcinoma in situ[J]. JAMA Oncol, 2015 ,1(7):888-896.
[2] Gambino G, Tancredi M, Falaschi E. Characterization of three alternative transcripts of the BRCA1 gene in patients with breast cancer and a family history of breast and/or ovarian cancer who tested negative for pathogenic mutations[J]. Int J Mol Med, 2015,35(4):950-956.
[3] Wagenblast E, Soto M, Gutiérrez-ngel S. A model of breast cancer heterogeneity reveals vascular mimicry as a driver of metastasis[J]. Nature, 2015,520(7547):358-362.
[4] Pignatelli J, Tumbarello DA, Schmidt RP. Hic-5 promotes invadopodia formation and invasion during TGF-β-induced epithelial-mesenchymal transition[J]. J Cell Biol, 2012,197(3):421-437.
[5] Hur H, Lee JY, Yun HJ. Analysis of HOX gene expression patterns in human breast cancer[J]. Mol Biotechnol, 2014,56(1):64-71.
[6] Javed S, Langley SE. Importance of HOX genes in normal prostate gland formation, prostate cancer development and its early detection[J]. BJU Int, 2014,113(4):535-540.
[7] 嚴東旺,于振海,王冬清,等.同源異形盒基因HOXB7在結腸癌中的表達及臨床意義[J].中華實驗外科雜志,2013,30(3):438-440.
[8] 李勁松,韓亮,于洋,等.HOXB7對人非小細胞肺癌A549細胞增殖的影響[J].腫瘤防治研究,2015,42(11):1119-1123.
[9] Conway K, Edmiston SN, May R. DNA methylation profiling in the carolina breast cancer study defines cancer subclasses differing in clinicopathologic characteristics and survival[J]. Breast Cancer Res, 2014,16(5):450.
[10] Wang X, Li Y, Qi W. MicroRNA-99a inhibits tumor aggressive phenotypes through regulating HOXA1 in breast cancer cells[J]. Oncotarget, 2015,6(32):32737-32747.
[11] Duan R, Han L, Wang Q. HOXA13 is a potential GBM diagnostic marker and promotes gliomainvasion by activating the Wnt and TGF-β pathways[J]. Oncotarget, 2015,6(29):27778-27793.
[12] Lee JY, Hur H, Yun HJ. HOXB5 promotes the proliferation and invasion of breast cancer cells[J]. Int J Biol Sci, 2015,11(6):701-711.
[13] Knight JM, Kim E, Ivanov I. Comprehensive site-specific whole genome profiling of stromal and epithelial colonic gene signatures in human sigmoid colon and rectal tissue[J]. Physiol Genomics, 2016,48(9):651-659.
[14] Di Vinci A, Casciano I, Marasco E. Quantitative methylation analysis of HOXA3, 7, 9, and 10 genes in glioma: association with tumor WHO grade and clinical outcome[J]. J Cancer Res Clin Oncol, 2012,138(1):35-47.
[15] Han B, Lian L, Li X. Chicken gga-miR-130a targets HOXA3 and MDFIC and inhibits Marek′s disease lymphoma cell proliferation and migration[J]. Mol Biol Rep, 2016,43(7):667-676.
10.3969/j.issn.1002-266X.2017.47.020
R736.3
B
1002-266X(2017)47-0066-03
2017-07-10)

