脊髓小腦共濟失調3型發病機制研究進展
張 帆 史長河 許予明 張化彪(通訊作者)
鄭州大學第一附屬醫院 鄭州 450002
脊髓小腦共濟失調3型發病機制研究進展
張 帆 史長河 許予明 張化彪(通訊作者)
鄭州大學第一附屬醫院 鄭州 450002
共濟失調;Ataxin-3;發病機制
脊髓小腦共濟失調3型(Spinocerebellar ataxia type 3,SCA3)又稱為馬查德約瑟夫病(Machado-Joseph Disease,MJD),是我國遺傳性共濟失調(Hereditary Ataxia,HA)中最常見的亞型,約占所有遺傳性共濟失調的60%,其患病率為3~5/10萬,僅我國就有4萬余名患者[1-2]。該病以進展性小腦型共濟失調為主要臨床表現,主要包括步態不穩、肢體搖晃、動作準確性變差等,可伴眼外肌麻痹、吞咽困難、舌肌纖顫、錐體征及錐體外系征等其他臨床表現[3-4],多數患者在起病后10~20 a內失去運動能力。目前此類疾病的常規治療只能改善臨床癥狀,缺乏有效治療手段,給患者及其家庭造成極大的軀體、精神和經濟負擔,因此對脊髓小腦共濟失調3型發病機制進行深入研究,尋找新的治療靶點具有重要意義,本文就其致病基因、致病蛋白、包涵體形成、Ataxia-3毒性片段形成、蛋白質質量控制系統異常、轉錄異常、線粒體功能異常、RNA異常等方面做一簡要綜述。
1 SCA3的致病基因和致病蛋白Ataxin-3
1.1 致病基因—Ataxin-3基因 SCA3是一種常染色體顯性遺傳病,由Ataxin-3基因(又稱為MJD1基因)突變所致。1994年,日本科學家Yoshiya Kawaguchi等[5]首先發現并報道了Ataxin-3基因。Ataxia-3基因位于14號染色體長臂,含有11個外顯子,其10號外顯子中有一段CAG重復序列(圖1)[6]。正常人Ataxin-3基因CAG重復次數為12~44次,當CAG重復次數≥52次時,即會發病,而當CAG重復次數在45~51次時,疾病不完全外顯(即可能會發病或發病時癥狀不典型)[7-8],因其由CAG重復過多而使其翻譯形成過長的多聚谷氨酰胺鏈而致病,故SCA3是一種多聚谷氨酰胺病。
1.2 致病蛋白—Ataxin-3蛋白 Ataxia-3蛋白是一種廣泛表達的去泛素化酶,分子量約42 kDa(千道爾頓),因多聚谷氨酰胺鏈長短不一,分子量會有所差異,該蛋白具有3個重要結構:Josephin結構域、泛素結合區(ubiquitin interacting motifs,UIM)和PolyQ序列(圖1)。其Josephin 結構域具有去泛素化酶活性,UIM結構域則可特異地識別并結合泛素化的蛋白底物。Ataxia-3通過其UIM結構特異識別泛素化的蛋白底物,進而通過其Josephin結構域發揮去泛素化酶活性,使與其結合的底物去泛素化,調節底物蛋白的活性和穩定性[9-10]。Ataxia-3的PolyQ結構為其致病突變直接調控的結構,可抑制組蛋白乙酰化過程而調節轉錄過程。
2 發病機制
目前SCA3確切發病機制仍不十分清楚,下面將從包涵體形成、Ataxia-3毒性片段形成、轉錄異常、RNA異常、蛋白質質量控制系統異常、線粒體功能異常等方面進行敘述(圖2)。
2.1 包涵體形成 神經元內廣泛的包涵體形成是SCA3病人及動物模型最早發現的特征病理改變,主要位于細胞核內,此外軸突內亦可形成少量包涵體[11-12]。軸突內的包涵體可干擾神經元的軸漿運輸,進而導致神經元功能受損;而核內包涵體形成的意義目前仍存在較大爭議;有研究提示包涵體具有毒性作用,神經元內包涵體形成的多少與疾病嚴重程度成相關,包涵體中成分復雜,其中包括泛素、蛋白酶體組分、分子伴侶、轉錄因子、正常Ataxia-3蛋白等細胞內必需組分,這些重要物質聚集在包涵體內,不能正常發揮相應功能,進而影響細胞內多種代謝過程,導致細胞內環境紊亂[12-13];但也有學者認為包涵體形成具有保護作用,可將毒性蛋白聚集到包涵體中,避免對細胞的進一步損傷[11]。目前認為包涵體形成是由突變的Ataxia-3蛋白裂解而促發。
2.2 Ataxia-3毒性片段的形成 Ataxia-3蛋白可被鈣蛋白酶(Calpain)裂解形成C端片段和N端片段,其中polyQ位于C端片段,正常情況下C端片段及N端片段均可被降解,不會聚集形成包涵體;突變的Ataxia-3被calpain裂解后,其含延長的polyQ的C-端片段形成不溶性的核內包涵體。體內動物實驗發現抑制鈣蛋白酶的活性可減少SCA3小鼠動物模型的包涵體形成,緩解其神經系統退行性變;增強鈣蛋白酶的活性,則使SCA3小鼠模型的神經系統退行性變加重[14-15]。相應的體外實驗顯示增加鈣蛋白酶的活性可促進Ataxia-3 C端毒性片段形成,使不溶性聚集體形成增加,并導致細胞凋亡增加[16]。且相對于全長的Ataxia-3蛋白裂解后形成含延長的polyQ的C端片段具有更強的毒性,故可將含延長polyQ的Ataxia-3的 C端片段視為毒性片段[14-16]。
2.3 轉錄異常 轉錄異常被認為在SCA3發病過程中起重要作用。在SCA3發病過程中,轉錄因子可被結合到核內包涵體中,使轉錄因子水平下調,不能發揮正常的轉錄調控功能,引起轉錄異常[17]。此外,突變的Ataxia-3失去對組蛋白乙酰化的抑制,組蛋白乙酰化水平升高,引起轉錄異常[18]。有研究顯示,突變的Ataxia-3蛋白后,其亮氨酸拉鏈結構與DNA雙鏈的GAGGAA富集區相互作用異常,影響轉錄[19-22]。Chou等[23]利用SCA3小鼠模型對腦組織進行轉錄組學研究,結果表明:谷氨酸能神經遞質傳遞相關的基因、熱休克蛋白(Heat Shock Protein,HSP)、調控神經細胞存活及分化的轉錄因子、伽馬氨基丁酸受體亞基等的轉錄水平下調;介導神經細胞死亡的Bax、細胞周期蛋白D1等基因的轉錄水平上調。但SCA3疾病動物模型的轉錄情況和SCA3病人并不完全相同,轉錄異常的確切機制有待進一步研究。
2.4 RNA異常 在SCA3發病進展過程中,多種ataxia-3相關RNA存在異常。
Ataxia-3基因的CAG重復序列可編碼含CUG重復序列的RNA。Li等[24]的研究表明,含過長CUG重復序列的RNA片段本身有毒性作用,在果蠅模型中,轉錄含過長CUG重復序列的RNA,可導致果蠅神經功能退化。進一步研究顯示,含過長CUG重復序列的RNA可形成發夾樣結構,并和MBNL1(Muscleblind Like 1)在細胞核中共定位,提示其可將MBNL1募集到細胞核中,使MBNL1介導的RNA可變性剪接發生異常,進而導致下游蛋白表達異常,并導致細胞功能異常[25]。
microRNA是一類內源性非編碼的線性小RNA,通過與靶基因信使RNA(Manage RNA,mRNA)3’端非編碼區特異性結合,調控靶基因表達。在SCA3病人血液中,發現miR-34b水平相比于正常人上調,miR-29a、miR25、miR-125b表達水平相比于正常人下調,提示miRNA參與SCA3發病過程[26]。此外,在SCA3動物模型中,抑制miRNA的表達,可加重動物模型的神經功能缺損和病例改變;在SCA3細胞系中,阻斷miRNA可使Ataxia-3的毒性增加,并使細胞凋亡增加,提示干預miRNA可作為潛在靶點,但具體機制及干預方式仍需進一步研究[27]。
此外,非ATG起始的翻譯過程、雙向轉錄等使神經細胞產生多種異常的毒性產物(如聚丙氨酸、聚絲氨酸等),亦可能在SCA3發病中起到一定作用,影響神經細胞功能,但相關研究少,具體機制仍不明確[28]。
2.5 蛋白質質量控制系統異常 SCA3主要通過影響分子伴侶系統、內質網有關降解途徑、泛素-蛋白酶體系統(ubiquitin-proteasome system,UPS)及自噬溶酶體通路(autophagy-lysosome pathway)等途徑影響蛋白質降解過程。
熱休克蛋白在調控蛋白質質量控制系統,介導蛋白質聚集及解聚,維持細胞內環境穩定等方面起重要作用[29]。在多種多聚谷氨酰胺病中,均發現在疾病早期熱休克蛋白表達上調,增加錯誤折疊蛋白的在細胞中的溶解度,減少其聚集,而隨著疾病進展,熱休克蛋白的水平持續下調[30-31]。在SCA3病人腦組織中,發現HSP40、HSP90在包涵體中和Ataxia-3共定位;而在SCA3動物模型中,可見HSP40、HSP70的表達水平下調;此外,在SCA3病人來源的成纖維細胞中,發現HSP40的表達水平和SCA3的發病年齡相關聯;而在SCA3細胞模型中過表達HSP40時,神經細胞內的包涵體形成減少,可見熱休克蛋白在SCA3發病過程中起重要作用,上調熱休克蛋白可作為潛在的治療策略[23,32- 33]。
Ataxin 3參與調節內質網錯誤折疊蛋白的降解。VCP/p97蛋白(valosin-containing protein,VCP)可使內質網中錯誤折疊的分泌型蛋白離開內質網,并在蛋白酶體中降解,這一過程稱為內質網有關降解途徑(endoplasmic reticulum associated degradation,ERAD)[34]。Ataxia-3可與VCP/p97結合,形成Ataxin 3-VCP/p97復合體,參與ERAD過程,調控內質網錯誤折疊蛋白的降解[35]。突變的Ataxia-3蛋白可影響ERAD過程,突變的Ataxia-3與VCP/p97之間結合力增加,影響VCP/p97的底物蛋白從內質網中脫離,使VCP/p97的底物蛋白難以被轉運至蛋白酶體降解,最終導致內質網錯誤折疊蛋白降解的異常,即ERAD異常[36]。
泛素-蛋白酶體系統的功能在SCA3中受損。對于突變的Ataxia-3,其去泛素化活性并無明顯改變,但部分蛋白酶體組分被聚集在包涵體中,使蛋白酶體功能異常[37-38]。此外,泛素E3連接酶CHIP、Parkin在SCA3中表達下調,CHIP和Parkin均有神經保護作用。突變的Ataxia-3蛋白使Parkin的泛素化水平降低,促使Parkin通過細胞自噬途徑降解增加,當Ataxia-3聚集形成包涵體時,可與Parkin結合使其進入包涵體中,導致細胞內Parkin量降低,Parkin底物降解異常[39- 40]。一些研究表明,突變的Ataxia-3與CHIP親和力增加,在SCA3動物模型中,CHIP表達下調,使CHIP的底物蛋白降解異常,但其具體機制尚不明確[40-41]。
自噬溶酶體通路在降解大分子蛋白復合物及維持細胞內環境穩定的過程中起重要作用。一系列研究表明,自噬溶酶體通路在SCA3中受損[42-43]。Beclin1在自噬通路中起重要作用,在SCA3小鼠模型中,受累腦區Beclin1含量減少;過表達Beclin1,激活自噬系統,可緩解SCA3小鼠模型的神經功能缺損并減少神經元內包涵體形成,提示自噬異常在SCA3發病過程中起重要作用,調控自噬通路可作為潛在的治療靶點[42-43]。
2.6 線粒體功能異常與細胞凋亡 既往研究表明,在亨廷頓病、脊髓小腦共濟失調7型等多種polyQ疾病中,均存在線粒體能量代謝異常[44-45]。在SCA3細胞模型及動物模型中,亦發現細胞能量代謝障礙,其線粒體呼吸鏈復合體活性降低,導致自由基清除能力降低,自由基大量蓄積,一方面導致線粒體DNA損傷,DNA拷貝數降低,另一方面導致氧化壓力增加,最終促發細胞凋亡[46-47]。在SCA3患者受累腦區進行病理染色,亦可見細胞凋亡的表現如核固縮、凋亡小體形成。目前關于線粒體功能異常及細胞凋亡在SCA3發病過程中所起到的作用仍不十分明確,有學者認為抗氧化治療可能在SCA3治療中起一定作用,但具體機制仍需要進一步研究。
3 總結與展望
SCA3目前發病機制尚未明確,現主要通過對癥治療提高患者的生活質量。而隨著科學的發展,隨著人類對這一疾病機制研究的不斷深入,隨著基因治療、細胞治療等新的治療方式出現,必將為疾病治療提供了新的思路,更有效的治療靶點也會被不斷發現。相信在不久的將來,人類對這一疾病定能找到更好的治療辦法。
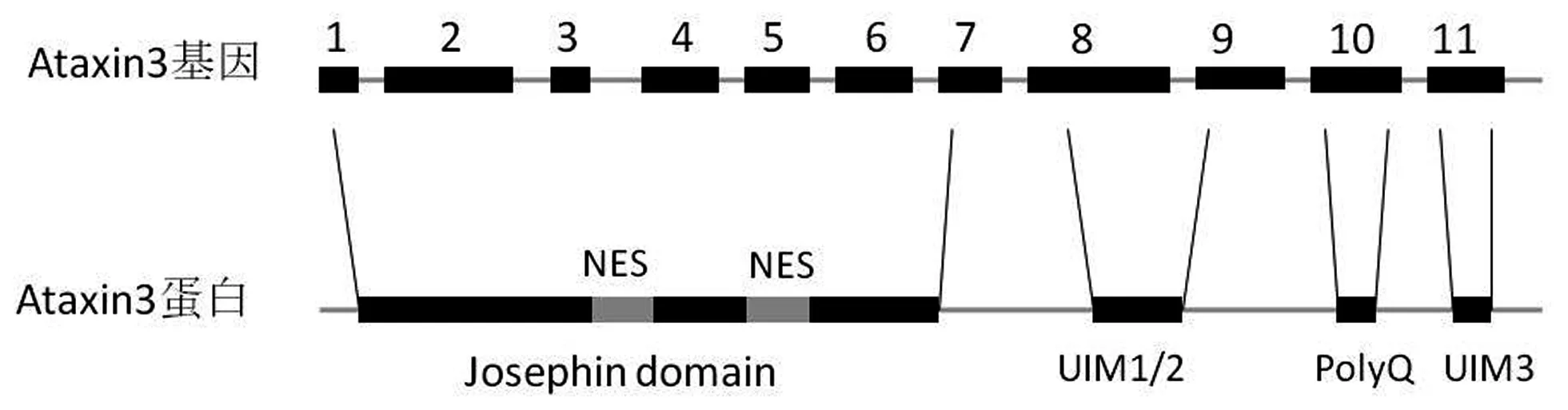
圖1 Ataxin3基因及Ataxin3蛋白的基本結構
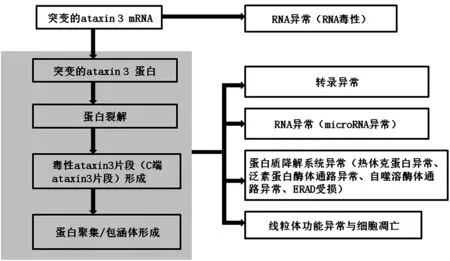
圖2 SCA3發病機制模式圖
[1] Gan SR,Shi SS,Wu JJ,et al.High frequency of Machado-Joseph disease identified in southeastern Chinese kindreds with spinocerebellar ataxia[J].BMC Med Genet,2010,11:47.
[2] Tang B,Liu C,Shen L,et al.Frequency of SCA1,SCA2,SCA3/MJD,SCA6,SCA7,and DRPLA CAG trinucleotide repeat expansion in patients with hereditary spinocerebellar ataxia from Chinese kindreds[J].Arch Neurol,2000,57(4):540-544.
[3] Riess O,Rub U,Pastore A,et al.SCA3:neurological features,pathogenesis and animal models[J].Cerebellum,2008,7(2):125-137.
[4] Rosenberg RN.Machado-Joseph disease:an autosomal dominant motor system degeneration[J].Mov Disord,1992,7(3):193-203.
[5] Kawaguchi Y,Okamoto T,Taniwaki M,et al.CAG expansions in a novel gene for Machado-Joseph disease at chromosome 14q32.1[J].Nat Genet,1994,8(3):221-228.
[6] Heilig R,Eckenberg R,Petit JL,et al.The DNA sequence and analysis of human chromosome 14[J].Nature,2003,421(6 923):601-607.
[7] Evers MM,Toonen LJ,van Roon-Mom WM.Ataxin-3 Protein and RNA Toxicity in Spinocerebellar Ataxia Type 3:Current Insights and Emerging Therapeutic Strategies[J].Mol Neurobiol,2014,49(3):1 513-1 531.
[8] Padiath QS,Srivastava AK,Roy S,et al.Identification of a novel 45 repeat unstable allele associated with a disease phenotype at the MJD1/SCA3 locus[J].Am J Med Genet B Neuropsychiatr Genet,2005,133B(1):124-126.
[9] Burnett B,Li F,Pittman RN.The polyglutamine neurodegenerative protein Ataxin-3 binds polyubiquitylated proteins and has ubiquitin protease activity[J].Hum Mol Genet,2003,12(23):3 195-3 205.
[10] Masino L,Musi V,Menon RP,et al.Domain architecture of the polyglutamine protein Ataxin-3:a globular domain followed by a flexible tail[J].FEBS Lett,2003,549(1-3):21-25.
[11] Seidel K,den Dunnen WFA,Schultz C,et al.Axonal inclusions in spinocerebellar ataxia type 3[J].Acta Neuropathologica,2010,120(4):449-460.
[12] Paulson HL,Perez MK,Trottier Y,et al.Intranuclear inclusions of expanded polyglutamine protein in spinocerebellar ataxia type 3[J].Neuron,1997,19(2):333-344.
[13] Chai Y,Wu L,Griffin JD,et al.The role of protein composition in specifying nuclear inclusion formation in polyglutamine disease[J].J Biol Chem,2001,276(48):44 889-44 897.
[14] Simoes AT,Goncalves N,Koeppen A,et al.Calpastatin-mediated inhibition of calpains in the mouse brain prevents mutant Ataxin 3 proteolysis,nuclear localization and aggregation,relieving Machado-Joseph disease[J].Brain,2012,135(8):2 428-2 439.
[15] Hubener J,Weber JJ,Richter C,et al.Calpain-mediated Ataxin-3 cleavage in the molecular pathogenesis of spinocerebellar ataxia type 3(SCA3)[J].Hum Mol Genet.,2013,22(3):508-518.
[16] Koch P,Breuer P,Peitz M,et al.Excitation-induced Ataxin-3 aggregation in neurons from patients with Machado-Joseph disease[J].Nature,2011,480(7 378):543-546
[17] Perez MK,Paulson HL,Pendse SJ,et al.Recruitment and the role of nuclear localization in polyglutamine-mediated aggregation[J].J Cell Biol,1998,143(6): 1 457-1 470.
[18] Evert B O,Araujo J,Vieira-Saecker AM,et al.Ataxin-3 Represses Transcription via Chromatin Binding,Interaction with Histone Deacetylase 3,and Histone Deacetylation[J].J Neurosci,2006,26(44):11 474-11 486.
[19] Li F,Macfarlan T,Pittman RN,et al.Ataxin-3 is a histone-binding protein with two independent transcriptional corepressor activities[J].J Biol Chem,2002, 277(47):45 004-45 012.
[20] Araujo J,Breuer P,Dieringer S,et al.FOXO4-dependent upregulation of superoxide dismutase-2 in response to oxidative stress is impaired in spinocerebellar ataxia type 3[J].Human Molecular Genetics,2011,20(15): 2 928-2 941.
[21] Wang G,Sawai N,Kotliarova S,et al.Ataxin-3,the MJD1 gene product,interacts with the two human homologs of yeast DNA repair protein RAD23,HHR23A and HHR23B[J].Hum Mol Genet,2000, 9(12):1 795-1 803.
[22] Landschulz WH,Johnson PF,Mcknight SL.The leucine zipper:a hypothetical structure common to a new class of DNA binding proteins[J].Science,1988,240(4860):1 759-1 764.
[23] Chou A,Yeh T,Ouyang P,et al.Polyglutamine-expanded Ataxin-3 causes cerebellar dysfunction of SCA3 transgenic mice by inducing transcriptional dysregulation[J].Neurobiol Dis,2008,31(1):89-101.
[24] Li L,Yu Z,Teng X,et al.RNA toxicity is a component of Ataxin-3 degeneration in Drosophila[J].Nature,2008,453(7198):1 107-1 111.
[25] Mykowska A,Sobczak K,Wojciechowska M,et al.CAG repeats mimic CUG repeats in the misregulation of alternative splicing[J].Nucleic Acids Research,2011,39(20):8 938-8 951.
[26] Shi Y,Huang F,Tang B,et al.MicroRNA profiling in the serums of SCA3/MJD patients[J].Int J Neurosci,2013,124(2):97-101.
[27] Bilen J,Liu N,Burnett BG,et al.MicroRNA pathways modulate polyglutamine-induced neurodegeneration[J].Mol Cell,2006,24(1):157-163.
[28] Zu T,Gibbens B,Doty NS,et al.Non-ATG-initiated translation directed by microsatellite expansions[J].Proc Natl Acad Sci U S A,2011,108(1):260-265.
[29] Kampinga HH,Bergink S.Heat shock proteins as potential targets for protective strategies in neurodegeneration[J].Lancet Neurol,2016,15(7):748-759.
[30] Muchowski PJ,Schaffar G,Sittler A,et al.Hsp70 and hsp40 chaperones can inhibit self-assembly of polyglutamine proteins into amyloid-like fibrils[J].Proc Natl Acad Sci U S A,2000,97(14):7 841-7 846.
[31] Huen NY,Chan HY.Dynamic regulation of molecular chaperone gene expression in polyglutamine disease[J].Biochem Biophys Res Commun,2005,334(4):1 074-1 084.
[32] Zijlstra MP,Rujano MA,Van Waarde MA,et al.Levels of DNAJB family members(HSP40)correlate with disease onset in patients with spinocerebellar ataxia type 3[J].Eur J Neurosci,2010,32(5):760-770.
[33] Ito N,Kamiguchi K,Nakanishi K,et al.A novel nuclear DnaJ protein,DNAJC8,can suppress the formation of spinocerebellar ataxia 3 polyglutamine aggregation in a J-domain independent manner[J].Biochem Biophys Res Commun,2016,474(4):626-633.
[34] Zhong X,Pittman RN.Ataxin-3 binds VCP/p97 and regulates retrotranslocation of ERAD substrates[J].Hum Mol Genet,2006,15(16):2 409-2 420.
[35] Wang Q,Li L,Ye Y.Regulation of retrotranslocation by p97-associated deubiquitinating enzyme Ataxin-3[J].J Cell Biol,2006,174(7):963-971.
[36] Wang Q,Li L,Ye Y.Regulation of retrotranslocation by p97-associated deubiquitinating enzyme Ataxin-3[J].J Cell Biol,2006,174(7):963-971.
[37] Chai Y,Koppenhafer SL,Shoesmith SJ,et al.Evidence for proteasome involvement in polyglutamine disease:localization to nuclear inclusions in SCA3/MJD and suppression of polyglutamine aggregation in vitro[J].Hum Mol Genet,1999,8(4):673-682.
[38] Winborn B J,Travis SM,Todi SV,et al.The deubiquitinating enzyme Ataxin-3,a polyglutamine disease protein,edits Lys63 linkages in mixed linkage ubiquitin chains[J].J Biol Chem,2008,283(39):26 436-26 443.
[39] Durcan TM,Kontogiannea M,Thorarinsdottir T,et al.The Machado-Joseph disease-associated mutant form of Ataxin-3 regulates parkin ubiquitination and stability[J].Human Molecular Genetics,2010,20(1):141-154.
[40] Durcan TM,Fon EA.Ataxin-3 and Its E3 Partners:Implications for Machado-Joseph Disease[J].Front Neurol,2013,4:46.
[41] Scaglione KM,Zavodszky E,Todi S V,et al.Ube2w and Ataxin-3 coordinately regulate the ubiquitin ligase CHIP[J].Mol Cell,2011,43(4):599-612.
[42] Nascimento-Ferreira I,Nobrega C,Vasconcelos-Ferreira A,et al.Beclin 1 mitigates motor and neuropathological deficits in genetic mouse models of Machado-Joseph disease[J].Brain,2013,136(7):2 173-2 188.
[43] Nascimento-Ferreira I,Santos-Ferreira T,Sousa-Ferreira L,et al.Overexpression of the autophagic beclin-1 protein clears mutant Ataxin-3 and alleviates Machado-Joseph disease[J].Brain,2011,134(5):1 400-1 415.
[44] Ajayi A,Yu X,Lindberg S,et al.Expanded Ataxin-7 cause toxicity by inducing ROS production from NADPH oxidase complexes in a stable inducible Spinocerebellar ataxia type 7(SCA7)model[J].BMC Neurosci,2012,13(1):86.
[45] Goswami A,Dikshit P,Mishra A,et al.Oxidative stress promotes mutant huntingtin aggregation and mutant huntingtin-dependent cell death by mimicking proteasomal malfunction[J].Biochem Biophys Res Commun,2006,342(1):184-190.
[46] Kazachkova N,Raposo M,Montiel R,et al.Patterns of Mitochondrial DNA Damage in Blood and Brain Tissues of a Transgenic Mouse Model of Machado-Joseph Disease[J].Neurodegener Dis,2013,11(4):206-214.
[47] Emerit J,Edeas M,Bricaire F.Neurodegenerative diseases and oxidative stress[J].Biomed Pharmacother,2004,58(1):39-46.
(收稿2016-11-14)
R744.7
A
1673-5110(2017)06-0124-05

