海洋酸化對青蛤免疫指標的影響
梁 健, 高 山, 李永仁, 殷 瀟, 劉金橋, 郭永軍, 閆喜武
(1. 天津農學院 水產學院, 天津市水產生態及養殖重點實驗室, 天津 300384; 2. 大連海洋大學, 遼寧省貝類良種繁育工程技術研究中心, 遼寧 大連 116023)
海洋吸收空氣中的二氧化碳形成碳酸, 增加海水的酸度, 這種現象稱為海洋酸化[1]。這是由Caldeira等[2]于2003年首次提出, 得到了科學界的廣泛關注, 成為當今國際海洋科學研究前沿領域的重要方向。同工業革命前的水平相比, 目前海洋的 pH降低0.1個單位, 據預測到 21世紀末期將持續降低0.3至0.5個單位, 到2300年大氣中增加的CO2濃度將會引起 pH 降低0.7個單位[1]。海洋酸化對海洋生態系統的平衡產生重大的影響, 可能導致物種組成(珊瑚、貝類、棘皮動物、甲殼動物和魚類等)發生變化。貝類作為主要的鈣化生物, 是近年來研究海洋酸化對生態系統的影響的主要對象。
貝類相對低等, 不能完成特異性免疫, 只能依靠血細胞完成非特異性免疫。貝類的非特異性免疫較為完善, 包括細胞免疫和體液免疫。細胞免疫的主要承擔者是血淋巴細胞, 參與了機體損傷的修復、貝殼的重建、吞噬異物顆粒和消除有毒物質等過程[3]。體液免疫的手段主要包括由血淋巴細胞分泌的各種水解酶類、非特異的抗菌膚類、高等動物細胞因子類似物、調理素和凝集素等[4]。
青蛤(Cyclina sinensis), 別稱赤嘴仔, 屬軟體動物門、雙殼綱、簾蛤目, 是我國沿海灘涂重要的經濟貝類之一。其味道鮮美, 營養價值高、生長快速、濾水效果好、抗逆性強、耐鹽范圍廣(8~37, 最適 15~25)、耐堿能力強(0~40 mmol/L)等特點, 深得沿海貝類養殖者的青睞, 形成較大規模的養殖產業。本實驗以通過設定兩組低pH條件(pH 7.7和pH 7.4)的酸化海水組, 并以正常海水pH做為對照, 探究酸化對青蛤免疫指標的影響, 從免疫學角度評估酸化對青蛤所造成的影響程度, 對預測青蛤養殖業和物種本身的未來發展趨勢提供一定的依據。
1 材料與方法
1.1 材料
青蛤取自天津獨流減河河口, 個體健康、大小相似, 平均殼長34.13 mm±0.61 mm (n=400)。在室內暫養 7 d后進行實驗, 養殖用水為砂濾海水, 鹽度 25,溫度25~28, ℃暫養期間連續充氧, 每天全量換水1次, 投喂小球藻。暫養后選擇閉殼能力強、反應迅速的個體作為試驗用貝。
1.2 酸化條件的建立
通過像水體中通入 CO2的方法來模擬海洋酸化的過程。使用氣體質量流量控制器和積算儀(七星華創電子股份有限公司)精確控制 CO2通入量, 維持養殖水槽(400 L)中海水pH值在所設定的范圍內。實驗所用水槽均配有獨立的循環過濾系統以達到去除糞便、降低氨氮和凈化水質, 并加有充氣設備。CO2通過水族缸使用的氣體細化器充入海水中, 溶解充分提高酸化效率。
1.3 實驗方法
建立酸化實驗組以模擬 2100年和 2300年海洋所達到的海水pH (分別為7.7、7.4)[1], 并以正常海水作為實驗對照組(pH 8.1)。各實驗組放置青蛤120枚,每天3次測量各實驗組的 pH值、溶解氧 DO、鹽度、溫度, 并根據實際測得數值調整 CO2通入量,保證酸化實驗組的pH正負偏差不超過0.1。試驗期間投喂小球藻、等鞭金藻、新月菱形藻, 投喂后再次調整 pH。每兩天換水四分之一, 及時挑出死亡個體并記錄。
1.4 血淋巴液的制備
在酸化的第0、7、14、21、28 天, 從各實驗組隨機選取15枚青蛤, 用1 mL針管從閉殼肌處抽取血淋巴液, 將 5個青蛤的血淋巴液混合作為一個測定樣品放入 2.5 mL離心管中, 置于冰上保存, 待后面指標的測定。
1.5 指標測定方法
血細胞總數的測定采用血細胞計數板進行測定。稀釋液為貝類生理鹽水, 配方: 0.02 mol/L HEPES,0.4 mol/L NaCl, 0.1 mol/L MgSO4, 0.01 mol/L KCl,0.01 mol/L CaCl2, 調節pH為7.4。
酸性磷酸酶(ACP)、堿性磷酸酶(ALP)、超氧化物歧化酶(SOD)、氧化氫酶(CAT)、戊二醛(MDA)、溶菌酶活性均采用南京建成生產的檢測試劑盒, 參照隨之附送的各使用說明書進行操作。
1.6 數據處理與分析
數據使用SPSS 18.0統計軟件進行數據分析。結果用平均數±標準差表示, 采用單因子方差分析法(one-way ANOVA)進行方差分析, 運用 Duncan test對數據進行顯著性檢驗, 顯著性水平為P < 0.05。
2 結果
2.1 海水溫度、鹽度、溶解氧和pH
為盡量減少其他環境因子對結果的影響, 本試驗維持海水溫度和鹽度在較小的變化范圍內。圖 1表明, 在酸化期間海水溫度整體范圍保持在 26~31℃, 鹽度保持在25。

圖1 海水溫度和鹽度變化Fig. 1 Changes in seawater temperature and salinity
圖 2所示整個試驗期間溶解氧含量均保持在較高水平, 三實驗組的溶解氧含量范圍均在(7.4±0.3) mg/L~(8.5±0.5)mg/L, 能夠保證青蛤正常生理活動的耗氧需求。

圖2 實驗期間各組海水溶氧Fig. 2 Variation of dissolved oxygen in each group
圖3所示對照組在第0 ~14 d時pH波動較大, 隨后逐漸趨于穩定。兩實驗組維持在實驗設定的固定數值, pH變化范圍控制在±0.5。
實驗期間, 只有在第 7 天對照組(pH8.1)和 21 d酸化組(pH7.4)組各死亡一枚, 其余時間內并未死亡。
2.2 酸化對血細胞總數影響
圖4所示, pH 8.1組和pH 7.7組的血細胞總數整體趨勢較穩定。pH 7.4組的變化較大, 總體呈降低的趨勢, 0~14 d差異不顯著(P>0.05), 但與21 d和28 d差異均顯著(P<0.05)。在14 d和28 d時三實驗組彼此差異顯著(P<0.05)。

圖3 海水pH變化Fig. 3 Changes in seawater pH

圖4 酸化對血細胞總數的影響Fig. 4 Effects of acidification on the total number of blood cells
2.3 酸化對溶菌酶活性影響
圖 5所示溶菌酶活性, pH8.1組整體趨于穩定;而pH7.7呈逐漸降低趨勢; pH7.4組呈先升高后降低,在第14 天時到最大值。各實驗組在各時間點差異均不顯著(P>0.05), 相同時間點三實驗組之間的差異性也不顯著(P>0.05)。
2.4 酸化對ACP活性影響
圖6所示ACP活性, pH8.1組整體保持基本不變;pH7.7組和pH7.4組呈先降低后增長再降低的趨勢。但各實驗組在各時間點差異均不顯著(P>0.05), 相同時間點三實驗組之間的差異性也不顯著(P>0.05)。

圖5 酸化對溶菌酶活性的影響Fig. 5 Effects of acidification on the lysozyme activity

圖6 酸化對青蛤ACP活性的影響Fig. 6 Effects of acidification on the ACP activity
2.5 酸化對ALP活性影響
圖7所示, 三實驗組的ALP活性隨時間增長均呈遞增的趨勢, 相同時間點上三實驗組之間 ALP活性的差異性不顯著(P>0.05), 且 pH 7.7實驗組 ALP活性最低。

圖7 酸化對青蛤ALP活性的影響Fig. 7 Effects of acidification on the ALP activity
2.6 酸化對SOD活性影響
圖8所示, 三實驗組 SOD活性在第 21 天均有顯著增加的趨勢(P<0.05), 其余時間內相對平穩。在14 d酸化組SOD要高于對照組。到21~28 d時, 酸化組降低, 對照組高于酸化組。在第 14 天和第 21天三實驗組彼此差異顯著(P<0.05), 其他時間差異均不顯著(P>0.05)。
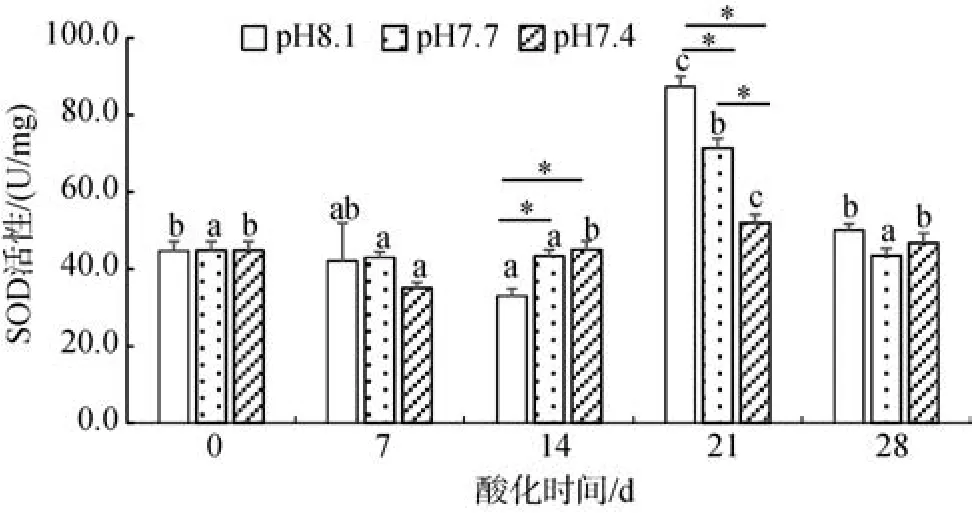
圖8 酸化對青蛤SOD活性的影響Fig. 8 Effects of acidification on the SOD activity
2.7 酸化對CAT活性影響
圖9所示, pH7.7組CAT活性在第28 天有較為突出的升高(P<0.05), 其余時間基本穩定不變。pH7.4組則表現為不斷增長的趨勢。21 d達到最大值, 28 d時略下降。酸化脅迫下各時間點上三實驗組彼此差異顯著(P<0.05)。

圖9 酸化對青蛤CAT活性的影響Fig. 9 Effects of acidification on the CAT activity
2.8 酸化對MDA含量影響
圖10所示, pH8.1和pH7.7組MDA含量均呈先增加后降低再增加的趨勢。pH7.4組為先降低再升高最后降低, 第 21 天時達到最大值。總體上看, 試驗期間兩個酸化實驗組的MDA含量要低于對照組。
3 討論

圖10 酸化對青蛤MDA含量的影響Fig. 10 Effects of acidification on the MAD count
作為細胞免疫承擔者的血細胞, 其數量作為重要的生理指標, 受種類、年齡、生態狀態和環境脅迫的影響較大[5]。本次試驗前期血細胞總數出現短暫的升高, 原因可能由于青蛤自身免疫的應激性。一些學者認為短時間污染物的刺激可以導致血細胞數量增加[6], 造成的原因可能是刺激物讓血細胞進入循環系統或者是細胞膜穩定性降低的補償的結果[7]。但當機體長時間受酸化脅迫后, 超出自身耐受范圍, 血細胞總數將受到影響開始下降。丁鑒鋒等[8]指出高濃度 Cu2+等重金屬長期脅迫下, 菲律賓蛤仔血細胞總數明顯降低, 與本次試驗結果一致。Cheng等[9]發現pH變化(7.6~4.8和9.3)7 d時羅氏沼蝦血細胞數量明顯降低。Matozzo等[10]也研究了海洋酸化和暖化對貝類免疫力的影響, 結果表明血細胞并非一直呈線性變動, 但也受到酸化顯著影響。所得結論不僅和本試驗結果一致, 還提出了另外一條結論: 即在酸化條件相同情況下, 不同的種類, 酸化效果各異。本試驗結果說明青蛤血細胞對外界 pH存在一定耐受范圍,當受到的pH脅迫超出機體的適應范圍時, 其數量會減少, 并顯示出血細胞總數隨酸化程度及其相關(P<0.05)。
溶菌酶、ALP和 ACP均來自血細胞溶酶體中,是研究血細胞體液免疫的重要指標。低濃度氨氮脅迫對凡納賓對蝦(Litopenaeus vannamei)時, 溶菌酶活性升高, 隨著濃度的升高, 溶菌酶反而下降[11]。本試驗也有相似結論, 0~14 d時, 隨著酸化時間段的增長, 溶菌酶逐漸呈現上升趨勢, 14 d時酸化組均大于對照組, 這可能是刺激源改變了溶酶體膜的通透性,溶菌酶外滲, 參與對刺激源的殺傷和清除[8]。此后14~28 d時, 溶菌酶又呈下降趨勢, 28 d達到最小值。這可能是機體由于應激反應使其活性升高, 超過自身閥值, 活性受到抑制。對于同樣是pH的改變作為外源刺激, 李曉梅等[12]在研究海洋酸化背景下鉛脅迫近江牡蠣(Crassostrea rivularis Gould)對溶菌酶活性的試驗中, 所得結論也與本試驗相同。
酸性磷酸酶(ACP)和堿性磷酸酶(ALP)是重要的體液免疫水解酶, ACP和ALP具有相同的作用效果:輔助吞噬作用消除異物。不同作用效果在于 ACP有催化效果, 而ALP更多在于起到調理、調節的作用[4]。梁健等[13]指出 Cu2+半致死濃度脅迫下青蛤血淋巴液中 ACP 活性呈現出先升高后抑制的趨勢。饒玉才[14]發現背角無齒蚌(Anodonta woodiana)的ACP活性隨pH下降先上升后下降, 在pH高于對照條件下, ACP活性在pH7.5略下降, 然后隨pH增高分別急劇上升和下降。本研究中機體自身受到酸化脅迫后 ACP活性逐漸升高最后在28 d時酸化組(pH7.7和pH7.4)出現明顯的下降。活性升高可能是由于“應激”導致; 脅迫后期ACP活性的降低可能通過以下兩條途徑所導致: 一是由于環境刺激造成的貝類血細胞溶解, 導致含有ACP的溶酶體失活; 二是可能改變了血細胞內溶酶體的膜通透性, 導致ACP滲漏。ALP活性表現與 ACP存在差異, 于第28天時, ALP處于上升趨勢, 且酸化組(pH7.4)略大于對照組(pH8.1), 推測是因為酸化組pH為7.4只能引起自身產生相應的應激效果, 并未達到抑制ALP的最小pH。任加云等[15]在指出在0.3和0.5 mg/L石油烴的脅迫下, 櫛孔扇貝的ALP活性呈上升趨勢, 而1 mg/L時ALP活性明顯下降, 這一現象充分證明了本文的推測。彭懷明等[16]也有相同結論, 但其認為原因可能是血細胞的破壞造成溶酶體的釋放。
SOD、CAT和 MDA是免疫能力檢測的重要指標。當刺激源侵害機體時, 機體便會產生氧化應激反應, 從而產生一系列的脂質過氧化產物, 如丙二醛(MDA), 它可以影響細胞膜流動性和通透性, 導致功能的改變[17]。于慶云等[18]測定菲律賓蛤仔消化腺和鰓SOD活性在酸化條件下隨著時間的增長, 呈現先增加后降低的趨勢。有學者指出草魚SOD活性隨著 pH不斷地下降和酸化時間的增長呈先上升后下降的趨勢[19]。陳琳琳等[20]提出重金屬能夠在短期內增加紫貽貝抗氧化酶的活性, 但隨著脅迫時間的延長, 便會抑制相關抗氧化酶的活性。本試驗酸化試驗初期, 7~14 d時, SOD活性出現短暫的升高, pH的降低使體內迅速產生活性氧, 抗氧化能力被激活, SOD活性上升, 以降低其細胞膜的脂質氧化程度; 隨著酸化脅迫時間的增長, 18~21 d, 低pH誘導產生的活性氧超出調控閾值, 便抑制了SOD活性, 使SOD活性低于對照組。
CAT能夠分解清除由 SOD歧化作用產生的H2O2從而保護細胞不受損傷, CAT和SOD在抗氧化,清除刺激脅迫產生的活性氧自由基時, 往往是共同協作。本試驗中試驗組隨酸化時間的增長呈上升的趨勢, 究其原因可能是: 1)酸化組所設 pH梯度不能抑制CAT活性, 使CAT活性仍然處在“誘導”階段。2)酸化的時間較短, 不能夠導致對CAT活性的抑制。另外結果中對照組CAT活性在酸化脅迫中并不穩定,出現有規律性的波動, 這可能是來自于溫度的影響,本次試驗是在夏天進行, 水溫較高, 有學者認為, 在夏天貝類CAT會普遍較高, 呈季節性變化[21]。
本試驗中實驗組 MDA含量隨酸化時間的延長呈先升高后降低的趨勢, 但試驗組MDA含量始終小于對照組且差異明顯, 說明生物體內活性氧的累積程度和細胞的損傷程度均處于較低水平, 非酶促反應起主要作用。機體自身的抗氧化防御系統有兩類,一類是酶促防御系統, 包括 SOD、CAT等; 另一類是非酶促反應, 包括還原型谷胱甘肽(GSH)、維生素E等[22]。當酶促防御系統SOD等受到酸化的脅迫, 導致活性降低, 機體可能提高非酶促反應, 來彌補酶促反應的不足, 導致MDA含量較低。
參考文獻:
[1] 許友卿, 唐旎, 丁兆坤, 等. 海水酸化對水生動物主要抗氧化酶的影響及機理[J]. 水產科學, 2016, 35(4):453-458.Xu Youqing, Tang Ni, Ding Zhaokun, et al. Effect and mechanism of ocean acidification on main antioxidant enzyme activity in aquatic animals[J]. Fisheries Science, 2016, 35(4): 453-458.
[2] Caldeira K, Wickett M E. Anthropogenic carbon and ocean pH[J]. Nature, 2003, 425: 365.
[3] 張朝霞, 王軍, 丁少雄, 等. 貝類免疫學研究新進展[J]. 廈門大學學報(自然科學版), 2006, 45(2): 90-96.Zhang Zhaoxia, Wang Jun, Ding Shaoxiong, et al. Recent progressses of shellfish’s immunology[J]. Journal of Xiamen University (natural science), 2006, 45(2): 90-96.
[4] 劉世良, 麥康森. 貝類免疫系統和機理的研究進展[J].海洋學報. 2003, 25(2): 95-105.Liu Shiliang, Mai Kangsen. The progress of studies on molluscs immunological system and mechanism-a review[J]. Acta Oceanologica Sinica, 2003, 25(2): 95-105.
[5] Thompson R J, Bayne C J, Moore M N, et al. Haemolymph volume changes in the biochemical composition of the blood, and cytological responses of the digestive cells in Mytilus californianus Conrad, induced by nu-tritional, thermal and exposure stress[J]. Journal of Comparative Physiology, 1978, 127: 287-298.
[6] Rickwood C J, Galloway T S. Acetylcholinesterase inhibition as a biomarker of adverse effect: a study of Mytilus edulis exposed to the priority pollutant chlorfenvinphons[J]. Aquatic Toxicology, 2004, 67(1): 45-56.
[7] Auffret M. Bivalves as models for marine immunology[M]. Investigative Immunotoxicology, 2005, 29-48.
[8] 丁鑒鋒, 閆喜武, 趙力強, 等. 海洋污染物對菲律賓蛤仔的免疫毒性[J]. 生態學報, 2013, 33(17): 5419-5425.Ding Jianfeng, Yan Xiwu, Zhao Liqiang, et al. Immunotoxicity of marine pollutants on the clam Ruditapes philippinarum[J]. Acta Ecologica Sinica, 2013, 33(17):5419-5425.
[9] Cheng W T, Chen J C. Effects of pH, temperature and salinity on immune parameters of the freshwater prawn Macrobrachium rosenbergii[J]. Fish &Shellfish Immunol,2000, 10: 387-391.
[10] Matozzo V, Chinellato A, Munari M. Finos L, et al.First evidence of immunomodulation in bivalves under seawater acidification and increased temperature[J].PLOS One, 2012, 7(3): 1-14.
[11] 姜令緒, 潘魯青, 肖國強. 氨氮對凡納對蝦免疫指標的影響[J]. 中國水產科學. 2014, 11(6): 537-541.Jiang Lingxu, Pan Luqing, Xiao Guoqiang. Effects of ammonia-N on immune parameter of white shrimp Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2014, 11(6): 537-541.
[12] 李曉梅, 郭體環, 張來軍, 等. 海洋酸化背景下鉛脅迫對近江牡蠣溶菌酶活性的影響[J]. 江蘇農業科學.2016, 44(12): 297-299.Li Xiaomei, Guo Tihuan, Zhang Laijun, et al. Effect of lead stress on lysozyme activity of oyster near oplain under ocean acidification[J]. Jiangsu Agricultural Sciences, 2016, 44(12): 297-299.
[13] 梁健, 雲雷雅, 李永仁, 等. Cu2+對青蛤的脅迫效應[J]. 海洋科學, 2015, 39(11): 74-78.Liang Jian, Lei Yayun, Li Yongren, et al. Effects of Cu2+stress on Cyclina sinens[J]. Marine Sciences, 2015,39(11): 74-78.
[14] 饒玉才. 外界刺激與環境脅迫對背角無齒蚌免疫因子的影響[D]. 南昌: 南昌大學, 2007.Rao Yucai. Effect of external stimuli and environmental stress on immune factors in Anodonta[D]. Nanchang:Nanchang University, 2007.
[15] 任加云, 苗晶晶, 李學平. 石油暴露對櫛孔扇貝免疫酶活性及血細胞穩定性的影響[J]. 中國水產科學,2015, 22(6): 1219-1226.Ren Jiayun, Miao Jingjing, Li Xueping. Effect of exposure on immune enzyme activity and hemocyte membrane stablility in scallop, Chlamys farreri[J]. Journal of Fishery Sciences of China, 2015, 22(6): 1219-1226.
[16] 彭懷明, 周書林. 軟體動物免疫功能研究進展[J]. 動物醫學進展, 2010, 31(8): 79-83.Peng Huaiming, Zhou Shulin. Progress on immune function of molluscs[J]. Progress in Veterinary Medicine, 2010, 31(8): 79-83.
[17] 張志杰, 張維平. 環境污染生物監測與評價[M]. 北京: 中國環境科學出版社, 1991: 9-71.Zhang Zhijie, Zhang Weiping. Environmental Pollution Monitoring and Assessment[M]. Beijing China: China Environmental Science Press, 1991: 9-71.
[18] 于慶云, 王悠, 徐彥, 等. 鎘和鉛對菲律賓蛤仔脂質過氧化及抗氧化酶活性的影響[J]. 生態毒理學報,2013, 8(4): 504-512.Yu Qingyun, Wang You, Xu Yan, et al. Effects of cadmium and lead on the lipid peroxidation and levels of antioxidant enzymes in Ruditapes philippinarum[J].Asian Journal of Ecotoxicology, 2013, 8(4): 504-512.
[19] 馬廣智, 唐玫, 徐軍. 低 pH 對草魚鰓和肝組織超氧化物歧化酶(SOD)活性的影響[J]. 中國水產科學,2001, 8(1): 23-25.Ma Guangzhi, Tang Mei, Xu Jun. Effects of low pH on superoxide dismutase (SOD) activities of branchial and liver tissue of grass carp[J]. Journal of Fishery Sciences of China, 2001, 8(1): 23-25.
[20] 陳琳琳, 張高生, 陳靜, 等. 汞、硒暴露對紫貽貝(Mytilus edulis) 抗氧化酶系統的影響[J]. 生態毒理學報. 2011, 6(4): 383-388.Chen Linlin, Zhang Gaosheng, Chen Jing, et al. Exposure effects of mercury and selenium on antioxidant enzymes of blue mussel Mytilus edulis[J]. Asian Journal of Ecotoxicology, 2011, 6(4): 383-388.
[21] Pellerin-Massicotte J. Influence of elevated temperature and air-exposure on MDA levels and catalase activities in digestive glands of the blue mussel (Mytilus edulis L)[J]. Journal de Recherche Oceanograpraphique, 1997,22: 91-98.
[22] 常君瑞, 徐東群. 甲醛對機體超氧化物歧化酶、谷胱甘肽過氧化物酶和丙二醛的影響[J]. 衛生研究, 2006,35(5): 653-655.Chang Junrui, Xu Dongqun. Effects of formaldehyde on the activity of superoxide dismutases and glutathione peroxidase and the concentration of malondialdehyde[J].Journal of Hygiene Research, 2006, 35(5): 653-655.

