全身炎性反應綜合征患兒腫瘤壞死因子-α表達水平與預后的相關性分析
吳慶波 詹海榮
·論著·
全身炎性反應綜合征患兒腫瘤壞死因子-α表達水平與預后的相關性分析
吳慶波 詹海榮
目的 探討全身炎性反應綜合征(SIRS)患兒的預后與腫瘤壞死因子-α表達的相關性。方法 2011年8月至2015年2月在PICU住院的符合全身炎性反應綜合征診斷標準的患兒140例為觀察組,同期在保健科進行抽血體檢的健康兒童140例為對照組,2組都進行血清腫瘤壞死因子-α(TNF-α)的檢測,進行了臨床資料的調查與相關性分析。結果 觀察組與對照組血清TNF-α含量分別為(34.22±12.98)pg/ml和(12.98±7.22)pg/ml,觀察組血清TNF-α含量明顯高于對照組(P<0.05)。觀察組中治療成功124例,治療失敗16例,治療成功率88.6%;經過檢測,治療成功組血清TNF-α含量為(25.22±13.32)pg/ml,而治療失敗組血清TNF-α含量為(51.92±10.36)pg/ml,2組比較差異有統計學意義(P<0.05)。Pearson相關性分析結果顯示SIRS患兒TNF-α含量與預后情況呈現明顯負相關性(r=-0.345,P<0.05),多元Logistic回歸模型顯示機械通氣時間、ICU住院時間和TNF-α含量都為導致SIRS患兒治療預后失敗的獨立危險因素(P<0.05)。結論SIRS患兒伴隨有血清TNF-α的高表達,且血清TNF-α的表達能直接影響患兒的預后,TNF-α作為一種炎性因子在疾病恢復過程中可能發揮負面效應。
全身炎癥反應綜合征;小兒;腫瘤壞死因子;相關性;預后
全身炎性反應綜合征(SIRS)是指機體對感染或非感染性損害的全身炎性反應,可引起炎性介質的大量、失控性釋放,各促炎或抗炎因子相互誘導、調節、刺激,形成復雜的級聯反應網絡,進而造成機體的嚴重損害[1,2]。當前小兒SIRS的發病率也在逐漸增加,而且出現SIRS時細胞因子顯著升高,有數據顯示,死亡者的促炎因子濃度高于存活者,表明濃度升高的水平與病情嚴重程度及預后有關[3,4]。并且SIRS提出使人們從分子水平上加深了對炎癥的認識,為高危疾病的監測、治療提供了新的思路和方法,對改善預后具有重要意義[5,6]。腫瘤壞死因子-α(TNF-α)是由單核-巨噬細胞和活化的T細胞在炎性介質作用下生成的一種多肽,是機體內部抵御各種致病因子、維持自穩態必不可少的免疫調節因子。目前國內外對TNF-α在SIRS的作用進行了相關的研究[7,8],但是關于正常兒童及SIRS患兒TNF-α的水平與預后相關性還無相關報道。本文為此具體探討了SIRS患兒的預后與TNF-α表達相關性,為尋求合理有效的SIRS防治措施提供理論與臨床依據。
1 資料與方法
1.1 一般資料 2011年8月至2015年2月在我院PICU住院的符合SIRS診斷標準的患兒140例為觀察組。診斷標準:(1)呼吸急促,PaCO2<32mmHg;(2)心動過速;(3)體溫>38℃或<36℃;(4)白細胞計數>12 000/mm2或<4 000/mm2或桿狀核粒細胞>10%,具有以上兩項或兩項以上指標者可診斷SIRS;疾病類型:肺炎45例,唇腭裂術后25例,哮喘20例,顱內出血10例,腦炎6例,腸套疊4例,其他10例。對照組為同期在我院保健科進行抽血體檢的健康兒童140例。本研究得到了2組入選者家長的知情同意且得到了醫院倫理委員會的批準,年齡2~10歲;排除下粘性心腦血管疾病患兒;排除各種急慢性感染、結締組織病等患兒。2組性別比、年齡、體重、身高等基線資料比較差異無統計學意義(P>0.05)。見表1。

表1 2組基線資料比較 n=140
1.2 檢測指標 2組入選者空腹12~14h后清晨取肘靜脈血2ml置于非抗凝真空采血管,以3 500r/min的速度在4℃下離心3~5min,取上清液,保存于-70℃冰箱中備用。采用IMMULITE-1000全自動酶放大化學發光免疫分析系統進行TNF-α的檢測,試劑盒來自由天津德普生物技術和醫學產品有限公司,嚴格按照說明書進行操作。
1.3 調查內容 采用我院統一印制的調查表,2組入選者進行現場調查、直接詢問并填寫問卷,內容包括受試者的年齡、性別、家族疾病史、個人疾病史、體重、身高、主要診斷、次要診斷、住院時間、住PICU時間、主要診斷、次要診斷、免疫障礙(惡性腫瘤,化療史)、先天性疾病、外傷史、手術史;小兒危重病評分(PCIS)、營養不良、多部位感染、血液微量元素、人工氣道、機械通氣時間等。治療預后分為2個級別,治療預后成功組包括治愈和好轉,治療預后失敗組包括死亡、放棄、未愈。
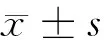
2 結果
2.1 血清TNF-α含量比較 觀察組與對照組血清TNF-α含量分別為(34.22±12.98)pg/ml和(12.98±7.22)pg/ml,觀察組血清TNF-α含量明顯高于對照組(P<0.05)。見表2。


組別TNF-α觀察組34.22±12.98對照組12.98±7.22t值16.309P值<0.05
2.2 預后情況 經過調查與隨訪,觀察組患者治療成功124例,治療失敗16例,治療成功率88.6%;治療成功組血清TNF-α含量(25.22±13.32)pg/ml,治療失敗組血清TNF-α含量(51.92±10.36)pg/ml,2組比較差異有統計學意義(P<0.05)。見表3。


組別TNF-α治療成功組25.22±13.32治療失敗組51.92±10.36t值9.113P值<0.05
2.3 相關性分析 觀察組140例患者中,血清TNF-α含量與預后進行Pearson相關性分析,結果顯示兩兩之間呈現明顯負相關性(r=-0.345,P<0.05)。
2.4 多因素的逐步Logistic回歸 觀察組調查的所有資料與數據作為自變量納入多元Logistic回歸模型,以預后治療失敗為應變量進行分析,結果顯示機械通氣時間、ICU住院時間和TNF-α含量都為導致SIRS患兒治療預后失敗的獨立危險因素(P<0.05)。見表4。
3 討論
SIRS是危重患兒搶救中常見且處理較為棘手的問題,可導致器官功能衰竭,當前在我國的發病率與病死率都比較高[9]。SIRS的發病機制涉及細胞因子假說、正反饋學說和促炎/抗炎失衡學說,表現為SIRS過程中炎性介質大量、失控性釋放,形成復雜的級聯反應網絡,從而造成病理損害[10]。適量的抗炎反應可以使炎性反應下調,過度的抗炎性反應可使機體出現無免疫狀態[11]。

表4 SIRS患兒治療預后失敗的獨立危險因素
TNF-α是主要的致炎因子之一,處于反應起始處,是網絡中的觸發成分,TNF-α可誘導多種炎性因子大量釋放,觸發炎癥發展;其也可以直接激活粒細胞,導致微血管通透性增加,損傷血管內皮細胞,血小板黏附,進一步釋放氧自由基和脂質代謝產物,從而引起組織損傷[12,13]。本研究顯示觀察組與對照組血清TNF-α含量分別為(34.22±12.98)pg/ml和(12.98±7.22)pg/ml,觀察組血清TNF-α含量明顯高于對照組(P<0.05),表明SIRS患兒伴隨血清TNF-α的高表達。
現代研究表明SIRS是機體對各種不同嚴重損傷所產生的全身炎性反應,兒科ICU中SIRS的發生率為25.0%左右,病死率高達7.0%左右,而非全身炎性反應綜合征的病死率僅為約3.0%[14]。本研究經過調查與隨訪,觀察組治療成功124例,治療失敗16例,治療成功率88.6%;經過檢測,治療成功組血清TNF-α含量為(25.22±13.32)pg/ml,而治療失敗組血清TNF-α含量為(51.92±10.36)pg/ml,差異有統計學意義(P<0.05),表明其治療成功率與文獻報道比較相符合[15],所有死亡者均并發多器官衰竭,且累及的器官越多,病死率越高。而炎性反應一旦啟動,并不會因致病因素的解除而停止,如果不被及時阻斷的話,可導致多器官衰竭的發生[16]。
機體的致炎反應和抗炎反應能保持平衡則可維持機體內環境穩定,反之,可導致機體組織器官的損傷。研究表明TNF-α在全身炎性反應時均升高,產生時間比較早,達高峰快,其升高程度與疾病嚴重程度有關[17,18]。本研究Pearson相關性分析結果顯示SIRS患兒TNF-α含量與預后情況呈現明顯負相關性(r=-0.345,P<0.05);同時多元Logistic回歸模型顯示機械通氣時間、ICU住院時間和TNF-α含量都為導致SIRS患兒治療預后失敗的獨立危險因素(P<0.05)。
為此ICU醫師應充分認識危重癥的危險因素,采取積極干預措施有可能改善預后。
總之,SIRS患兒伴隨有血清TNF-α的高表達,且血清TNF-α的表達能直接影響患兒的預后,TNF-α作為一種炎性因子在疾病恢復過程中可能發揮著負面效應。
1 王書華.全身炎癥反應綜合征患兒血清降鈣素原的變化及其意義.中國實用醫刊,2015,14:102-104.
2 郝曉燕,梁春莉.全身炎癥反應綜合征患兒血漿腦鈉肽濃度測定的臨床意義.中國現代醫生,2015,53:41-43.
3FarinhaJB,StecklingFM,StefanelloST,etal.Responseofoxidativestressandinflammatorybiomarkerstoa12-weekaerobicexercisetraininginwomenwithmetabolicsyndrome.SportsMedOpen,2015,1:3-8.
4 黃光舉,張慧玉,田玲,等.血清IL-6、TNF-α、IL-10的動態監測在兒童重癥肺炎中臨床意義.中國實驗診斷學,2015,6:1010-1011.
5 于靜,高若飛,周喜紅.新生小鼠全身炎癥反應綜合征時肺組織糖皮質激素受體的表達及意義.中國臨床研究,2015,28:567-570.
6ChenY,DuY,LiY,etal.PanaxadiolSaponinandDexamethasoneImproveRenalFunctioninLipopolysaccharide-InducedMouseModelofAcuteKidneyInjury.PLoSOne,2015,10:134-136.
7 張付來,陸振輝,楊黎志.SIRS評分評估小兒感染性腹瀉病情嚴重度的臨床研究.中國臨床研究,2015,28:82-84.
8 段君.烏司他丁對膿毒癥患兒TNF-α、IL-6、IL-10及腎功能的影響.中國實用醫刊,2015,42:115-116.
9ZhangK,JiaoXF,LiJX,etal.Rheininhibitslipopolysaccharide-inducedintestinalinjuryduringsepsisbyblockingthetoll-likereceptor4nuclearfactor-κBpathway.MolMedRep,2015,12:4415-4421.
10 蔣麗芳,魏洪平,吳莉萍,等.七味白術散治療輪狀病毒腸炎療效及對血清腫瘤壞死因子-α和白介素-6水平的影響.浙江中西醫結合雜志,2015,7:656-657.
11FanJ,WuL,LiG,etal.Effectsofenteralnutritionwithparenteralglutaminesupplementationontheimmunologicalfunctioninsepticrats.BrJNutr,2015,113:1712-1722.
12 李林祖,張明真,黃誠花,等.兒童全身炎癥反應綜合征與血清降鈣素原的相關性研究.中國處方藥,2015,4:1-2.
13 賈云霞.兒童重癥支原體肺炎60例診治分析.山西醫藥雜志,2015,8:939-941.
14AmbroseN,KhanE,RavindranR,etal.TheexaggeratedinflammatoryresponseinBehet’ssyndrome:identificationofdysfunctionalpost-transcriptionalregulationoftheIFN-γ/CXCL10IP-10pathway.ClinExpImmunol,2015,181:427-433.
15 沈英華,凌杰.孟魯司特對兒童咳嗽變異性哮喘患者血清炎癥因子的調節及療效觀察.中國現代醫生,2015,53:64-66.
16 王幼黎,路樹強,高舉,等.腸道去污在全身炎癥反應綜合征患者炎癥反應調節中的作用.中華危重病急救醫學,2015,6:484-488.
17BruckN,SchnabelA,HedrichCM.Currentunderstandingofthepathophysiologyofsystemicjuvenileidiopathicarthritis(sJIA)andtarget-directedtherapeuticapproaches.ClinImmunol,2015,159:72-83.
18 李春玲,劉玉田,張美英.手足口病患兒血清白介素與腫瘤壞死因子α變化的護理干預.中華醫院感染學雜志,2015,2:452-454.
10.3969/j.issn.1002-7386.2017.02.034
442000 湖北省十堰市人民醫院新生兒科(吳慶波),預防保健科(詹海榮)
詹海榮,442000 湖北省十堰市人民醫院預防保健科;
E-mail:zhr4203@163.com
R
A
1002-7386(2017)02-0272-03
2016-05-17)

