晚期非小細胞肺癌外周血EGFR基因檢測與腫瘤抗原標志物的臨床意義
沈立 沈紅 杜興冉 杜強 朱成華
晚期非小細胞肺癌外周血EGFR基因檢測與腫瘤抗原標志物的臨床意義
沈立1沈紅1杜興冉2杜強1朱成華1
目的 探討原發性非小細胞肺癌(NSCLC)患者的血液腫瘤抗原標志物和外周血漿EGFR基因突變的關系,研究其對靶向治療的價值。方法 選擇NSCLC患者66例,無創檢測外周血漿標本EGFR基因突變和血液腫瘤抗原標志物水平,評價兩者的關系及臨床意義。結果 本研究中NSCLC患者的EGFR基因突變率為43.94%。EGFR基因突變多發患者群為女性、非吸煙及肺腺癌(P<0.05),與年齡及腫瘤分期無顯著相關性(P>0.05)。血漿EGFR基因突變陽性的患者血CEA水平比無EGFR基因突變的患者高,而SCCAg的水平比無EGFR基因突變的患者低,差異有統計學意義(P<0.05),其余指標NSE,Ca125,Cyfra21-1在EGFR基因突變型和野生型患者的比較中差異無統計學意義(P>0.05)。結論 對于血液中CEA升高和SCCAg降低的晚期NSCLC患者EGFR基因突變發生的可能性較大,選擇這些患者行血漿EGFR基因檢測無創安全且對靶向治療有一定的指導意義。
非小細胞肺癌;血漿EGFR基因突變;腫瘤抗原標志物
肺癌是一種高度異質性的惡性腫瘤,表皮生長因子受體酪氨酸激酶抑制劑(EGFR-TKI)在非小細胞肺癌(non-small celllung cancer,NSCLC)治療中起重要作用,EGFR突變是預測口服EGFR-TKI療效的最有效因子,但臨床組織標本獲取存在不同程度的困難,有報道組織EGFR基因突變與CEA之間存在一定關聯[1],本文通過無創檢測晚期NSCLC患者外周血漿EGFR基因突變情況,同時匹配血液腫瘤抗原標志物并觀察兩者相關性,從而為晚期NSCLC患者是否行EGFR基因檢測及治療提供相對精準的選擇。
資料與方法
一、研究對象
連續收集2015年9月至2016年5月我院病理確診為晚期NSCLC患者66例,男37例,女29例,年齡39-81歲,平均60.12歲。其中肺腺癌48例,非腺癌18例,包括磷癌17例,大細胞癌1例(見表1)。
二、 研究方法
1 標本采集:采集入組患者10mL全血置于EDTA管中,立即(或于4℃冰箱中2 h內)于1200 rpm離心20min,取上清6000 rpm再離心10min,然后分離血漿和血細胞并于-80℃保存直至提取。
2 DNA提取:血漿中循環腫瘤DNA的抽提采用上海允英公司的循環腫瘤DNA專用提取試劑盒 (Cat NO 23211),所提產物需用Life Technology公司 Qubit測定濃度,濃度應不小于2ng/μL,根據測定濃度進行最終濃度調整至2-52ng/μL,高于這個濃度,應該用純水進行稀釋,低于這個濃度,應真空濃縮或者重新提取。合格標本應立即進行檢測或-20℃保存。

表1 患者基本特征
3 EGFR基因突變檢測: 采用競爭性阻遏PCR(Competitiv Blocker Q-PCR)技術檢測EGFR基因突變,以腫瘤DNA(微量)作為模板,采用阻遏分子封閉EGFR野生型位點,使得PCR時突變特異引物只能以基因組為模板對突變靶序列進行高精度PCR擴增放大,利用Taqman-MGB熒光探針對擴增產物進行檢測,并在實時PCR平臺上對樣本DNA中EGFR突變進行檢測,每次PCR反應中,所有樣品和陽性對照、無模板對照共同分析。檢測步驟為:① 95℃ 10分鐘, 1個循環;② 95 ℃ 10秒鐘,60 ℃ 50秒鐘,15個循環;③ 95℃10秒鐘,60 ℃50秒鐘,35個循環,于第三階段60 ℃時收集FAM和HEX信號,執行實時PCR,保存文件。
突變結果判斷:按檢測說明書,EGFR檢測每次試驗均設定空白、野生型對照以及各突變的陰、陽性檢測結果作為參照,首先確定樣品各個反應管各自的突變Ct值,然后確定該樣品的外控Ct值。ΔCt值=突變Ct值-外控Ct值。由于樣品中突變百分比彼此不同,因而得出對應突變Ct值亦不等。根據不同的突變Ct值,把樣品檢測結果分為陰性、弱陽及強陽。Ct≥24為EGFR突變陰性,Ct<20 為EGFR突變陽性,20≤Ct<24為可疑陽性,需計算ΔCt值,當ΔCt<10,為突變陽性,反之則為陰性。
4 腫瘤抗原標志物的測定:抽取空腹肘靜脈血3.0 mL,3500 r/min離心10 min取上清液,測定儀為羅氏2010全自動電化學發光免疫分析儀,使用配套試劑。采用電化學發光法測定癌胚抗原CEA(CEA)、血清神經元特異性烯醇化酶(NSE)、糖基抗原CAl25(CAl25)、非小細胞肺癌抗原(CYFRA21-1)、鱗狀細胞癌抗原(SCCAg)水平,
結 果
一、EGFR基因突變結果
共66例NSCLC患者行血漿EGFR基因檢測,陰性37例,陽性29例,突變率為43.94%。(見表2)EGFR基因突變多發生于女性、非吸煙及肺腺癌患者(P<0.05),與患者的年齡及腫瘤分期無明顯相關性(P>0.05)。
二、血漿EGFR基因突變與血清腫瘤標志物的關系

表2 NSCLC患者EGFR基因突變與相關臨床特征分析
血漿EGFR基因突變陽性患者其血清CEA值高于血漿EGFR基因野生型患者(P<0.05),而血漿EGFR基因突變陽性患者血清SCCAg值低于EGFR野生型患者(P<0.05)。其余幾項血清腫瘤標志物包括CYFRA21-1、NSE和CA125在EGFR基因突變型和野生型間差異無統計學意義,P>0.05。(見表3)。
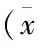
表3 EGFR基因突變與血清腫瘤標志物的關系±s)
三、統計學處理
應用SPSS 20.0軟件進行統計,計數資料采用χ2檢驗, 兩組間計量資料比較采用t檢驗。P<0.05為差異有統計學意義
討 論
已經證實EGFR-TKI在治療EGFR敏感突變的NSCLC患者時其療效明顯優于傳統化療[2]。然而,組織活檢樣本具有局限性,如很多高齡患者診斷時已無法手術因而無標本可取,氣管鏡取材小,某些腫瘤解剖位置及肺部基礎疾病不適和穿刺,穿刺本身諸多風險,反復取材患者接受程度低等[3],IPASS研究中組織標本篩選成功率較低僅為36%[4],因此有必要選擇更多的方法來預測EGFR-TKI的療效。
“液體腫瘤學檢測”因其操作可行性強、侵害性小、具有實時動態等特點正越來越受到臨床關注。循環腫瘤DNA(ctDNA)是腫瘤細胞因凋亡和壞死而直接釋放入外周血的DNA片段,攜帶有與腫瘤組織相關的信息[5-6]。王潔教授[7]報道230例NSCLC患者外周血EGFR突變與組織中EGFR突變的一致率為78%。最新研究認為甲醛溶液石蠟包埋技術對DNA的分子分析也會產生影響,每個樣本中腫瘤細胞的數量與形態和取樣的位置及大小有很大關系[8],因此腫瘤病理組織活檢可能不能反映整個病灶的完整信息。ctDNA來源于腫瘤原發灶和轉移灶壞死凋亡的腫瘤細胞碎片,可能可以避免腫瘤組織的遺傳異質性而體現整個腫瘤的遺傳學特征[9-10]。本研究檢測66例NSCLC患者血漿EGFR基因,結果發現EGFR基因突變陽性29例,突變率43.94%;同文獻[11]報道相符,分層分析顯示EGFR基因突變陽性率女性為62.07%,非吸煙患者為62.5%,肺腺癌患者為54.17%,據此可知EGFR基因突變多見于女性、非吸煙和肺腺癌患者(P<0.05),而與年齡和腫瘤分期無關(P>0.05)。
腫瘤抗原標志物是由腫瘤細胞生物合成釋放的一類物質,其中癌胚抗原(CEA)是肺癌患者的獨立預后因素,血清CEA表達水平與NSCLC療效及腫瘤的侵襲轉移相關。Shoji等[12]將CEA濃度劃分為3組,CEA≥20μg/L,5-19μg/L和<5μg/L,研究結果顯示血清CEA濃度和EGFR突變檢測陽性基本呈線性關系,推測CEA的變化可以預測EGFR-TKI的療效。Jung等[13]提出假設:EGRF突變可激活下游信號通路,加速癌細胞分化致CEA蛋白表達升高。本文發現攜帶EGFR突變的患者其血清CEA水平較EGFR野生型患者明顯升高(P<0.05)。我們推測,因CEA是細胞表面的糖蛋白,其本質是腺癌標志物,高CEA值預示腫瘤負荷大或腫瘤進展,因此CEA值升高可能與高EGFR突變率或EGFR突變的豐度升高有關。本文還發現EGFR突變患者中血清鱗狀細胞癌抗原SCCAg水平明顯低于EGFR野生型(P<0.05)。我們分析SCCAg為鱗癌特異性標記物,腺癌中表達極低,目前鱗癌的發病率較腺癌略低,而EGFR突變多見于腺癌,因此EGFR突變患者中血清SCCAg水平降低。
綜上所述,血清CEA濃度升高與血漿EGFR基因突變相關,聯合檢測血清CEA及SCCAg對預測EGFR基因突變具有重要意義,有助于結合臨床優勢人群,經驗性使用EGFR-TKIs治療,并可以避免盲目選擇昂貴的EGFR基因檢測,減輕患者醫療費用。晚期NSCLC患者多采用局部取材,難以獲取足量腫瘤組織進行EGFR基因檢測,血漿EGFR檢測無創安全,可重復性好有望彌補這一不足。然而,本研究由于樣本量較少存在一定的限制,血漿EGFR基因突變檢測尚處于起步階段, 主要用于檢測晚期肺癌患者,對于早期肺癌病變,該方法還不適合。需要進一步的大樣本研究闡明存在于該現象背后的可能分子機制。
[1] 徐琳,鄭明峰,張稷,等. EGFR突變基因檢測與腫瘤指標相關性研究[J].醫學研究雜志, 2011,40(8):79-81.
[2] Pallis AG,Syrigos KN. Epidermal growth factor receptor tyrosine kinase inhibitors in the treatment of NSCLC[J]. Lung Cancer, 2013,80(2):120-130.
[3] Orshew T,Murtaza M,Parkinson C,et al.Noninvasive identification and monitoring of cancer mutations by targeted deep sequencing of plasma DNA[J].Sci Transl Med,2012,4(136):136-l68.
[4] Fukuoka M,Wu YL,Thongprasert S,et al.Bio-marker analysis and final overall survival results from a phase Ⅲ,randomized,open-label,first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia(IPASS)[J].J Clin Oncol,2011,29(21):2866-2874.
[5] HIGGINS M J, JELOVAC D, BARNATHAN E, et al. Detection of tumor PIK3CA status in metastatic breast cancer using peripheral blood[J]. Clin Cancer Res, 2012, 18(12): 3462-3469.
[6] DAWSON S J, TSUI D W, MURTAZA M, et al. Analysis of circulating tumor DNA to monitor metastatic breast cancer[J]. N Engl J Med, 2013, 368(13): 1199-1209.
[7] Bai H, Mao L, Wang HS, et al. Epidermal growth factor receptor mutations in plasma DNA samples predict tumor response in Chinese patients with stages ⅢB to Ⅳ non-small-cell lung cancer[J]. J Clin Oncol,2009, 27(16): 2653-2659.
[8] DIAZL A,BARDELLI A. Liquid biopsies: genotyping circulating tumor DNA[J]. J Clin Oncol,2014,32(6):579-586.
[9] Crowley E,Di Nieolantonio F,Loupakis F,et al. Liquid biopsy:Monitoring eance T-genetics in the blood[J]. Nat Rev Clin Oncol,2013,10(8):472-484.
[10] Haber DA,Veleulescu VE.Blood-based analyses of cancer:circulating tumor cells and circulating tumor DNA[J].Cancer Discov,2014,4(6):650-661.
[11] Shigematsu H, Lin L, Takahashi T, et al. Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers[J]. J Natl Cancer Inst,2005, 97(5): 339-346.
[12] Shoji F,Yoshino I,et al.Serum carcinoembryonic antigen level is associated with epidermal growth factor receptor mutations in recurrent lung adenocarcinomas[J].Cancer,2007,110(12):2793-2798.
[13] Jung M,Kim SH,Hong S,et al.Prognostic and pretictive value of carcinoembryonic antigen and cytokeratin-19 fragments levels in advanced non-small-cell lung cancer patients treated with gefitinib or erlotinib[J].Yonsei Med J,2012,53(5) :931-939.
Relationship between serum tumor markers and EGFR gene mutation in plasma circulating DNA from NSCLC patients
SHENLi,SHENHong,DUXing-ran,DUQiang,ZHUCheng-hua.
DepartmentofRespiratoryMedicine,theSecondAffiliatedHospitalofNanjingMedicalUniversity,Nanjing,Jiangsu210011,China
Objective To investigate the relationship between serum tumor markers and plasma epidermal growth factor (EGFR) gene mutation in patients with non-small cell lung cancer (NSCLC) and to explore its prognostic value. Methods The serum EGFR gene mutation and serum tumor markers of 66 NSCLC patients were detected, and the relationship between EGFR gene mutation and serum tumor markers was analyzed. Results 66 NSCLC patients were enrolled, and the mutation rate was 43.94%. EGFR gene mutation was mainly occurred in women, non-smoking and adenocarcinoma patients (P<0.05). When the serum CEA was elevated or the serum SCCAg decreased, EGFR mutation rate increased significantly (P<0.05). While there was no correlation between NSE, CA125, CYFRA21-1 and EGFR gene mutation (P>0.05). Conclusion For the patients whose EGFR gene mutation can not be tested, we can chose those with low serum SCCAg and high CEA, and according to their clinical characteristics, they will be given EGFR-TKIs treatment and EGFR gene mutation detection.
non-small-cell lung cancer; epidermal growth factor gene mutation; tumor markers
10.3969/j.issn.1009-6663.2017.04.010
210011 江蘇 南京,南京醫科大學第二附屬醫院1.呼吸科、2.感染科
2016-06-28]

