染料木素對尿毒癥大鼠細胞外基質沉積的影響
王 浩,馮 冰△,朱 超,于建平,黃寶磚
(1.解放軍第四一一醫院腎內科,上海 200081;2.第二軍醫大學長海醫院腎內科,上海 200433;3.上海市徐匯區中心醫院腎內科 200031)
染料木素對尿毒癥大鼠細胞外基質沉積的影響
王 浩1,馮 冰1△,朱 超1,于建平2,黃寶磚3
(1.解放軍第四一一醫院腎內科,上海 200081;2.第二軍醫大學長海醫院腎內科,上海 200433;3.上海市徐匯區中心醫院腎內科 200031)
目的 探討染料木素對尿毒癥大鼠細胞外基質(ECM)沉積的影響及其機制。方法 5/6腎切除術建立尿毒癥模型鼠,將模型鼠分為染料木素組(G組)和對照組(C組),假手術組(S組)作為正常對照。檢測各組術前及術后第4、8周尿蛋白和生化等指標,第8周觀察腎組織病理變化情況,半定量法評估腎小球硬化指數(GSI)。免疫組化法檢測Ⅳ型膠原(ColⅣ)、纖維連接蛋白(FN)的沉積情況。應用逆轉錄聚合酶鏈反應(RT-PCR)法、Western blot法分別檢測腎組織中轉化生長因子β1(TGF-β1) mRNA轉錄、蛋白質表達情況。結果 術后第4周與C組比較,G組尿蛋白排泄量減少[(11.63±2.07)vs. (19.93±3.19)mg/d,P<0.01],血清尿素氮、肌酐水平降低[(9.39±0.59)vs.(12.09±0.78)mmol/L,(65.11±3.79)vs.(77.63±3.20)μmol/L,P<0.01]。至術后第8周,尿蛋白排泄量減少,血清尿素氮、肌酐水平降低更為顯著。腎小球內ColⅣ和FN沉積減少[(17.30±1.96)%vs. (24.68±3.97)%,(18.26±2.31)%vs. (29.35±4.15)%,P<0.01],腎小球硬化明顯減輕。TGF-β1mRNA、蛋白質表達減弱(P<0.05)。結論 染料木素可以減少尿毒癥大鼠細胞ECM的蓄積,對腎臟具有保護作用。
染料木素;尿毒癥;大鼠,Sprague-Dawley;膠原Ⅳ型;纖維連接蛋白;轉化生長因子β1
大豆為豆科植物大豆的成熟種子,我國最早的本草著作《神農本草經》首次記載了大豆及其藥用價值,并將其列為中品。大豆異黃酮(soybean isoflavone)是存在于大豆中的生物活性物質,主要包括染料木素(genistein)、大豆甙元(daidzein)、大豆苷元(glycitein)等。有研究證實,大豆蛋白飲食可以減輕腎小球纖維化、降低蛋白尿、減輕腎小管萎縮[1-3]。國內亦有研究發現,大豆蛋白飲食可以減輕尿毒癥大鼠的早期血管病變,對腎臟具有一定的保護作用[4]。目前有關大豆蛋白幾種活性成分的研究主要集中在細胞與分子水平上,動物實驗研究相對較少。本研究以5/6腎切除建立尿毒癥大鼠模型,觀察染料木素對腎硬化鼠細胞外基質(ECM)的作用情況。
1 材料與方法
1.1 材料 (1)實驗動物:雌性6周齡清潔級SD大鼠[動物許可證號SCXK-(滬)2007-0003] 25只,體質量200~230 g,飼養于第二軍醫大學藥學院院清潔級動物房(合格證號:醫動字第02-64號)。溫度20~23 ℃,相對濕度40%~50%,光照12 h明暗交替,標準飼料飼養,自由飲水。(2)主要試劑:染料木素(批號:G6649-70)、兔抗大鼠Ⅳ型膠原(ColⅣ)、兔抗大鼠纖維連接蛋白(FN)抗體購于Sigma公司,小鼠抗大鼠轉化生長因子β1(TGF-β1)抗體、羊抗小鼠二抗購于DAKO公司,ECL試劑盒購于Pierce公司,逆轉錄聚合酶鏈反應(RT-PCR)試劑購于Promega公司。(3)主要儀器:SYNCHRON CX5全自動生化分析儀購于Beckman公司,Thermal Cycler 480 PCR儀購于Perkin Elmer公司,HPIAS-1000型醫學圖像分析系統購于千屏影像工程公司,GDS 7500凝膠成像分析系統購于美國UVI公司。
1.2 方法
1.2.1 動物分組 使用數字表法,隨機將25只大鼠分為3組:假手術組(S組)8只,對照組(C組)8只,染料木素組(G組)9只。
1.2.2 尿毒癥模型鼠的建立及飼養方案 C、G組大鼠采用間隔1周的兩步法建立5/6腎切除尿毒癥模型鼠[5],1期手術在麻醉下扇形切除左腎上下極各1/3,吸收性明膠海綿止血;術后第8天行2期手術摘除右腎。S組麻醉下僅打開左、右腎包膜,不切除腎臟。術后各組正常飲食喂養8周,G組于2期手術后次日給予染料木素15 mg/(kg·d)灌胃;C組予等量的生理鹽水灌胃。
1.2.3 尿蛋白及血生化檢測 術前及術后第4、8周各組大鼠禁飲1 d,于代謝籠中收集24 h尿液,使用酶聯免疫吸附試驗(ELISA)法測定尿蛋白量。于同樣的時間點,各組大鼠禁食12 h后經內眥靜脈取血,檢測血肌酐(Scr)、血尿素氮(BUN)、血清清蛋白(Alb)和血清總蛋白(TP)。
1.2.4 腎組織病理檢查 2期手術后第8周采血檢測Scr和BUN,確認尿毒癥模型成功建立后即處死大鼠。手術摘取殘腎,固定、包埋、切片,行HE染色。在光鏡下觀察各組腎小球病理情況。Raij半定量法[6]評估腎小球硬化指數(GSI)。腎小球出現玻璃樣變和(或)毛細血管塌陷則定義為硬化。根據硬化灶所占腎小球比例分為0~++++:腎小球無硬化為0;受損0~<25%為+;受損25%~<50%為++;受損50%~<75%為+++,受損75%~100%為++++。每張切片觀察30個以上的腎小球,計算GSI。
1.2.5 免疫組織化學檢測 應用SABC法測定殘腎組織中的ColⅣ和FN。腎組織切片、脫蠟,PBS沖洗3 min,3%H2O2抑制內源性過氧化物酶30 min,微波加熱后行抗原修復,PBS沖洗5 min,分別加入一抗、二抗,DAB顯色,光鏡下棕黃色的顆粒為陽性顯示。各鼠隨機選取10個腎小球,應用HPIAS-1000型醫學圖像分析系統計算圖像中陽性區域與全區域的面積比。
1.2.6 RT-PCR法檢測TGF-β1mRNA表達 取腎皮質30~50 mg,Trizol法抽提總RNA,逆轉錄合成cDNA。TGF-β1引物序列上游:5′-CTT CAG CTC CAC AGA GAA GAA CTG A-3′,下游:5′-CCT CGT CAA CAG GTT GTA CTA GCA C-3′,擴增產物大小為298 bp;GAPDH引物序列上游:5′-TTC ATT GAC CTC AAC TAC ATG-3′,下游:5′-GTG GCA GTG ATG GCA TGG ATC-3′,擴增產物大小為443 bp。PCR擴增條件:94 ℃變性 1 min,55 ℃ 退火1 min 30 s,72 ℃ 延伸1 min 30 s,共40個循環,72 ℃再延伸10 min。擴增產物在2%瓊脂糖凝膠中電泳,溴化乙錠染色,GDS 7500分析系統進行定量分析。
1.2.7 Western blot 印跡分析 取30~50 mg腎皮質碾碎,加入0.5 mL含PMSF的細胞裂解液,置冰上超聲細胞粉碎。5 000 r/min,0 ℃離心后取上清液。用十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(SDS-PAGE)進行分離,分離后電轉移至硝酸纖維素膜,置于5%脫脂奶粉中封閉1 h。將NC膜放入小鼠抗大鼠TGF-β1稀釋液中孵育16 h,漂洗。加入羊抗小鼠IgG中孵育2 h。利用ECL試劑盒對產物進行檢測。GDS 7500分析系統檢測各條帶的光密度。
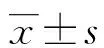
2 結 果
2.1 各組大鼠尿蛋白水平及血生化指標比較 手術后第4周,C組大鼠尿蛋白及Scr、Bun水平均升高,第8周時明顯升高。與C組比較,S、G組尿蛋白排泄量明顯減少(P<0.01),Scr、Bun水平均顯著下降(P<0.01)。實驗期間各組大鼠血清Alb及TP水平比較均差異無統計學意義(P>0.05),見表1。
2.2 各組大鼠腎臟病理檢查比較 在光鏡下,S組(圖1A)腎小球結構清晰,無系膜增生、細胞增殖;C組(圖1B、C)腎小球肥大、結構紊亂,呈局灶纖維化或彌漫性球性硬化,血管襻內皮細胞增殖,腎間質可見炎細胞浸潤,動脈管腔輕度狹窄;G組(圖1D)腎小球肥大不明顯,細胞增殖、系膜區增寬亦不及C組顯著。S、C、G組大鼠GSI分別為3.34±2.62、42.38±14.31、27.65±7.23。與C組比較,G組大鼠GSI明顯降低(P<0.01)。
2.3 各組大鼠腎臟組織FN 和Col Ⅳ表達水平比較 結果表明,S組腎小球系膜區有少量的ColⅣ和FN沉積。C組ColⅣ和FN沉積明顯增加(P<0.01)。與C組相比,G組ColⅣ和FN沉積明顯減少(P<0.01),見圖2、表2。
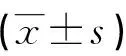
表1 不同時間點各組大鼠尿蛋白量及生化指標比較
a:P<0.01,與S組比較;b:P<0.01,與C組同期比較。

A:S組;B、C:C組;D: G組。
圖1 各組大鼠腎組織HE染色(HE×200)

A:S組FN表達;B:G組FN表達;C:C組FN表達;D:S組Col Ⅳ表達;E:G組Col Ⅳ表達;F:C組Col Ⅳ表達。

圖2 各組大鼠腎組織FN 和Col Ⅳ表達(HE×200)
a:P<0.01,與S組比較;b:P<0.01,與C組比較。
2.4 各組大鼠腎臟組織TGF-β1mRNA及蛋白表達比較 C組腎組織TGF-β1mRNA及蛋白表達較S組升高(P<0.05),G組腎組織TGF-β1mRNA及蛋白表達較C組降低(P<0.05),見圖3、4及表3。

圖3 各組大鼠腎臟組織 TGF-β1 mRNA表達

圖4 各組大鼠腎臟組織TGF-β1蛋白表達

組別nTGF-β1mRNATGF-β1蛋白S組80.132±0.0320.127±0.037C組80.644±0.079a1.405±0.131aG組90.329±0.055b0.432±0.076b
a:P<0.05,與S組比較;b:P<0.05,與C組比較。
3 討 論
慢性腎臟病的醫學營養治療由來已久,但是關于是否可以食用大豆蛋白的爭議一直困擾著臨床醫生和患者。傳統觀念認為,大豆蛋白由于非必需氨基酸的存在,加重了腎臟的負擔,可能不利于甚至加重腎病患者的病情。但近年來,越來越多的研究表明,大豆蛋白飲食可以減輕多種腎病的腎臟損害。Javanbakht等[7]通過對腎病綜合征鼠模型的研究發現,大豆蛋白可以改善腎組織氧化應激、減輕腎實質損害。Ibrahim等[8]發現,大豆蛋白可以降低多囊模型鼠的蛋白尿、改善酸中毒、減輕腎硬化。Yang等[9]研究證實大豆蛋白可以降低5/6腎次全切大鼠殘余腎組織 TNF-α水平、抑制血管緊張素轉化酶(ACE)活性、減緩腎衰竭。而作為大豆蛋白單獨的一種活性成分,染料木素也已被證實可以減少糖尿病模型鼠的蛋白尿、降低SCr和BUN、改善脂質堆積[10],對腎臟具有保護作用。
本實驗以5/6腎切除建立尿毒癥鼠模型,觀察染料木素對ECM的作用情況。研究發現,在實驗的第4周,C組尿SCr、BUN升高,尿蛋白排泄量增加;第8周時,SCr、BUN升高更為明顯。G組前述指標在第4和第8周時均明顯低于C組,殘腎組織病理改變亦明顯減輕。結果表明染料木素可以減輕尿毒癥鼠的腎損傷。全段實驗過程中,各組間血清Alb及TP水平比較差異無統計學意義(P>0.05),分析其原因可能是雖然尿蛋白排泄量增加,但肝臟尚能代償,故血清Alb及TP水平沒有明顯降低。
ECM主要由ColⅣ、FN、ColⅠ、ColⅤ型和層粘連蛋白等組成。ColⅣ為基底膜膠原蛋白,主要分布于腎小球、腎小管基底膜以及系膜基質之中。FN是一種糖蛋白,由腎小球固有細胞分泌。目前普遍認為,ECM動態平衡的失調介導了腎小球硬化的發生、發展。特別是ColⅣ和FN,其代謝失衡過程可能參與了腎小球損傷及修復過程中的組織重塑[11]。現已認識到,腎臟正常組織的逐漸纖維化是大多數慢性腎衰竭進行性發展的共同病理基礎。如能有效地阻止或減緩腎組織纖維化的發展,對延緩或改善慢性腎衰具有非常重要的意義。在本實驗中,G組與C組相比,ColⅣ和FN在基底膜和系膜區的沉積明顯減少。表明染料木素可以減少尿毒癥鼠ECM的蓄積,減緩腎小球硬化。
TGF-β1是一類超家族細胞因子,作用廣泛,參與了體內諸如炎癥、血管形成、組織發生、增生、凋亡等多種生物學過程[12-13],尤其是在ECM的產生和調控方面意義重大。Meng等[14]認為,正常或僅有微小病變的腎臟中,TGF-β1表達非常微弱。當出現腎損害時,TGF-β1表達明顯增強。通過抑制TGF-β1表達,可以減輕腎臟纖維化、維護正常的腎臟功能、保護殘余腎功能[15]。本實驗中,G組TGF-β1在mRNA、蛋白質水平上與C組比較均明顯減弱,提示TGF-β1的過度表達可能參與了腎組織間質纖維化的過程,并最終導致慢性腎衰竭。而染料木素有對TGF-β1的表達有抑制作用,該結果與尿蛋白排泄量、血生化、腎組織病理學改變、ColⅣ和FN的沉積情況等相一致。
綜上所述,染料木素可以降低ColⅣ、FN等ECM的蓄積、減輕腎小球硬化,對尿毒癥鼠具有一定的腎臟保護作用,其機制可能與下調TGF-β1表達有關。
[1]Javanbakht MH,Sadria R,Djalali M,et al.Soy protein and genistein improves renal antioxidant status in experimental nephrotic syndrome[J].Nefrologia,2014,34(4):483-490.
[2]Maditz KH,Gigliotti JC,Tou JC.Evidence for a role of proteins,lipids,and phytochemicals in the prevention of polycystic kidney disease progression and severity[J].Nutr Rev,2013,71(12):802-814.
[3]Miraghajani MS,Esmaillzadeh A,Najafabadi MM,et al.Soy milk consumption,inflammation,coagulation,and oxidative stress among type 2 diabetic patients with nephropathy[J].Diabetes Care,2012,35(10):1981-1985.
[4]張志強,袁偉杰,葉菡洋,等.大豆蛋白飲食對5/6腎切除大鼠血管早期病變的影響[J].中華腎臟病雜志,2007,23(8):529-533.
[5]Kennedy DJ,Elkareh J,Shidyak A,et al.Partial nephrectomy as a model for uremic cardiomyopathy in the mouse[J].Am J Physiol Renal Physiol,2008,294(2):450-454.
[6]Raij L,Azar S,Keane W.Mesangial immune injury,hypertension,and progressive glomerular damage in Dahl rats[J].Kidney Int,1984,26(2):137-143.
[7]Javanbakht MH,Sadria R,Djalali M,et al.Soy protein and genistein improves renal antioxidant status in experimental nephrotic syndrome[J].Nefrologia,2014,34(4):483-490.
[8]Ibrahim NH,Jia Y,Devassy JG,et al.Renal cyclooxygenase and lipoxygenase products are altered in polycystic kidneys and by dietary soy protein and fish oil treatment in the Han:SPRD-Cy rat[J].Mol Nutr Food Res,2014,58(4):768-781.
[9]Yang HY,Chen JR,Chang LS.Effects of soy protein hydrolysate on blood pressure and angiotensin-converting enzyme activity in rats with chronic renal failure[J].Hypertens Res,2008,31(5):957-963.
[10]Elmarakby AA,Ibrahim AS,Faulkner J,et al.Tyrosine kinase inhibitor,genistein,reduces renal inflammation and injury in streptozotocin-induced diabetic mice[J].Vascul Pharmacol,2011,55(5/6):149-156.
[11]Genovese F,Manresa AA,Leeming DJ,et al.The extracellular matrix in the kidney:a source of novel non-invasive biomarkers of kidney fibrosis[J].Fibrogenesis Tissue Repair,2014,7(1):4-9.
[12]Liu RM,Desai LP.Reciprocal regulation of TGF-β and reactive oxygen species:a perverse cycle for fibrosis[J].Redox Biol,2015,12(6):565-577.
[13]Docherty NG,Murphy M,Martin F,et al.Targeting cellular drivers and counter-regulators of hyperglycaemia and TGF-β1-associated profibrotic responses in diabetic kidney disease[J].Exp Physiol,2014,99(9):1154-1162.
[14]Meng XM,Nikolic-Paterson DJ,Lan HY.TGF-β:the master regulator of fibrosis[J].Nat Rev Nephrol,2016,12(6):325-338.
Effect of genistein on deposition of extracellular matrix in uremic rats
WangHao1,FengBing1△,ZhuChao1,YuJianping2,HuangBaozhuan3
(1.DepartmentofNephrology,No. 411HospitalofPLA,Shanghai200081,China;2.DepartmentofNephrology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China;3.DepartmentofNephrology,XuhuiDistrictCentralHospital,Shanghai200031,China)
Objective To investigate the effect of genistein on deposition of extracellular matrix(ECM) in uremic rats and its mechanism.Methods The uremic rat model was established by 5/6 nephrectomy.The model rats were divided into the genistein group(G) and control group (C).The sham-operation group served as the normal control(S).Urinary protein and biochemical indexes before operation,at postoperative 4,8 weeks were measured in various groups.The pathologic changes of renal tissue were observed.The glomerular sclerosis index(GSI) was evaluated by the semi-quantitative method.fibronectin(FN) and type Ⅳcollagen(ColⅣ) deposition situation were detected by using the immunohistochemical method.Western blot and RT-PCR were used to measure the protein expression and mRNA transcription of TGF-β1.Results Comparing postoperative 4 weeks with the group C,the urinary protein excretion amount was decreased[(11.63±2.07)mg/dvs.(19.93±3.19)mg/d,allP<0.01],serum urea nitrogen and creatinine levels of the group G were decreased[(9.39±0.59)mmol/Lvs.(12.09±0.78)mmol/L,(65.11±3.79)mmol/Lvs.(77.63±3.20)μmol/L,allP<0.01].Until postoperative 8 weeks,the urinary protein excretion amount was decreased and the decrease of serum urea nitrogen and creatinine levels was more obvious.The deposition of ColⅣ and FN in renal glomerulus was lower than that of the control group[(17.30±1.96)%vs.(24.68±3.97)%;(18.26±2.31)%vs.(29.35±4.15)%,allP<0.01].Glomerular sclerosis was significantly alleviated.The TGF-β1mRNA and protein expression were attenuated (P<0.05).Conclusion Genistein can reduce the deposition of ECM in uremic rats and has a protective effect on kidney.
genistein;uremia;rats,Sprague-Dawley;collagen type Ⅳ;fibronectin;transforming growth factor beta1
? 著·
10.3969/j.issn.1671-8348.2017.07.005
王浩(1973-),副主任醫師,碩士研究生,主要從事腎臟病營養學研究。△
,E-mail:fengbing411snk@163.com。
R459.3
A
1671-8348(2017)07-0879-04
2016-08-12
2016-11-26)

