活血方與陽和湯抗apoE-/-小鼠動脈粥樣硬化并發非酒精性脂肪肝的比較研究?
姜 楠,袁曉雯,薛 欣,陶旭光,喬艷雪,李 蕊,陳 冰,李玉梅,胡鏡清△△,馬雅鑾△
(1. 中國中醫科學院中醫基礎理論研究所,北京 100700; 2. 首都醫科大學附屬北京地壇醫院傳染病研究所,北京 100015; 3. 新發突發傳染病研究北京市重點實驗室,北京 100015)
高脂血癥(hyperlipidemia, HP)的發生與長期攝入高脂飲食、脂質代謝障礙有關。高血脂不僅觸發和加速動脈粥樣硬化(atherosclerosis,AS),還可引起肝臟脂質代謝負擔加重,導致非酒精性脂肪性肝病(none- alcholic fatty liver disease,NAFLD)[1-2]。高脂血癥引發機體全身慢性的炎癥反應,與炎性細胞因子、單核/巨噬細胞為基礎的免疫損傷過程密切相關[3]。因此,采用藥物減輕高脂所致的免疫損傷,可以抑制或延緩高脂血癥向AS和NAFLD的發生發展。
祛痰化瘀方是中國中醫科學院中醫基礎理論研究所胡鏡清研究員多年來治療高脂血癥/AS與心腦疾病等痰瘀互結證的經驗方。前期研究證實,祛痰化瘀方具有抗炎和抗AS作用[4-5]。活血方是祛痰化瘀方的精簡方,主要包括桃仁、生地、丹皮、干姜、羌活等活血類藥物。AS斑塊可由氣血虛而寒痰凝滯所致,呈現漫腫無頭、色澤不變、不熱不疼的陰疽癥狀。治療陰疽的代表方陽和湯出自《外科證治全生集》為溫里劑,具有溫陽補血、散寒通滯之功效,文獻報道其對AS和冠心病具有治療作用[6-8]。本文采用apoE-/-小鼠高脂喂養,探討并比較活血方與陽和湯能否緩解高脂所致的免疫壓力,以及延緩AS斑塊形成和NAFLD的發生發展。
1 材料與方法
1.1 藥物與試劑
活血方組成:桃仁、生地、丹皮、干姜、羌活、黃連,陽和湯組成:熟地、肉桂(去皮研粉)、麻黃、鹿角膠、白芥子、姜炭、生甘草,活血方和陽和湯藥材購于北京同仁堂藥店;抗小鼠CD11b-PercpCy5.5、Gr1-APC、CD48-FITC、TLR4-PE抗體和紅細胞裂解液為美國BD Pharmingen公司產品;小鼠細胞因子Bio-Plex懸液芯片試劑盒購自MERCK公司;RNA提取試劑盒購自Quagen公司;逆轉錄試劑盒、實時熒光定量PCR試劑盒、小鼠實時熒光定量PCR探針甘油醛-3-磷酸脫氫酶(glyceralde hyde-3-phosphate dehydrogenase, GAPDH)、腫瘤壞死因子-a(Tumor Necrosis Factor-a, TNF-a)、白介素1β(Interleukin-1β, IL-1b)、IL-6、單核細胞趨化蛋白(monocyte chemo- attractant protein-1, MCP-1)、干擾素-g(interferon-g, IFN-g)和一氧化氮合酶-2(nitric oxide synthase-2, NOS-2) 購自ABI公司;生化試劑購于日本和光公司;FACS Callibur流式細胞儀為美國BD公司產品;Bio-PlexTM 200 System懸液芯片檢測儀和C1000TMThermal Cycler實時定量PCR儀為美國BIO-RAD公司產品;BECKMAN CX4全自動生化分析儀為美國貝克曼庫爾特公司產品。
1.2 分組及處理
所有實驗用鼠均購自北京大學實驗動物中心(動物許可證號SCXK(京)2011-0012),并飼養于SPF條件下。實驗采用10周齡野生C57BL/6和apoE-/-雌性小鼠,體質量(20±2 g),每組8只。高脂飼料含78.85%基礎飼料,0.15%膽固醇,21%脂肪。C57BL/6+普食為對照;apoE-/-小鼠分為apoE-/-+普食、apoE-/-+高脂、apoE-/-+高脂+活血方、apoE-/-+高脂+陽和湯干預組。干預組每天給予臨床等效劑量,其他小組采用等量純凈水灌胃。
18周后,小鼠在異戊烷吸入麻醉下摘眼球采EDTA抗凝血,離心800 g 10 min后獲取血漿,-80 ℃保存,用于生化檢測和細胞因子懸液芯片檢測備用。血細胞用于流式細胞儀檢測,剝離胸腹主動脈和肝臟用于病理檢測和實時定量PCR檢測。
1.3 血脂水平測定
BECKMAN CX4全自動生化分析儀,日本和光公司試劑,常規測定各組血漿膽固醇(cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)、谷丙轉氨酶(alanine aminotransferase,ALT)和谷草轉氨酶(aspartate transaminase,AST)水平。
1.4 外周血單核細胞及表面受體TLR4的表達檢測
血細胞加入獲取血漿等量的PBS,加1X紅細胞裂解液裂解紅細胞后,應用抗小鼠CD11b-PercpCy5.5、Gr-1-APC、CD48-FITC和TLR4-PE抗體直接法標記外周血白細胞,FACS Callibur流式細胞儀檢測各組動物外周血單核細胞、單核細胞亞型比例及其表面toll樣受體(Toll-like receptor 4, TLR4)的表達[5]。
1.5 細胞因子測定
各組動物血漿應用小鼠細胞因子懸液芯片試劑盒測定,嚴格按試劑盒說明書進行操作,Bio-PlexTM 200 System懸液芯片檢測儀檢測細胞因子IL-10、Il-1β、IL-6、MCP-1、巨噬細胞集落刺激因子(Macrophage colony stimulating factor, M-CSF)和TNFα的表達水平。
1.6 病理染色
剝離胸腹主動脈用4%多聚甲醛固定,經脫水、透明浸蠟、包埋、切片、攤片、HE染色后觀察。取肝臟右上葉用4%多聚甲醛固定,經20%蔗糖脫水,OCT包埋、冰凍切片油紅O染色。
1.7 實時定量PCR檢測
剝離胸腹主動脈,剪取其主動脈弓少量的胸主動脈約1 cm,TRIzol法提取總RNA,逆轉錄成cDNA,應用C1000TMThermal Cycler實時定量PCR儀熒光定量PCR檢測炎性因子TNF-a、IL-6、MCP-1、IFN-γ、NOS2和IL-1b 表達,使用ABI SDS 7500軟件分析結果。
1.8 統計學方法
2 結果
2.1 血脂和肝功能水平變化
表1顯示,普食狀態下apoE-/-小鼠血脂TC和LDL水平顯著高于C57BL/6小鼠,HDL水平顯著低于野生小鼠(P<0.01)。18周高脂飲食apoE-/-模型小鼠的TC和LDL水平顯著增高(P<0.01);給予活血方和陽和湯干預后,模型小鼠TC、TG、LDL和HDL水平未見明顯改變(P>0.05)。C57BL/6小鼠比較,apoE-/-普食小鼠肝功能ALT水平升高(P<0.05),AST水平無明顯改變(P>0.05);18周高脂飲食apoE-/-模型小鼠的ALT和AST水平無明顯改變(P>0.05);活血方和陽和湯干預后模型小鼠ALT、AST水平未見明顯改變(P>0.05)。
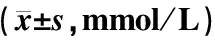
表1 各組小鼠血脂和肝功能水平比較
注:與野生普食組比較:*P<0.05,**P<0.001;與apoE-/-高脂組比較:▲▲P<0.001
2.2 外周血單核細胞及其炎癥亞型比例以及表面受體TLR4表達水平比較
表2顯示,飼養18周后apoE-/-普食小鼠與C57BL/6小鼠比較,外周血單核細胞及其Ly6C++比例無明顯變化(P>0.05),表面受體TLR4表達水平無明顯影響。18周的高脂飲食顯著增加apoE-/-鼠外周血單核細胞比例(P<0.05)和Ly6C++比例(P<0.05),其表面受體TLR4表達有增高趨勢,但差異無統計學意義(P>0.05)。活血方干預18周后,單核細胞及其炎癥亞型Ly6C++比例顯著降低(P<0.05),單核細胞和Ly6C++表面受體TLR4水平顯著降低(P<0.05);陽和湯干預后,單核細胞比例無明顯改變,但Ly6C++比例顯著降低(P<0.05),單核細胞和Ly6C++表面受體TLR4水平顯著降低(P<0.05)。
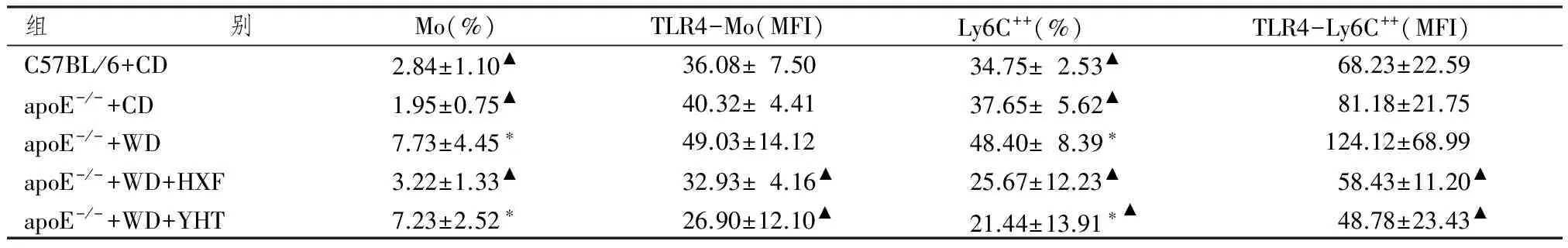
表2 各組動物單核細胞及Ly6C++亞型比例與表面受體TLR4表達水平比較
注:與野生普食組比較:*P<0.05;與apoE-/-高脂組比較:▲▲P<0.01
2.3 血漿細胞細胞因子表達水平的比較
表3顯示,我們采用懸液芯片檢測各組小鼠外周血細胞因子表達水平。結果發現,與C57BL/6小鼠比較,apoE-/-普食小鼠血漿細胞因子IL-10、Il-1β、IL-6、MCP-1、M-CSF和TNFα表達無明顯改變(P>0.05),高脂飲食的apoE-/-小鼠除MCP-1和M-CSF表達水平顯著增高外(P<0.05),IL-10、IL-1b和TNFα水平增加,但差異無統計學意義(P>0.05);活血方干預后,小鼠血漿細胞因子M-CSF水平顯著降低(P<0.05),Il-1β、IL-10、MCP-1和TNFα水平降低,但差異無統計學意義(P>0.05);陽和湯干預后,細胞因子水平與高脂飲食組比較無明顯改善。
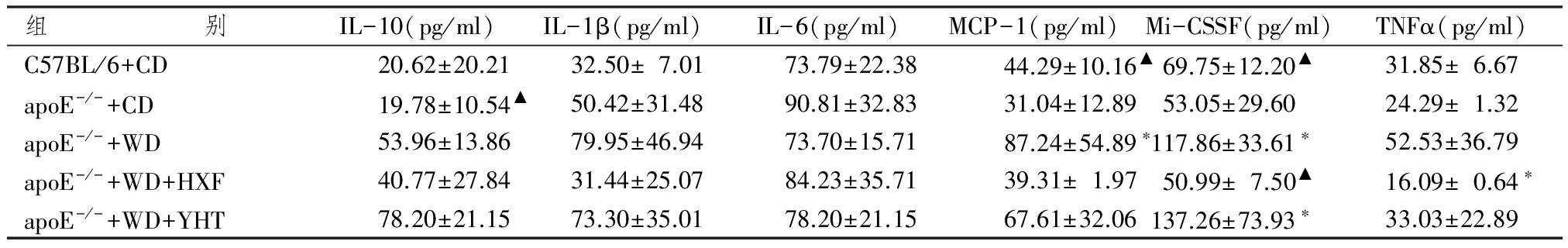
表3 各組動物血漿細胞因子表達水平
注:與野生普食組比較:*P<0.05;與apoE-/-高脂組比較:▲P<0.05
2.4 各組動物主動脈細胞因子mRNA表達水平比較
圖1表4顯示,10周齡apoE-/-小鼠普食飼養18周后,病理檢測可見明顯的主動脈粥樣硬化斑塊。因主動脈血管粥樣硬化斑塊不規則且分布不均勻,難以鏡下定量比較,因此我們取主動脈根部1 cm組織提取mRNA,實時定量PCR檢測主動脈血管局部炎癥因子表達。

圖1 HE染色檢測主動脈病理組織變化比較

組 別TNF-αIL-6MCP-1IFN-γNOS-2IL-1βC57BL/6+CD1.18±0.86▲▲1.36±1.171.40±1.48▲▲1.49±1.96▲1.12±0.551.11±0.62▲▲apoE-/-+CD1.91±0.87▲▲0.64±0.401.83±0.98▲▲5.01±2.58?1.11±0.382.31±1.13?▲▲apoE-/-+WD11.73±5.93??0.92±1.066.58±3.26??5.54±1.81?1.67±1.129.69±4.87??apoE-/-+WD+HXF0.17±0.05?▲▲0.08±0.04?▲0.30±0.06?▲▲0.32±0.09▲▲0.50±0.230.69±0.24▲▲apoE-/-+WD+YHT0.30±0.04?▲▲0.62±0.270.36±0.11▲▲1.99±0.50▲▲0.59±0.090.73±1.00▲▲
注:與野生普食組比較:*P<0.05,**P<0.01;與apoE-/-高脂組比較:▲P<0.05,▲▲P<0.01
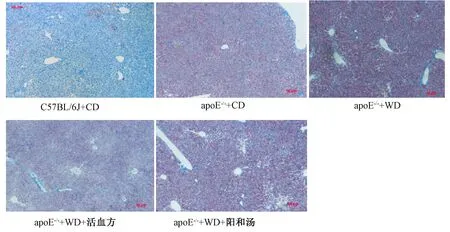
圖2 油紅O染色檢測肝臟病理組織變化比較
與既往研究結果一致,野生普食小鼠比較,apoE-/-普食小鼠主動脈血管壁炎癥因子IL-1b和 IFN-g mRNA水平顯著升高(P<0.05);而接受高脂飲食后,apoE-/-小鼠主動脈血管壁炎癥因子TNFα、Il-1b、MCP-1和 IFN-γ mRNA水平顯著升高(P<0.01和P<0.05),提示高脂血癥導致顯著的血管炎癥反應。活血方干預18周后,TNFα、Il-1b、MCP-1、IFN-γ和NOS-2 mRNA水平顯著降低(P<0.01和P<0.05),陽和湯干預后,TNFα、Il-1b、IL-6、MCP-1、IFN-γ和NOS-2 mRNA水平顯著降低(P<0.01和P<0.05),提示活血方和陽和湯均可減輕高脂導致的主動脈血管局部免疫損傷,活血方對血管局部的作用較陽和湯顯著。
2.5 各組動物肝臟病理檢測細胞因子mRNA表達水平比較
圖2顯示,10周齡apoE-/-小鼠普食飼養18周后,肝臟油紅O染色可見肝細胞內富含脂滴,油紅O染色呈陽性,給予高脂飲食后,可見油紅O染色陽性增強;活血方組肝細胞內脂滴含量減少,而油紅O染色呈現以血管為中心油紅O染色減弱;陽和湯組肝臟油紅O染色較模型組稍弱。
表5顯示,實時定量PCR檢測各組肝臟組織炎癥因子與主動脈血管組織結果一致。與野生普食小鼠比較,apoE-/-普食組小鼠肝臟組織炎癥因子TNFα、MCP-1和IL-1b mRNA水平顯著升高(P<0.01),IL-6、IFN-γ和NOS-2 mRNA水平顯著降低(P<0.01和P<0.05);而接受高脂飲食后,apoE-/-小鼠肝臟組織炎癥因子TNFα、MCP-1和IL-6 mRNA水平進一步升高(與apoE-/-普食組比較P<0.01和P<0.05),提示apoE-/-基因敲除導致顯著的肝臟炎癥反應,高脂飲食進一步加重肝臟免疫損傷。活血方干預18周后,TNFα、MCP-1、IL-1b、IL-6、IFN-γ和NOS-2mRNA水平顯著降低(P<0.01和P<0.05);陽和湯干預后,TNFα、MCP-1、IL-1b、IL-6和NOS-2mRNA水平顯著降低(P<0.01和P<0.05),提示活血方與陽和湯均可以減輕高脂導致的肝臟免疫損傷,活血方減輕肝臟損傷效果較陽和湯顯著。
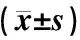
表5 各組動物肝臟炎癥因子相對mRNA表達水平比較
注:與野生普食組比較:*P<0.05,**P<0.01;與apoE-/-高脂組比較:▲P<0.05,▲▲P<0.01
3 討論
高脂血癥促進AS和NAFLD形成[1-2],其中LDL-C是CHD及AS的危險因素,且與肝臟TG含量密切相關[9]。肝臟脂肪病變會通過提高血漿中TC、LDL-C的濃度,降低HDL-C的濃度加重AS的進展[10]。免疫損傷是AS和NAFLD的共性特征[11]。長期高血脂促進氧化應激、ox-LDL造成血管內皮細胞損傷,促進單核細胞趨化并分化成巨噬細胞吞噬脂質形成泡沫細胞沉積于血管壁形成AS[12]。同時大量的游離脂肪酸、甘油進入肝臟,超過肝臟的消化、轉化、代謝能力,大量的脂肪在肝細胞內蓄積,并通過Kupffer細胞、細胞因子等復雜的炎癥和免疫機制誘導NAFLD的形成[13]。因此,高脂血癥導致慢性全身性炎癥狀態,加重血管和肝臟局部炎性病變[9],加劇AS和NAFLD的發生發展。
本研究采用apoE-/-小鼠18周高脂飲食,從模型組血脂水平和主動脈血管HE染色檢測到AS斑塊,說明AS模型成功。同時我們發現,模型組小鼠肝組織油紅O染色陽性,病理特征有明顯的肝細胞脂肪病變。結合模型組血脂,參考中華醫學會2010年所推薦的NAFLD診斷標準[14],可將模型組小鼠診斷為NAFLD。在上述研究基礎上,我們采用高脂飲食喂飼apoE-/-小鼠,分別給予活血方和陽和湯干預18周,探討和比較2種方劑對于AS并發NAFLD小鼠的作用。結果我們發現,活血方能減輕高脂所致的免疫損傷,不僅改善AS還可抑制NAFLD;陽和湯的免疫調節作用較活血方弱,對AS和NAFLD抑制作用也不如活血方顯著。我們前期研究還發現,活血方與陽和湯對于AS和NAFLD防治作用并不依賴于降脂,而是通過調節免疫發揮作用。另外給藥干預18周,肝功能無明顯改變,說明18周活血方與陽和湯干預未造成藥物性肝損傷。
研究證明,免疫損傷在AS和NAFLD發生發展中在起重要作用,表現為一系列的全身和局部炎癥反應[13]。對于系統炎癥反應,活血方降低外周血單核細胞、炎癥型單核細胞比例及其表面受體TLR4表達,陽和湯僅僅降低炎癥型單核細胞比例和表面受體TLR4表達;對于血漿炎癥因子,活血方降低炎癥因子M-CSF、IL-10、IL-1b、MCP-1和TNF-a水平,陽和湯僅僅降低TNF-a水平,可見對于系統性炎癥反應活血方抗炎作用強且全面,陽和湯作用弱且局限。對于血管和肝臟局部的免疫損傷,活血方和陽和湯明顯降低主動脈血管炎癥因子TNF-a、MCP-1、IFN-γ、NOS2和IL-1b表達,活血方降低效果更為顯著。活血方和陽和湯的抗炎機制不同、作用強度不同,導致的作用結果也不相同。長期干預活血方減輕肝細胞脂質沉積,陽和湯改善血管肝臟病理損傷不如活血方明顯。我們推測,活血方因活血行氣,氣行則血行,通過氣行和血行廣泛作用于全身血管乃至微血管,且作用直接而快速。陽和湯溫陽疏布,作用于整體緩慢而溫和,相形之下抗炎抗AS效果較慢且弱,不如活血方立竿見影。
雖然活血方與陽和湯免疫調節的作用機制、作用強度不同,但是我們發現,不論是活血方還是陽和湯對于局部炎癥反應影響要優于對其全身炎癥反應的影響,我們推測與選擇的疾病模型、疾病發生部位直接相關,治療的目標是改善病變部位,所以活血方與陽和湯的主要免疫調節靶點在血管和肝臟局部。
綜上所述,活血方干預主要抑制apoE-/-小鼠
關。AD自噬的激活影響β-分泌酶(BACE1)轉運到溶酶體降解,增加了軸突BACE1積累,使得β-淀粉樣前體(APP)在BACE1作用下裂解產生過多的Aβ[17]。已有學者提出, AD病人大腦皮層和海馬神經細胞體內存在數量較多的自噬體,LC3-Ⅱ表達升高[18];老齡AD小鼠腦內自噬高于正常,LC3-Ⅱ蛋白水平也增加[19]。Beclin1也參與Aβ代謝,所以自噬參與 Aβ生成和代謝。本研究AD模型大鼠海馬LC3、Beclin1表達升高,自噬上升可影響神經元Aβ水平[19],使用GB后AD大鼠海馬LC3和Beclin1降低。結合上述討論認為,GB降低自噬可能是通過減少神經元自噬體數量及Aβ及其前體APP、提高突觸蛋白表達、減少突觸丟失、改善學習記憶的。自噬與AD聯系密切,GB通過調控自噬改善AD相關學習記憶,但其中的具體作用機制尚需進一步探討,以期為闡明GB改善AD學習記憶能力的機制奠定理論和實驗基礎。
[1] WEI L, JIA Y, YONG L, et al. Elevation of brain magnesium prevents synaptic loss and reverses cognitive deficits in Alzheimer’s disease mouse model[J]. Molecular Brain, 2014, 7(1):8423-8441.
[2] POZUETA J, LEFORT R, SHELANSKI ML. Synaptic changes in Alzheimer’s disease and its models[J]. Neuroscience, 2013, 251:51-65.
[3] LIPINSKI MM, ZHENG B, LU T, et al. Genome wide analysis reveals mechanisms modulating autophagy in normal brain aging and in Alzheimer’s disease.[J] Proc Natl Acad Sci USA, 2010, 107:14164-14169.
[4] SANCHEZ-VARO R1, TRUJILLO-ESTRADA L, SANCHEZ-MEJIAS E, et al. Abnormal accumulation of autophagic vesicles correlates with axonal and synapticpathology in young Alzheimer’s mice hippocampus[J]. Acta Neuropathol, 2012,123(1):53-70.
[5] CHEN Y, WEI G, NIE H, et al. beta-Asarone prevents autophagy and synaptic loss by reducing ROCK expression in asenescence-accelerated prone 8 mice[J]. Brain Res,2 014, 1552: 41-54.
[6] BATE C, TAYBEI M, WILLIAMS BA. Ginkgolides protect against amyloid-β1-42-mediated synapse damage in vitro[J]. Mol Neurodegeneration, 2008, 3(1): 127-131.
[7] YANG P, CAI X, ZHOU K, et al. A novel oil-body nanoemulsion formulation of ginkgolide B: pharmacokinetics study and in vivo pharmacodynamics evaluations[J]. J Pharm Sci, 2014,103(4): 1075-1084.
[8] CLAUDIA FEREZ-CRUZ. Reduced spine density in specific regions of CA1 pyramidal neurons in two transgenic mouse models of Alzheimer’s disease[J]. J Neurosci, 2011, 31 (10): 3926-3934.
[9] CLARE R, KING VG, WIRENFELDT M, et al. Synapse loss in dementias[J]. J Neurosci Res, 2010,88 (10): 2083-2090.
[10] 張均田. 神經元—突觸丟失與老年癡呆[J]. 神經藥理學報, 2011,1(1):1-15.
[11] SCHEFF SW, PRICE DA, SCHMITT FA, et al. Hippocampal synaptic loss in early Alzheimer’s disease and mild cognitive impairment[J]. Neurobiol Aging, 2006,27(10): 1372-1384.
[12] 羅磊,杜艷軍. Aβ1-40、Aβ1-42與Aβ25-35在阿爾茨海默病模型復制中的評價[J]. 中國老年學雜志, 2014,9:2585-2587.
[13] 唐睿. 阿爾茨海默病發病機理與治療策略[J]. 中山大學研究生學刊:自然科學醫學版,2013,34(2):31-42.
[14] 郝莉,賀改英,張志雄. 銀杏酮酯對小鼠學習記憶能力及海馬神經炎癥反應的影響[J] . 中國中醫藥信息雜志, 2014,21(8):49-53.
[15] 郝莉,徐玉英,任秀花,等. 銀杏酮酯對自然衰老大鼠學習記憶及海馬、前額葉皮層c-fos、Caspase-3和Caspase-8表達的影響[J]. 中藥藥理與臨床, 2015,31(3):96-100.
[16] KENJI SUGAWARA,NOBUO N. SUZUKI. The crystal structure of microtubule-associated protein light chain 3, a mammalian homologue of Saccharomyces cerevisiae Atg8[J]. Genes Cells,2004,9(7): 611-618.
[17] FENG T, TAMMINENI P, AGRAWAL C, et al. Autophagy-Mediated Regulation of BACE1 Trafficking and Degradation[J]. J Biol Chem, 2017,292(5): 1679-1690.
[18] ZHANG X,HENG X,LI T,et al. Longterm treatment with lithium alleviates memory deficits and reduces amyloid-β production in an aged Alzheimer’s disease transgenic mouse model[J].J Alzheimers Dis, 2011,24(4): 739-749.
[19] 李麗喜, 章素芳, 張鑫,等. 阿爾茨海默病小鼠大腦和脊髓自噬變化的研究[J]. 上海交通大學學報:醫學版, 2012,32(5): 536-542.

