炎癥反應與慢性阻塞性肺疾病相關肺動脈高壓及其血液高凝狀態的關系
李雪英,胡蘇萍,陳國忠,胡紅玲,趙蘇
(1武漢市中心醫院,武漢430014;2武漢大學人民醫院)
炎癥反應與慢性阻塞性肺疾病相關肺動脈高壓及其血液高凝狀態的關系
李雪英1,胡蘇萍2,陳國忠2,胡紅玲1,趙蘇1
(1武漢市中心醫院,武漢430014;2武漢大學人民醫院)
目的 探討炎癥反應與慢性阻塞性肺疾病(COPD)相關肺動脈高壓及其高凝狀態的關系。方法 收集COPD患者80例,根據心臟超聲估測肺動脈收縮壓(PASP),以PASP 40 mmHg為界將患者分為COPD伴肺動脈高壓組和COPD無肺動脈高壓組兩組(每組40例),檢測兩組血清C反應蛋白(CRP)、白介素6(IL-6)、白介素8(IL-8)、腫瘤壞死因子-α(TNF-α)、腦鈉肽(BNP)、D-二聚體(D-D)、纖維蛋白原(FIB)、紅細胞壓積(HCT),比較兩組各項檢測的差異,分析炎性因子與肺動脈壓、D-D的相關性以及肺動脈高壓、高凝狀態的影響因素。結果 肺動脈高壓組血清CRP、IL-6、IL-8、TNF-α、D-D、FIB、BNP水平高于無肺動脈高壓組(P均<0.05)。偏相關性分析顯示,CRP、IL-6、IL-8水平與PASP呈正相關,PaO2與PASP呈負相關(r分別為 0.387、0.611、0.412、-0.576,P均<0.05),CRP水平與D-D呈正相關(r=0.379,P<0.05)。二元Logistic回歸分析示,CRP、IL-8、TNF-α為肺動脈高壓的危險因素;PaO2為其保護因素;CRP、IL-6為血液高凝狀態的危險因素。結論 炎癥反應及其炎癥因子對COPD相關肺動脈高壓及其血液高凝狀態形成有重要作用。
慢性阻塞性肺疾病;肺動脈高壓;C反應蛋白;白細胞介素6;白細胞介素8;D-二聚體;纖維蛋白原(FIB)
研究表明,慢性低氧可以導致低氧性肺動脈高壓[1],然而慢性阻塞性肺疾病(COPD)的病變程度與肺動脈高壓、肺動脈高壓與低氧程度均無正相關關系[2]。在長期吸煙和輕度COPD (無低氧血癥) 患者中同樣可以觀察到肺血管重建和內皮細胞功能異常,長期吸氧也并不能逆轉肺動脈高壓[3]。由此可見,低氧血癥并非COPD繼發肺動脈高壓的唯一因素。近年來,炎癥及反復微小血栓的形成與COPD相關的肺動脈高壓的關系研究日益受到重視。炎性細胞的浸潤、炎性因子的聚集可激活補體系統及增強氧化應激反應,直接或間接損傷血管內皮細胞,引起血小板的聚集、黏附,進一步激活機體凝血系統,使機體呈現高凝狀態。為此,本研究對炎癥反應與COPD相關肺動脈高壓及其高凝狀態的關系進行了探討。
1 資料與方法
1.1 臨床資料 篩選武漢大學人民醫院呼吸內科2011年6月~2012年12月就診的穩定期COPD患者80例,男62例、女18例,年齡51~82(70±9)歲;第1秒用力呼氣量占用力肺活量百分比為(53±8)%,第1秒用力呼氣量占預計值百分比為(55±11)%。納入標準:①診斷符合2006年COPD全球倡議;②支氣管舒張試驗陰性;③至少近4周咳嗽、咳痰、喘息癥狀穩定。排除標準:①不符合上述納入標準者;②胸部高分辨率CT提示存在肺炎、肺間質纖維化者;心臟彩色多普勒超聲提示心臟瓣膜病、高血壓心臟病者;多導睡眠監測提示睡眠呼吸暫停低通氣綜合征者;CT肺動脈造影提示肺栓塞者;血生化表明存在肝腎疾病者,有風濕免疫系統性疾病、冠心病病史及近期手術者;③資料不全影響判斷者。
1.2 肺動脈收縮壓(PASP)檢測 采用彩色多普勒超聲,選擇有經驗的超聲科醫師專人專機操作。患者靜息狀態時選擇胸骨旁大動脈短軸、右心室流入道和心尖五腔室或四腔室切面,測定三尖瓣最大的返流速度值。按照改良的Bernoulli方程,收縮期右房、右室壓差即跨瓣壓(△V)。PASP根據跨瓣壓計算,右心室大小正常,PASP=△V+5 mmHg;右心室增大,PASP=△V+10 mmHg[4,5]。當PASP超過100 mmHg時,心臟超聲估測值明顯低于經右心導管測得值[6],故此部分患者不納入本研究。依據2007年中華醫學會心血管分會發布的肺動脈高壓篩查診斷與治療專家共識[7],PASP≥40 mmHg時則認為存在肺動脈高壓,PASP<40 mmHg時則認為不存在肺動脈高壓;80例患者分為COPD伴肺動脈高壓組40例和COPD無肺動脈高壓組40例。
1.3 血液指標檢測 采用化學發光免疫法測定血清C反應蛋白(CRP)水平;酶聯免疫吸附法測定血清白介素6(IL-6)、白介素8(IL-8)、腫瘤壞死因子-α(TNF-α)、腦鈉肽(BNP);采用SYSMEX CA7000 全自動凝血分析儀測定D-二聚體(D-D)、纖維蛋白原(FIB)、紅細胞壓積(HCT)。
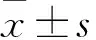
2 結果
2.1 兩組PASP比較 肺動脈高壓組PASP為(49±13)mmHg,無肺動脈高壓組PASP為(27±9)mmHg;與無肺動脈高壓組比較,肺動脈高壓組PASP增大(P均<0.05)。
2.2 兩組血液檢測指標比較 兩組血清CRP、IL-6、IL-8、TNF-α、D-D、FIB、BNP水平比較差異有統計學意義(P均<0.05),兩組HCT比較差異無統計學意義(P>0.05)。見表1。

表1 兩組血液檢測指標比較
注:與無肺動脈高壓組比較,*P<0.05。
2.3 炎癥因子、凝血因子及其與PASP的相關性 偏相關性分析顯示,CRP、IL-6、IL-8水平與PASP呈正相關,PaO2與PASP呈負相關(r分別為 0.387、0.611、0.412、-0.576,P均<0.05)。TNF-α水平與PASP無相關性(r=0.294,P>0.05);CRP水平與D-D水平呈正相關(r=0.379,P<0.05),IL-6、IL-8、TNF-α、PaO2水平與D-D水平無相關性(r分別為0.154、0.307、0.216、0.279,P均>0.05)。
2.4 肺動脈高壓的危險因素 以是否存在肺動脈高壓為因變量,CRP、IL-6、IL-8、TNF-α、PaO2(分別設為X1、X2、X3、X4、X5)為自變量,建立Logistic 回歸模型,顯示CRP、IL-8、TNF-α是肺動脈高壓的危險因素,PaO2是其保護因素。見表2。模型擬合度檢驗Cox&SnellR2和NegelkerkeR2分別為0.568、 0.757。

表2 肺動脈高壓危險因素的Logistic 回歸分析
2.5 血液高凝狀態的危險因素 以是否存在血液高凝狀態為因變量(D-D以0.5 mg/L為界分為存在血液高凝狀態組,不存在血液高凝狀態組),以血中CRP、IL-6、IL-8、TNF-α、PaO2(分別設為X1、X2、X3、X4、X5)為自變量,建立Logistic 回歸模型,表明CRP、IL-6是血液高凝狀態的危險因素。見表3。模型擬合度檢驗Cox&SnellR2和NegelkerkeR2分別為0.365、 0.500。

表3 血液高凝狀態危險因素的Logistic 回歸分析
3 討論
研究顯示,CRP、TNF-α等全身炎癥指標與肺動脈高壓存在相關性[8],而這些指標在COPD相關肺動脈高壓中研究較少。研究發現,伴肺動脈高壓組血清CRP、IL-6、IL-8、TNF-α水平較不伴肺動脈高壓組升高,與文獻報道相符[9]。CRP被認為是一種全身炎癥生物標記物,能很好地反映全身炎癥反應,與肺功能受損相關[10]。IL-6可誘導抗原刺激T細胞增殖,刺激B細胞成熟和上調局部免疫反應,還可誘導全身性炎癥因子的釋放,在COPD患者全身炎癥反應中起到一定作用。但也有研究表明IL-6可阻止脂多糖誘發的肺損傷,起到抗炎作用。IL-8在炎癥反應中趨化中性粒細胞、T淋巴細胞以及嗜堿性粒細胞至病灶部位,炎癥細胞浸潤加重缺氧、血管內皮細胞損傷、血管收縮及重塑等,參與了肺動脈高壓的形成和發展。TNF-α能誘發炎癥反應,促進肉芽腫形成和組織纖維化,降低肺動脈平滑肌細胞前列腺素的產生[11]。過度表達TNF-α的轉基因小鼠可以發展為肺氣腫及重度肺動脈高壓,而TNF-α受體缺陷的小鼠則未形成肺動脈高壓[12],這說明TNF-α與COPD患者氣道炎癥及肺血管重塑密切相關。在炎癥損傷與修復的過程中,炎癥細胞合成的血管內皮生長因子、轉化生長因子β等釋放增加及受體表達上調,促進氣道及肺小動脈平滑肌細胞、成纖維細胞增殖和細胞外基質沉積等參與肺血管結構重建,形成肺動脈高壓。本研究顯示,血清CRP、IL-6、IL-8水平與肺動脈壓呈正相關,PaO2與肺動脈壓呈負相關。TNF-α水平與肺動脈壓無相關性。
長期慢性缺氧可以導致缺氧性肺血管收縮、肺血管內皮細胞功能障礙及肺血管結構重建等引起肺動脈高壓。近年研究認為,一氧化氮、離子通道、一氧化碳-血紅素氧合酶體系、凋亡相關基因等也在缺氧引起肺動脈高壓過程中發揮一定作用。但也有文獻報道TNF-α與肺動脈壓兩者間存在相關性。本文以是否存在肺動脈高壓為因變量,血清CRP、IL-6、IL-8、TNF-α、PaO2為自變量,進行二元Logistic回歸分析,結果顯示CRP、IL-8、TNF-α是肺動脈高壓的危險因素,PaO2是其保護因素。其中以PaO2的回歸系數絕對值最大,表明PaO2對肺動脈高壓影響最大。一般來說,相關分析與回歸分析結果是一致的,且回歸分析可以定量揭示自變量對因變量影響的大小。本研究中TNF-α水平與肺動脈壓無相關性,但TNF-α水平升高是肺動脈高壓的危險因素,二者結果存在矛盾,此可能與樣本量較少、存在偏倚有關。
D-D是機體呈高凝狀態及纖溶亢進的標志 ,FIB升高是心血管疾病及血栓形成的重要危險因素之一。既往研究顯示COPD患者血液存在高凝狀態,急性加重期這種狀態則更加突出[13]。本研究中肺動脈高壓組患者FIB、D-D高于無肺動脈高壓組,提示COPD繼發肺動脈高壓患者血液高凝狀態更加明顯,反復持續的肺部血管微小血栓的形成是肺動脈高壓形成和發展的另一個重要因素。CRP可通過激活補體途徑促進血栓形成。IL-6等炎性因子還可增強血小板對凝血酶的反應性,故能增加血栓形成傾向。炎癥介質激活單核/巨噬細胞時能釋放更多微顆粒,可提前導致血管破損或斑塊破裂部位血栓快速形成。當微顆粒的實體成分磷脂小囊泡與炎性介質結合后,血管受損處可見大的血栓發生[14]。本文偏相關分析提示,CRP與D-D呈正相關,但暫無證據表明IL-6等炎癥因子與D-D存在相關性。以是否存在血液高凝狀態為因變量,血中CRP、IL-6、IL-8、TNF-α、PaO2為自變量,進行二元Logistic回歸分析,提示CRP、IL-6是血液高凝狀態的危險因素。由此可見,炎癥反應與血液高凝狀態及血栓形成也是密切相關的。然而,老年人生理狀態下D-D會出現升高。本研究中以一般人群D-D正常高值0.5 mg/L為界劃分出血液高凝狀態組,可能對結果造成一定的影響。
綜上所述,CRP、IL-6、IL-8水平與肺動脈壓呈正相關,CRP、IL-8、TNF-α為肺動脈高壓的危險因素,CRP、IL-6為血液高凝狀態的危險因素。炎癥反應參與了肺動脈高壓及血液高凝狀態的形成,防治COPD相關的肺動脈高壓在強調氧療的同時還需注重抗炎治療。
[1] 蔣明,王昌明,林云,等.低氧性肺動脈高壓和慢性支氣管炎、肺氣腫并肺動脈高壓動物模型的異同[J].臨床與實驗病理學雜志,2011,27(4):64-68.
[2] Wright JL,Levy RD,Churg A.Pulmonary hypertension in chronic obstructive pulmonary disease:current theories of pathogenesis and their implications for treatment [J].Thorax,2005,60(7):605-609.
[3] Fabbri LM,Luppi F,Beghé B,et al.Update in chronic obstructive pulmonary disease 2005 [J].Am J Respir Crit Care Med,2006,173(10):1056-1065.
[4] Fisher MR,Criner GJ,Fishman AP,et al.Estimating pulmonary artery pressures by echocardio graphy in patients with emphysema [J].Eur Respir J,2007,30(5):914-921.
[5] 張樹斌.臨床實用超聲心動圖學[M].北京:北京醫科大學中國協和醫科大學聯合出版社,1996:195.
[6] 荊志成,徐希奇,鄧可武,等.基于循證醫學證據的ACCP臨床診斷指南-超聲心動圖在肺動脈高壓診斷中的應用[J].中華醫學信息導報,2004,19(22):14.
[7] 中華醫學會心血管病分學會.肺動脈高壓篩查診斷與治療專家共識[J].中華心血管病雜志,2007,35(11):979-987.
[8] Langer F,Schramm R,Bauer M,et al.Cytokine response to pulmonary thromboendarterectomy [J].Chest,2004,126(1):135-141.
[9] 蔣延文,龐莉,方秋紅,等.血清炎性因子水平與慢性阻塞性肺疾病繼發肺動脈高壓的相關性研究[J].中華結核和呼吸雜志,2011,34(12):904-908.
[10] Walter RE,Wilk JB,Larson MG,et al.Systemic inflammation and COPD:the Framingham Heart Study [J].Chest,2008,133(1):19-25.
[11] Itoh A,Nishihira J,Makita H,et al.Effects of IL-1beta,TNF-alpha,and macrophage migration inhibitory factor on prostacyclin synthesis in rat pulmonary artery smooth muscle cells[J].Respirology,2003,8(4):467-472.
[12] Ortiz LA,Lasky J,Hamilton RJ,et al.Expression of TNF and the necessity of TNF receptors in bleomycin-induced lung injury in mice[J].Exp Lung Res,1998,24(6):721-743.
[13] 蘇毅.慢性阻塞肺病急性發作D二聚體、纖維蛋白原的變化及意義[J].臨床急診雜志,2008,9(2):21-22.
[14] Huber K,Beckmann R,Frank H,et al.Fibrinogen,t-PA,and PAI-1 plasma levels in patients with pulmonary hypertension [J].Am J Respir Crit Care Med,1994,150(4):929-933.
10.3969/j.issn.1002-266X.2017.01.025
R563.9
B
1002-266X(2017)01-0071-03
2016-08-06)

