高血壓病患者腦白質(zhì)疏松與血清神經(jīng)生化指標(biāo)的相關(guān)性
韋檸琳,陽(yáng)洪,吳鋼,彭日紅,劉立民
(廣西醫(yī)科大學(xué)第四附屬醫(yī)院,廣西柳州545005)
高血壓病患者腦白質(zhì)疏松與血清神經(jīng)生化指標(biāo)的相關(guān)性
韋檸琳,陽(yáng)洪,吳鋼,彭日紅,劉立民
(廣西醫(yī)科大學(xué)第四附屬醫(yī)院,廣西柳州545005)
目的 探討高血壓病患者腦白質(zhì)疏松(LA)與血清IL-6、神經(jīng)元特異性烯醇化酶(NSE)、TNF-α、基質(zhì)金屬蛋白酶-2(MMP-2)的關(guān)系。方法 根據(jù)頭顱MRI結(jié)果將確診的高血壓患者61例分為L(zhǎng)A組30例及非LA組31例,同時(shí)選取無(wú)高血壓正常健康者30例作為對(duì)照組;三組均行血清神經(jīng)生化指標(biāo)IL-6、NSE、TNF-α、MMP-2檢測(cè),并比較以上血清神經(jīng)生化指標(biāo)的差異。結(jié)果 與無(wú)LA組及對(duì)照組比較,LA組血清IL-6、TNF-α、MMP-2水平明顯升高,差異均具有統(tǒng)計(jì)學(xué)意義(P均<0.01);三組患者血清NSE水平比較差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。LA與IL-6、TNF-α、MMP-2呈正相關(guān)(r分別為0.048、0.601、0.655,P均<0.01)。結(jié)論 血清IL-6、TNF-α、MMP-2水平與LA發(fā)生密切相關(guān),可作為L(zhǎng)A改變的重要標(biāo)記物。
高血壓病;腦白質(zhì)疏松; 白介素6;神經(jīng)元特異性烯醇化酶;腫瘤壞死因子α;基質(zhì)金屬蛋白酶-2
腦白質(zhì)疏松(LA)是一種非特異性大腦白質(zhì)病變,是由多種病因引起的廣泛腦室周圍區(qū)腦白質(zhì)損害,是腦小血管病導(dǎo)致腦組織損傷的一個(gè)重要標(biāo)志[1]。關(guān)于LA的發(fā)病機(jī)制目前有多種學(xué)說(shuō),其中血管內(nèi)皮功能障礙[2,3]、缺血和低灌注[4,5]、血腦屏障破壞[6,7]被廣泛提及。研究發(fā)現(xiàn),白介素6(IL-6)、腫瘤壞死因子α(TNF-α)可能是LA的生物學(xué)標(biāo)記物。在腦損傷發(fā)病過(guò)程中,IL-6有可能加速了腦細(xì)胞的壞死和凋亡,進(jìn)而引起細(xì)胞內(nèi)神經(jīng)元特異性烯醇化酶(NSE)的過(guò)度釋放,IL-6、NSE均參加了腦白質(zhì)損傷的病理過(guò)程。在慢性腦缺血中,基質(zhì)金屬蛋白酶-2(MMP-2)可能通過(guò)過(guò)多的分解血管基底層和活化膠質(zhì)細(xì)胞而破壞血腦屏障的完整,可能為白質(zhì)損害的重要原因。本研究通過(guò)檢測(cè)血清中IL-6、NSE、TNF-α、MMP-2的水平,探討高血壓患者LA與上述神經(jīng)生化指標(biāo)的關(guān)系,旨在為臨床預(yù)防和治療LA提供理論依據(jù)。
1 資料與方法
1.1 臨床資料 選擇2015年1月~2016年1月在我院就診的高血壓患者61例,男29例、女32例,年齡51~80歲。以非藥物狀態(tài)下3次或3次以上非同日多次重復(fù)血壓測(cè)定所得的平均值為依據(jù),收縮壓≥140 mmHg和(或)舒張壓≥90 mmHg診斷為高血壓[8]。根據(jù)高血壓患者是否伴有LA改變,分為L(zhǎng)A組30例,無(wú)LA組31例。排除標(biāo)準(zhǔn):多發(fā)性硬化、一氧化碳中毒、腦外傷、腦腫瘤、阿爾茨海默病、血管炎引起的腦白質(zhì)損害、蛛網(wǎng)膜下腔出血后的梗阻性腦積水、腦炎、嚴(yán)重心肺腎功能不全。另選取無(wú)高血壓正常健康者30例為對(duì)照組,男14例、女16例,年齡50~76歲。本研究經(jīng)醫(yī)院倫理委員會(huì)批準(zhǔn),所有患者或其家屬簽屬知情同意書(shū)。
1.2 LA的診斷 采用德國(guó)西門(mén)子NOVUS 1.5T超導(dǎo)磁共振儀掃描頭顱檢查,由1名影像學(xué)主任醫(yī)師和1名神經(jīng)內(nèi)科副主任醫(yī)師進(jìn)行圖像判讀。LA磁共振檢查顯示為:大腦皮質(zhì)下白質(zhì)、腦室周圍及半卵圓中心的散在或者彌漫性病灶,呈T1像等或低信號(hào)、T2像和Flair像高信號(hào)。采用Wahlund等的4級(jí)標(biāo)準(zhǔn)(0~3級(jí))對(duì)患者腦白質(zhì)損害評(píng)級(jí)。0級(jí):側(cè)腦室周圍和深部白質(zhì)無(wú)高信號(hào),為無(wú)白質(zhì)損害;1級(jí):側(cè)腦室前后角信號(hào)呈帽狀或鉛筆樣,深部腦白質(zhì)高信號(hào)呈點(diǎn)狀,為輕度白質(zhì)損害;2級(jí):側(cè)腦室周圍高信號(hào)連接成圓環(huán)狀,深部腦白質(zhì)高信號(hào)開(kāi)始融合,為中度白質(zhì)損害;3級(jí):側(cè)腦室周圍信號(hào)不規(guī)則,延伸入深部白質(zhì),深部腦白質(zhì)高信號(hào)開(kāi)始大片狀融合,為重度白質(zhì)損害[9]。本研究將高血壓合并無(wú)白質(zhì)損害定義為無(wú)LA,合并輕、中、重度白質(zhì)損害定義為L(zhǎng)A。
1.3 血清TNF-α、IL-6、MMP-2、NSE水平檢測(cè) 利用酶聯(lián)免疫技術(shù)檢測(cè)血清TNF-α、IL-6、MMP-2水平,采用電化學(xué)發(fā)光法檢測(cè)血清NSE水平。
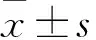
2 結(jié)果
2.1 三組性別、年齡、血清LDL、FPG水平比較 三組性別、年齡、血清LDL、FPG水平比較差異無(wú)統(tǒng)計(jì)學(xué)意義(P均>0.05)。見(jiàn)表1。

表1 三組性別、年齡、血清LDL、FPG水平比較
2.2 三組血清IL-6、NSE、TNF-α、MMP-2水平比較 與對(duì)照組及無(wú)LA組相比,LA組IL-6、TNF-α、MMP-2的表達(dá)均明顯升高,差異均具有統(tǒng)計(jì)學(xué)意義(P均<0.01),與對(duì)照組相比,無(wú)LA組IL-6、TNF-α、MMP-2的表達(dá)也升高(P均<0.05)。三組NSE水平比較未見(jiàn)統(tǒng)計(jì)學(xué)差異(P>0.05)。見(jiàn)表2。

表2 三組血清IL-6、NSE、TNF-α、MMP-2水平比較
注:與對(duì)照組比較,*P<0.01,▲P<0.05;與無(wú)LA組比較,△P<0.01。
2.3 LA與血清IL-6、TNF-α、MMP-2水平的關(guān)系 Spearman等級(jí)相關(guān)分析顯示,LA與IL-6、TNF-α、MMP-2呈正相關(guān)(r分別為0.048、0.601、0.655,P均<0.01),與NSE無(wú)相關(guān)性(r=0.143,P=0.176)。
3 討論
研究發(fā)現(xiàn),LA的病理改變主要是腦小動(dòng)脈脂質(zhì)透明樣變、腦小動(dòng)脈壁增厚、小血管重構(gòu)、血管內(nèi)皮破壞,與嚴(yán)重高血壓引起的小動(dòng)脈病變相關(guān)[10,11]。目前臨床尚缺乏LA檢測(cè)的神經(jīng)生化指標(biāo)。因此,迫切需要對(duì)LA的病理生理和神經(jīng)生化改變進(jìn)行研究,尋找可預(yù)測(cè)LA嚴(yán)重程度的神經(jīng)生化指標(biāo),為臨床上高血壓性LA的診治提供新思路。
腦白質(zhì)區(qū)炎癥反應(yīng)是腦缺血后在缺血灶及周圍存在顯著的炎性細(xì)胞浸潤(rùn)。在炎癥反應(yīng)過(guò)程中,內(nèi)皮細(xì)胞可促進(jìn)誘導(dǎo)型一氧化氮合酶及環(huán)氧合酶-2等促炎酶的表達(dá)、細(xì)胞因子TNF-α的釋放、細(xì)胞間黏附分子-1的合成,這些炎性物質(zhì)共同介導(dǎo)白細(xì)胞黏附至血管內(nèi)皮,穿過(guò)血管壁進(jìn)入腦實(shí)質(zhì),引起神經(jīng)細(xì)胞壞死和凋亡。本研究結(jié)果顯示,在高血壓合并LA組血清IL-6水平明顯高于非LA組,并且IL-6水平與LA存在正相關(guān)。Nagai等對(duì)137例出現(xiàn)記憶障礙的老年女性利用磁共振T2加權(quán)成像對(duì)其LA進(jìn)行評(píng)價(jià),顯示血清IL-6水平與腦室周圍高信號(hào)及深部白質(zhì)高信號(hào)評(píng)分顯著相關(guān)。這都表明IL-6可能是LA的一個(gè)重要標(biāo)記物[12]。但是,也有學(xué)者認(rèn)為兩者之間并無(wú)明顯相關(guān)性[13]。王敏等[5]制造慢性低灌注動(dòng)物模型,發(fā)現(xiàn)慢性缺血后期出現(xiàn)進(jìn)行性腦白質(zhì)病變,并觀察到TNF-α等炎性細(xì)胞因子在慢性低灌注過(guò)程中出現(xiàn)慢性持續(xù)性高表達(dá),提示TNF-α可能是LA的生物學(xué)標(biāo)記物。本研究LA組TNF-α水平較無(wú)LA組及正常健康對(duì)照組明顯升高,TNF-α水平與LA發(fā)生存在明顯相關(guān)。MMP-2通過(guò)分解血管基底層和活化膠質(zhì)細(xì)胞而破壞血腦屏障的完整,可能為腦白質(zhì)損害的重要原因[14]。研究發(fā)現(xiàn),自發(fā)性高血壓大鼠MMP-2在基因水平的表達(dá)較對(duì)照組大鼠顯著升高,并且與腦白質(zhì)損傷的嚴(yán)重程度有關(guān),基質(zhì)金屬蛋白酶導(dǎo)致的血腦屏障破壞參與了自發(fā)性高血壓大鼠腦白質(zhì)改變的病理生理過(guò)程[15]。本研究發(fā)現(xiàn)LA組患者M(jìn)MP-2水平顯著高于無(wú)LA組及正常健康對(duì)照組,并且MMP-2水平與LA存在正相關(guān)。三組NSE水平LA組最高,但比較NSE水平無(wú)統(tǒng)計(jì)學(xué)差異。
總之,血清IL-6、TNF-α、MMP-2水平可以作為小血管病損傷的一個(gè)標(biāo)記物,對(duì)高血壓病患者LA的診斷和治療有重要意義。但是,由于本研究樣本量相對(duì)偏少,結(jié)果有待大樣本、多中心的研究證實(shí)。
[1] Poggesi A,Pantoni L,Inzitari D,et al.2001-2011:A decade of the lADIS (leukoaraiosis and dISability) study:what have we learned about white matter changes and small-vessel disease[J].Cerebrovasc Dis,2011,32(6):577-588.
[2] Grueter BE,Schulz UG.Age-related cerebral white matter disease(1eukoaraiosis):a review[J].Postgrad Med J,2012,88(1036):79-87.
[3] Guo L,Zhu N,Guo Z,et al.Particulate matter(PMIO)exposure induces endothelial dysfunction and inflammation in rat brain[J].J Hazard Mater,2012,213-214:28-37.
[4] 王娟,張薇薇,魏微.腦白質(zhì)損傷與慢性缺血的相關(guān)性[J].中國(guó)卒中雜志,2010,5(2):168-173.
[5] 王敏,曹秉振.慢性低灌注大鼠血清及腦組織中ICAM-1、NF-κB65、TNF-α、IL-1β的表達(dá)[J].中風(fēng)與神經(jīng)疾病雜志,2012,29(11):974-978.
[6] Simpson JE,Wharton SB,Cooper J,et al.Alterations of the blood-brain barrier in cerebral white matter lesions in the ageing brain[J].Neurosci Lett,2010,486(3):246-251.
[7] Topakian R,Barrick TR,Howe FA,et al.Blood-brain barrier permeability is increased in normal-appearing white matter in patients with lacunar stroke and leucoraiosis[J].J Neurol Neurosurg Psychiatr,2010,81(2):192-197.
[8] 劉力生,王文,姚崇華.中國(guó)高血壓防治指南(2009基層版)[J].中華高血壓雜志,2010,18(1):11-30.
[9] Auriel E,Csiba L,Berenyi E,et al.Leukoaraiosis is associated with arterial wall thickness:a quantitative analysis[J].Neuropathology,2012,32(3):227-233.
[10] Wahlund LO,Barkhof F,Fazekas F,et al.A new rating scale for age-related white matter changes applicable to MRI and CT[J].Stroke,2001,32(6):1318-1322.
[11] 陳裴,屈傳強(qiáng),焉傳祝,等.自發(fā)性高血壓大鼠的腦白質(zhì)損傷及其炎癥反應(yīng)機(jī)制[J].中華神經(jīng)醫(yī)學(xué)雜志,2013,12(1):24-28.
[12] Nagai K,Kozaki K,Sonohara K,et al.Relationship between interleukin-6 and cerebral deep white matter and periventricular hyperintensity in elderly women[J].Geriatr Gerontol Int,2011,11(3):328-332.
[13] Aribisala BS,Wiseman S,Morris Z,et al.Circulating inflammatory markers are associated with magnetic resonance imaging-visible perivascular spaces but not directly with white matter hyperintensities[J].Stroke,2014,45(2):605-607.
[14] Nakaji K,Ihara M,Takahashi C,et al.Matrix metalloproteinase-2 plays a critical role in the pathogenesis of white matter lesions after chronic cerebral hypoperfusion in rodents[J].Stroke,2006,37(11):2816-2823.
[15] 屈傳強(qiáng),焉傳祝,陳裴,等.基質(zhì)金屬蛋白酶在LA癥血-腦脊液屏障機(jī)制中的實(shí)驗(yàn)研究[J].山東大學(xué)學(xué)報(bào)(醫(yī)學(xué)版),2012,50(10):23-27.
廣西壯族自治區(qū)衛(wèi)計(jì)委科學(xué)基金項(xiàng)目(Z2015146)。
10.3969/j.issn.1002-266X.2017.01.024
R544.1;R743.2
B
1002-266X(2017)01-0068-03
2016-08-28)

