哈薩克族原發性高血壓患者腎功能減退的相關因素分析
張明,王忠,陳少澤,張衛華,陶杰
(1石河子大學醫學院,新疆石河子832002;2石河子大學醫學院第一附屬醫院)
哈薩克族原發性高血壓患者腎功能減退的相關因素分析
張明1,王忠2,陳少澤2,張衛華1,陶杰1
(1石河子大學醫學院,新疆石河子832002;2石河子大學醫學院第一附屬醫院)
目的 探討新疆哈薩克族原發性高血壓患者腎小球濾過功能減退的相關因素。方法 隨機抽取新疆沙灣縣、瑪納斯縣等哈薩克族聚集地高血壓患者231例,利用簡化腎臟病膳食改良試驗方程估算腎小球濾過率(eGFR);根據eGFR水平將高血壓患者分成腎功能組減退組85例和腎功能正常組146例,檢測兩組血肌酐(Cr)、尿酸(UA)、總膽固醇(TC) 、甘油三酯(TG) 、空腹血糖(FPG)、低密度脂蛋白膽固醇( LDL-C) 、高密度脂蛋白膽固醇( HDL-C)、同型半胱氨酸(Hcy)等生化指標,同時測量其體質量指數(BMI)、腰臀比(WHR)、腰身比(WHtR)。采用Pearson相關及二元Logistics回歸分析法分析影響腎功能減退的相關因素。結果 兩組年齡、血壓、BMI、血Ccr、UA、TG、FPG、LDL-C、Hcy比較差異有統計學意義(P均<0.05)。高血壓患者eGFR與HDL-C呈正相關(P<0.05),與BMI、TG、LDL-C、UA、SBP、DBP呈負相關(P均<0.05)。矯正性別、年齡,血壓等因素后,二元Logistic回歸示UA、BMI、 LDL-C是高血壓患者腎功能減退的獨立危險因素(OR分別為1.010、0.642、2.067,P均<0.05) 。結論 新疆哈薩克族原發性高血壓患者腎功能減退是血壓、血脂、UA、BMI等因素共同作用的結果。
原發性高血壓;哈薩克族;腎小球濾過率
近年來,原發性高血壓及高血壓所導致的終末期腎病(ESRD)的發生率逐年上升。受生活方式及飲食習慣的影響,哈薩克族高血壓的發病率顯著高于同地區其他民族[1],ESRD發生率也相對較高。本文探討影響哈薩克族原發性高血壓患者腎小球濾過功能減退的相關因素,以便為預防腎臟損傷提供參考。
1 資料與方法
1.1 臨床資料 隨機抽取2013年8月~2015年3月在新疆瑪納斯縣、沙灣縣進行流行病學調查的哈薩克族人447例,嚴格按照《中國高血壓防治指南2010》關于高血壓的診斷標準診斷為高血壓231例。排除標準:繼發性高血壓、糖尿病、原發性腎病、合并急性感染、急性心腦血管疾病、嚴重肝腎損害疾病等。根據腎臟病透析預后質量指南的建議,將231例高血壓患者按估算腎小球濾過率(eGFR)水平分為兩組。腎功能減退組85例,男43例、女42例;腎功能正常組146例,男72例、女74例。兩組間性別構成比差異無統計學意義(P>0.05)。
1.2 生化指標及肥胖指標測定 研究對象均禁食12 h,抽取空腹靜脈血6 mL,4 000 r/min 離心8 min,分離血清,于當日測定血肌酐(Cr)、尿酸(UA)、總膽固醇(TC) 、甘油三酯(TG) 、空腹血糖(FPG)、低密度脂蛋白膽固醇( LDL-C) 、高密度脂蛋白膽固醇( HDL-C)、同型半胱氨酸(Hcy)等生化指標。同時測量研究對象體質量指數(BMI)、腰臀比(WHR)、腰身比(WHtR)。
1.3 eGFR計算及腎功能評估 利用針對我國患者的簡化“腎臟病膳食改良試驗”公式計算eGFR,eGFR=175×Cr(mg/dL)-1.234×年齡(歲)-0.179×性別(男=1,女=0.79),eGFR<90 mL/(min·1.70 m2)為腎功能減退,eGFR≥90 mL/(min·1.70 m2)為腎功能正常。
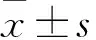
2 結果
2.1 兩組臨床資料比較 兩組年齡、血壓、BMI、血Cr、UA、TG、FPG、LDL-C、Hcy比較差異有統計學意義(P均<0.05)。見表1。

表1 兩組臨床資料比較
2.2 腎功能減退單因素分析 Pearson相關分析顯示,eGFR與HDL-C呈正相關(r=0.177,P<0.05),與BMI、UA、TG、LDL-C、Hcy、SBP、DBP呈負相關(r分別為-0.557、-0.395、-0.167、-0.151、-0.334、-0.235、-0.239,P均<0.05),與WHR、WHtR、FPG、TC無相關性(P均>0.05) 。
2.3 腎功能減退多因素回歸分析 以腎功能減退為應變量,將性別、年齡、UA、Hcy、HDL-C、LDL-C、TG、BMI、SBP、DBP作為自變量進行二元Logistic 回歸分析,顯示UA、BMI、LDL-C是高血壓患者腎功能減退的危險因素(OR分別為1.010、0.642、2.067,P均<0.05) 。
3 討論
高血壓是最常見的心血管危險因素,控制高血壓一直是臨床上控制心血管事件的重要目標。腎臟是高血壓器官損害的重要靶器官之一,早期預防早期發現腎臟損害可以延緩高血壓患者最終走向腎功能衰竭的進程。因此積極尋找高血壓腎病的獨立危險因素,可以對高血壓患者的生活質量提供安全保障。
Ren等[2]研究表明,BMI與高血壓性腎硬化患者的尿總蛋白排泄率和尿白蛋白排泄率獨立相關。目前肥胖造成腎功能損害的機制尚不明確,除血流動力學障礙、胰島素抵抗、腎組織缺氧外,足細胞損傷在腎損害的發生發展中也起到重要作用[3]。本研究發現,BMI與高血壓患者腎小球濾過率呈負相關,說明肥胖可使腎臟呈現高濾過狀態,從而損傷腎小球足細胞,最終造成腎臟的損傷。這與Wuerzner等[4]的研究結果相一致。一項針對36例肥胖患者的前瞻性研究發現,經過12個月的藥物與生活飲食習慣的干預,BMI、eGFR、尿蛋白均較干預前有所減低,證明降低BMI可降低腎病患者的尿蛋白水平,改善其腎小球濾過率[5]。
王妍[6]一項薈萃分析顯示,與對照組相比,高尿酸血癥患者發生急性腎損傷風險增加1.36倍。Ohta等[7]通過對104例高血壓患者進行10年的隨訪,發現在控制性別、年齡、血壓、降壓藥等因素后,Cr增高與腎功能獨立相關,適當的降低血Cr水平可減緩腎功能的損傷。目前認為Cr可通過氧化應激、炎癥反應、激活RAS系統及腎素-血管緊張素系統對腎臟造成嚴重損傷。此外,高尿酸血癥還可通過改變血流動力學。影響腎臟血流灌注的改變,從而導致腎功能急劇下降、急性腎損傷等多種腎臟及心血管疾病[8]。一項薈萃分析發現[9],血Cr水平與腎小球濾過率呈負相關,血Cr水平降低,腎小球濾過率升高。
馬儒林等[10]對新疆3935例哈薩克族居民流行病學調查顯示,新疆哈薩克族血脂異常標準化患病率普遍高于全國平均水平。本研究發現,LDL-C為高血壓患者腎小球濾過率損害的獨立危險因素。此外周紅霞等[11]通過對109例患兒的研究發現慢性腎臟疾病患者血TG、LDL-C、TC高于健康對照組,血HDL-C低于健康對照組。脂代謝異常主要通過促進動脈粥樣硬化來發揮其作用的。Yamashita等[12]研究發現,非蛋白尿的糖尿病腎病患者腎小球濾過率與外周血管動脈硬化獨立相關,血脂水平的改變可能是這一相關性的基礎。LDL-C造成腎損害的主要機制是通過脂質的沉積,促進巨噬細胞浸潤吞噬,最終造成腎實質的炎癥損害。此外升高的LDL-C還可通過損害內皮細胞、腎小球上皮細胞、系膜細胞使得腎小球發生硬化。David[13]的一項薈萃分析顯示阿托伐他汀藥物可明顯改善患者的腎小球濾過功能。
本研究說明,高血壓患者腎功能損害除了與血壓水平有關外,還與BMI、血Cr、血脂有關。因此,臨床工作中高血壓患者在降壓的同時,一定要兼顧血脂、血Cr、BMI的達標以實現預防腎臟靶器官損害的目的。最后需要指出的是,本研究樣本量較小,結果可能存在一定的偏倚,有待擴大樣本量繼續研究以提高結果的可靠性。
[1] 劉芬.新疆不同民族高血壓現況的流行病學調查[J].中華醫學雜志,2010,90(46):3259-3263.
[2] Ren M,Sun K,Li F,et al.Association between obesity measures and albuminuria:A population-based study[J].J Diabetes Complications,2016,30(3):451-456.
[3] 吳睿,王鋒,汪年松.肥胖相關腎病發病機制與臨床研究進展[J].中華腎病研究電子雜志,2016,5(1):38-41.
[4] Wuerzner G,Pruijm M,Maillard M,et al.Marked association between obesity and glomerular hyperfiltration:a cross-sectional study in an African population[J].Am J Kidney Dis,2010,56(2):303-312.
[5] Bolignano D,Zoccali C.Effects of weight loss on renal function in obese CKD patients:a systematic review[J].Nephrol Dial Transplant,2013,28(4):82-98.
[6] 王妍.高尿酸血癥與急性腎損傷的相關性Meta分析[J].寧夏醫學雜志,2016,38(3):215-217.
[7] Ohta Y,Tsuchihashi T,Kiyohara K,et al.Increased uric acid promotes decline of the renal function in hypertensive patients:a 10-year observational study[J].Intern Med,2013,52(13):1467-1472.
[8] 梁穗,李自成,李虹.利用腎小球濾過率評估高尿酸血癥對老年男性高血壓病患者腎功能的影響[J].廣東醫學,2014,(6):859-861.
[9] Wang H,Wei Y,Kong X,et al.Effects of urate-lowering therapy in hyperuricemia on slowing the progression of renal function:a meta-analysis[J].J Ren Nutr,2013,23(5):389-396.
[10] 馬儒林,郭淑霞,李妍,等.新疆哈薩克族成人血脂異常及其影響因素[J].中國公共衛生,2012,28(8):1009-1013.
[11] 周紅霞,梅柏如,趙麗萍.慢性腎臟疾病中的脂質代謝異常與腎損傷的關系[J].江蘇醫藥,2007,33(11):1179.
[12] Yamashita T,Makino H,Nakatani R,et al.Renal insufficiency without albuminuria is associated with peripheral artery atherosclerosis and lipid metabolism disorders in patients with type 2 diabetes[J].J Atheroscler Thromb,2013,20(11):790-797.
[13] David D.LDL-cholesterol lowering and renal outcomes[J].Curr Opin Lipidol,2015,26(3):195-199.
國家自然科學基金資助項目( 81460075)。
王忠(E-mail:wangzshz@163.com)
10.3969/j.issn.1002-266X.2017.01.014
R544.1;R692.9
B
1002-266X(2017)01-0044-03
2016-09-25)

