肉桂多酚對HepG2細胞脂質代謝的影響及其機制
鄭婧
(貴州醫科大學附屬醫院,貴陽550000)
肉桂多酚對HepG2細胞脂質代謝的影響及其機制
鄭婧
(貴州醫科大學附屬醫院,貴陽550000)
目的 觀察肉桂提取物肉桂多酚對HpeG2細胞脂質代謝的影響并探討其作用機制。方法 培養HepG2細胞,用不同濃度的肉桂多酚處理HpeG2細胞后,分別用油紅O染色觀察脂質沉積情況及甘油三酯(TG)試劑盒檢測TG水平變化;采用q-PCR方法檢測肉桂多酚處理HpeG2細胞后脂肪酸從頭合成相關基因表達水平;HepG2細胞轉染siRNA沉默SIRT1基因后,用Western blotting方法檢測下游通路蛋白腺苷酸活化蛋白激酶(AMPK)、乙酰輔酶A羧化酶(ACC) 水平以及從頭合成相關基因的表達。結果 肉桂多酚可有效降低HpeG2細胞內TG水平,下調脂肪酸從頭合成關鍵轉錄因子SREBP-1及其下游靶基因FAS、SCD1 mRNA表達(P均<0.05);SIRT1基因沉默后,下游通路蛋白AMPK、ACC及其磷酸化水平明顯降低,SREBP-1、FAS、SCD1 mRNA表達上調(P均<0.05)。結論 肉桂多酚可有效改善HepG2細胞內脂質代謝,該作用可能是通過SIRT1-AMPK-ACC通路抑制脂質從頭合成實現的。
非酒精性脂肪肝;肝臟脂質代謝;肉桂多酚;HepG2
非酒精性脂肪肝(NAFLD)是一種與胰島素抵抗(IR)和遺傳易感性密切相關的代謝性肝臟損傷[1,2]。根據著名的“二次打擊”學說[3],肝細胞內脂肪沉積是NAFLD發病的中心環節。近幾年來國內外藥理研究發現肉桂活性成分具有降糖、調脂、改善胰島素抵抗(IR)、擴血管以及抗血小板聚集等作用[4]。肉桂多酚是從肉桂皮提取的多酚類物質,具有改善人肝癌細胞系HepG2細胞IR和細胞內脂肪沉積的作用[5,6],其作用機制可能是通過特定的信號轉導通路影響了細胞內某些與脂代謝相關基因的表達。2015年3~7月,本研究通過采用不同濃度的肉桂多酚處理HepG2細胞,觀察處理前后細胞內甘油三酯(TG)以及脂質代謝相關基因表達的變化,旨在從分子水平探討肉桂提取物改善脂質沉積的生物學機制。
1 材料與方法
1.1 材料 HepG2細胞購自中國科學院細胞庫(上海)。肉桂購于廣州同仁堂大藥房,取100 g粉碎后,分別用50%丙酮、乙醚、不同濃度的乙醇對研磨后的肉桂粉末進行分離、純化,凍干后得肉桂多酚提取物約6 g。其他材料有:油酸(Sigma,USA)、棕櫚酸(Sigma,USA)、DMEM培養基(GIBCO,USA)、青鏈霉素(GIBCO,USA)、胎牛血清(GIBCO,USA)、油紅O(Sigma,USA)、Trizol(Invitrogen,USA)、Promega Go Taq?PCR Master Mix試劑盒(Promega,USA)、Promega GoScript逆轉錄試劑盒(Promega,USA)、TG試劑盒(Biovision,USA),β-tublin Antibody(CST,USA)、辣根過氧化物酶標記的兔抗小鼠IgG(弗德,中國)、SIRT1 Antibody(CST,USA)、p-AMPK Antibody (Thr172)(CST,USA) 、腺苷酸活化蛋白激酶(AMPK)AMPK Antibody、SIRT1 Antibody(CST,USA)、乙酰輔酶A羧化酶(ACC) Antibody(CST,USA)、 p-ACC Antibody (Ser79)(CST,USA) 。-80 ℃低溫冰箱(Thermo,USA),核酸/蛋白定量檢測儀(Eppendorf,German),PCR擴增儀(ABI,USA),熒光定量PCR儀7500 (ABI,USA),高速低溫離心機(Thermo,USA),電子天平(Mettler-Toledo,Switzerland)。
1.2 細胞培養及處理 HepG2細胞培養于DMEM低糖培養基(含10 %胎牛血清、1 %青霉素、1 %鏈霉素)中。置于37 ℃、5 %的CO2飽和濕度培養箱中培養,取對數生長期細胞用于實驗。將處于對數生長期的HepG2細胞以每孔1×106種于6孔板中。待細胞貼壁24 h,更換無FBS的DMEM培養基,加入游離脂肪酸(FFA)及不同濃度的肉桂多酚,作用24 h后,行相關檢測。
1.3 HepG2細胞內TG水平檢測 先小心輕緩倒去培養液,用PBS輕緩漂洗3次,加4 %多聚甲醛固定30 min,雙蒸水清洗殘留的多聚甲醛,油紅O工作液染色10 min左右后棄去,用75 %乙醇或60 %異丙醇漂洗,除去多余的染料,再用PBS洗3次,顯微鏡下觀察細胞內脂滴水平。在FFA 0.5 mmol/L作用HepG2細胞的基礎上,分別加入PBS、肉桂多酚1、10、100 μg/mL,作用24 h后,TG試劑盒定量檢測加入PBS及不同濃度肉桂多酚后HepG2細胞內TG水平。
1.4 HepG2細胞脂肪酸代謝相關因子mRNA表達檢測 分別將PBS(空白組)、FFA 0.5 mmol/L(FFA組) 及FFA 0.5 mmol/L +肉桂多酚10 μg/mL(FFA+肉桂組)作用細胞24 h后,用Trizol法提取各組HepG2細胞脂肪酸從頭合成相關基因SREBP-1、FAS、SCD1 mRNA,通過q-PCR技術進行檢測。使用PrimeScript@RT Enzyme Mix試劑盒將mRNA逆轉錄成cDNA,-80 ℃保存待用。使用Toyobo SYBR Green Real-Time PCR Master Mix試劑盒進行擴增,在ABI 7500 PCR儀上對基因進行熒光定量PCR檢測。 以β-actin為內參,采用相對定量的方法,得到Ct值(達到閾值的循環數)為原始數據,計算Ct值均值,應用相對定量法(△△Ct)進行分析,按照2-△△Ct法進行數據處理和作圖。
1.5 HepG2細胞的siRNA轉染 siRNA由上海吉瑪生物科技有限公司設計及合成。將HepG2細胞接種至6孔板,待細胞貼壁,生長密度30%~40 %時,將培養基換為轉染專用培養基Opti-MEM,按轉染試劑盒LipofectamineTM3000說明書提供方法進行轉染。轉染48 h后終止實驗。
1.6 轉染HepG2細胞AMPK、ACC通路蛋白及其磷酸化水平檢測 采用HepG2細胞轉染siRNA的方法沉默SIRT1基因,用Western blotting方法檢測其下游通路蛋白AMPK、ACC表達及磷酸化水平。將細胞按上述實驗分組給予干預后收集細胞,提取細胞內總蛋白質,用BCA法檢測蛋白質濃度并標化。β-tublin作為內參照蛋白。樣品加入等體積Loading Buffer于沸水中煮5 min變性。經上樣、電泳、轉膜等步驟后,5 %脫脂牛奶封閉過夜;分別加入相應一抗(1∶1 000)4 ℃孵育過夜,加入二抗 (1∶8 000)37 ℃孵育1 h,化學發光法顯色。將膠片進行拍照存檔,Photoshop整理去色,Image J軟件處理系統分析目標帶的光密度值。再用q-PCR方法檢測轉染HepG2細胞SREBP-1、FAS、SCD1 mRNA表達。
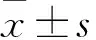
2 結果
2.1 不同濃度肉桂多酚對HepG2細胞內TG水平的影響 肉桂多酚可顯著減少細胞內脂質沉積,不同濃度肉桂多酚作用后HepG2細胞內TG水平有統計學差異(P均<0.05)。見圖1、圖2。

注:A.PBS;B.肉桂多酚1 μg/mL;C.肉桂多酚10 μg/mL;D.肉桂多酚100 μg/mL。
圖1 不同濃度肉桂多酚作用后HepG2細胞油紅O染色

圖2 不同濃度肉桂多酚作用后HepG2細胞內TG水平
2.2 肉桂多酚對HepG2細胞SREBP-1因子及其下游靶基因FAS、SCD1 mRNA表達的影響 FFA作用細胞后,與脂質從頭合成密切相關的轉錄因子SREBP-1及其下游靶基因FAS、SCD1mRNA表達顯著增多,而加用肉桂多酚后可以明顯抑制上述因子及靶基因的mRNA表達(P均<0.05)。見圖3。
2.3 SIRT1-AMPK-ACC通路在肉桂多酚對脂質從頭合成調節中的作用 抑制SIRT1后,下游通路蛋白AMPK、ACC及其磷酸化水平隨之受到明顯抑制,而脂質從頭合成的相關基因表達水平明顯升高(P均<0.05)。見圖4。
3 討論
目前,NAFLD尚缺乏效果顯著的治療手段,除了清淡飲食、運動、減重、治療原發病等基本措施外,還可加用藥物針對其發病機制進行干預。既往研究證實,肉桂提取物有降血糖、增強胰島素敏感性、降血脂、改善肝臟脂肪代謝等作用[5~8]。但是其改善肝臟脂肪代謝的具體機制目前并不十分明確。本研究顯示,肉桂多酚可以改善肝細胞內脂質的沉積,該 作用是通過SIRT1-AMPK-ACC通路抑制脂質從頭合成的關鍵轉錄因子SREBP-1及其下游靶基因FAS、SCD1的表達而實現的。

圖3 肉桂多酚對SREBP-1因子及其下游靶基因FAS、SCD1表達的影響

圖4 SIRT1-AMPK-ACC通路在肉桂多酚對脂質從頭合成調節中的作用
脂質從頭合成增多是機體在病理狀態下引起肝脂沉積的主要途徑,而體外實驗中從頭合成則是細胞內脂質的主要來源。我們用q-PCR的方法檢測脂肪酸從頭合成的關鍵轉錄因子SREBP-1以及其下游靶基因如FAS、SCD1的表達情況。結果表明,肉桂多酚有明顯抑制SREBP-1及其下游靶基因表達的作用,提示肉桂改善肝臟病變的作用可能是通過抑制脂質的從頭合成路徑而實現的。
SIRT1是sirtuin蛋白家族中的一員,它是一種NAD+依賴的去乙酰化酶,與糖脂代謝密切相關[9],由于其可以調控體內眾多與代謝相關的轉錄因子而成為關鍵的能量調節器[10,11]。越來越多的研究表明,SIRT1參與體內肝脂代謝的調節,在過表達SIRT1的肥胖小鼠肝臟脂肪變的程度明顯減輕[12]。AMP激活的AMPK是一種多亞基激酶,在調節細胞代謝中發揮重要作用,AMPK被活化后可以促進葡萄糖的攝取、脂肪酸的氧化,減少TG、膽固醇的生成,調節機體能量平衡,因此也被稱為“能量感受器”[13]。肝臟AMPK激活后,通過抑制ACC的活性降低丙二酰輔酶的濃度來促進脂肪酸氧化,抑制脂肪酸合成[14,15]。既往研究顯示多酚類化合物對HepG2細胞的降脂效應是通過提高AMPK的磷酸化水平及其下游靶基因ACC的表達、同時抑制FAS基因的表達實現的。若在基因水平上干擾或用藥物抑制SIRT1的表達可以削弱這種降脂效應,說明在多酚類調節肝脂通路中SIRT1是AMPK的上游分子[16]。本研究結果表明,肉桂多酚正是通過該通路調節脂肪酸的從頭合成,從而改善肝細胞內脂肪沉積的。
[1] De Alwis NM,Day CP.Non-alcoholic fatty liver disease:the mist gradually clears[J].J Hepatol,2008,48(1):104-112.
[2] Fan JG.Epidemiology of alcoholic and nonalcoholic fatty liver disease in China[J].J Gastroenterol Hepatol,2013,28(1):11-17.
[3] Day CP,James OF.Steatohepatitis:a tale of two "hits"[J].Gastroenterology,1998,114(4):842-845.
[4] 方琴.肉桂的研究進展[J].中藥新藥與臨床藥理,2007,18(3):249-252.
[5] Sartorius T,Peter A,Schulz N,et al.Cinnamon extract improves insulin sensitivity in the brain and lowers liver fat in mouse models of obesity[J].PLoS One,2014,9(3):e92358.
[6] 盧兆蓮,黃才國.肉桂多酚改善HepG2細胞胰島素抵抗作用研究[J].遼寧中醫藥大學學報,2013,15(2):42-44.
[7] Kim SH,Choung SY.Antihyperglycemic and antihyperlipidemic action of cinnamomi cassiae (Cinnamon bark) extract in C57BL/Ks db/db mice[J].Arch Pharm Res,2010,33(2):325-333.
[8] Mang B,Wolters M,Schmitt B,et al.Effects of a cinnamon extract on plasma glucose,HbA1c,and serum lipids in diabetes mellitus type 2[J].Eur J Clin Invest,2006,36(5):340-344.
[9] Li X.SIRT1 and energy metabolism[J].Acta Biochim Biophys Sin (Shanghai),2013,45(1):51-60.
[10] Kemper JK,Choi SE,Kim DH.Sirtuin 1 deacetylase:a key regulator of hepatic lipid metabolism[J].Vitam Horm,2013,91:385-404.
[11] Schug TT,Li X.Sirtuin 1 in lipid metabolism and obesity[J].Ann Med,2011,43(3):198-211.
[12] Li Y,Xu S,Giles A,et al.Hepatic overexpression of SIRT1 in mice attenuates endoplasmic reticulum stress and insulin resistance in the liver[J].FASEB J,2011,25(5):1664-1679.
[13] Canto C,Gerhart-Hines Z,Feige JN,et al.AMPK regulates energy expenditure by modulating NAD+ metabolism and SIRT1 activity[J].Nature,2009,458(7241):1056-1060.
[14] Cho K,Kim SJ,Park SH,et al.Protective effect of Codonopsis lanceolata root extract against alcoholic fatty liver in the rat[J].J Med Food,2009,12(6):1293-1301.
[15] Folmes CD,Lopaschuk GD.Role of malonyl-CoA in heart disease and the hypothalamic control of obesity[J].Cardiovasc Res,2007,73(2):278-287.
[16] Hou X,Xu S,Maitland-Toolan KA,et al.SIRT1 regulates hepatocyte lipid metabolism through activating AMP-activated protein kinase[J].J Biol Chem,2008,283(29):20015-20026.
10.3969/j.issn.1002-266X.2017.01.012
R575.5
A
1002-266X(2017)01-0038-03
2016-08-02)

