二芳基碘钅翁鹽參與的芳基化反應研究進展
江龍,嚴毅巖,謝媛媛
(浙江工業大學藥學院,浙江杭州310014)
醫藥化工
二芳基碘钅翁鹽參與的芳基化反應研究進展
江龍,嚴毅巖,謝媛媛*
(浙江工業大學藥學院,浙江杭州310014)
綜述了近年來二芳基碘钅翁鹽在有機合成中促進芳基化反應的最新進展,著重介紹了羰基化合物的芳基化反應、C-H芳基化反應、C-雜芳基化反應以及串聯環化反應。
二芳基碘钅翁鹽;芳基化;串聯環化
0 前言
二芳基碘钅翁鹽(Figure 1)作為有機高價碘試劑[1],因其易得、溫和、無毒且性質穩定,受到了科學工作者們的廣泛關注。它參與的許多反應,反應條件溫和、官能團耐受性好且區域選擇性好[2],是一種普適性的芳基化試劑[3-5]。二芳基碘钅翁鹽參與的芳基化反應既可以在金屬催化下進行,也可以在無金屬催化條件下進行。在常溫下,二芳基碘钅翁鹽大多是以固體形式存在,其熱穩定性比較好,與氧氣、水等也不發生反應;但是二芳基碘钅翁鹽對光比較敏感,在長期光照下容易分解,故應當避光保存[6]。

Figure 1
自從二芳基碘钅翁鹽首次被合成出來,后續發展出來的制備方法已有十多種[7-8],這也促進了二芳基碘钅翁鹽在有機合成中的應用。對于二芳基碘钅翁鹽,早期的研究主要集中在與各種親核試劑發生親電芳基化反應,近年來過渡金屬催化的交叉偶聯反應研究較多[9]。本文對二芳基碘钅翁鹽參與的芳基化反應最新研究進展進行綜述。
1 羰基α-位芳基化反應
早在1960年,就有報道[10]利用二芳基碘钅翁鹽對羰基α-位進行芳基化反應(Scheme 1),但反應的收率和選擇性都較差。Ryan JH等人[11]研究發現(Scheme 2),環己酮在強堿LDA的作用下發生烯醇化,然后在亞銅鹽的催化下生成單取代的α-芳基化合物,在體系中加入1 eq.的氰化亞銅,可使α-芳基化產物的收率從15%提高到50%。
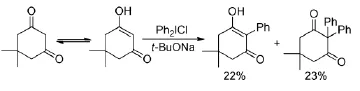
Scheme 1

Scheme 2
為研究7-芳基嗎啡喃類化合物對δ型阿片受體的選擇性,Gao P等人[12]在強堿LiHMDS的作用下通過二芳基碘钅翁鹽對嗎啡喃7-位進行芳基化(Scheme 3),合成了一系列7-芳基嗎啡喃類化合物,并研究了其構效關系[13]。該反應選擇性良好,7-位單取代的產物收率可達71%。
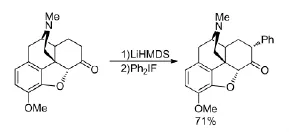
Scheme 3
2 金屬催化的交叉偶聯反應
由于碘苯是一個較好的離去基團,在反應中,二芳基碘钅翁鹽的活性要高于鹵代芳烴。二芳基碘钅翁鹽參與的交叉偶聯反應通常為氧化加成-還原消去的反應機理,但與鹵代芳烴參與的交叉偶聯反應相比,其反應條件更加溫和,產率更高。
2.1 二芳基碘钅翁鹽參與的芳烴芳基化
Phipps R J等人[14]報道了在二價銅的催化下,利用二芳基碘钅翁鹽合成聯苯類化合物的方法(Scheme 4)。該反應選擇性地實現了苯環間位的芳基化,并提出了可能的反應機理。研究者還發現,二價鈀催化該反應時,主要生成鄰位芳基化產物。
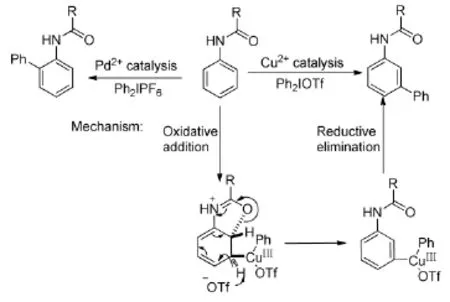
Scheme 4
反應的催化體系不同會影響這一類反應的選擇性,有研究發現導向基團也顯著影響這一類反應的選擇性[15](Scheme 5)。該反應條件溫和,產率較高,且通過導向基的不同選擇性地實現了吲哚2-位和3-位的芳基化。當導向基為乙酰基時,含有五元環的三價銅中間體更加穩定,隨后還原消去得到2-位芳基化的產物。
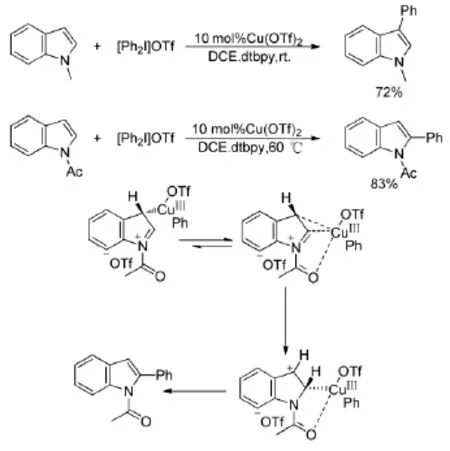
Scheme 5
2.2 二芳基碘钅翁鹽參與的Heck偶聯反應
Phipps R J等人[16]報道了在銅催化下,烯烴與二芳基碘钅翁鹽的類Heck偶聯反應(Scheme 6)。反應底物適用范圍廣,大部分底物以中等偏上的產率完成反應,反應可能經由碳正離子的反應機理。
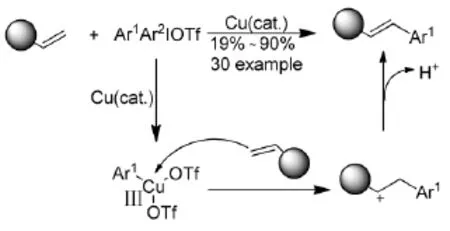
Scheme 6
此外還發現,反應產物與通過Heck反應得到的產物是有比較大的差別的,反應的選擇性取決于碳正離子的穩定性,因此有可能得到雙鍵移位的產物。最重要的一點就是,以此類反應為基礎還發展了許多新的串聯反應,將一些烯烴類化合物轉化成結構復雜、應用廣泛的芳基取代的化合物(Scheme 7)。這些實驗結果也初步驗證了他們在機理上提出的假設。
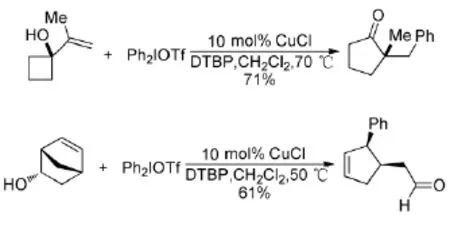
Scheme 7
二芳基碘钅翁鹽作為芳基源參與的過渡金屬催化芳烴化合物和烯烴化合物的芳基偶聯反應近年已經取得了很大的進展,因此化學家也對炔烴化合物陸續進行了嘗試。Suero Marcos G等人[17]報道了以乙烯基或二芳基碘钅翁鹽和炔烴為底物在氯化亞銅催化下的芳基化反應。一般炔烴類化合物的金屬催化偶聯反應的機理是三鍵首先被活化,而二芳基碘钅翁鹽參與反應的機理不同,它首先是活化高價碘化合物得到三價銅的中間體(即苯基正離子),然后三價銅中間體再進一步活化三鍵最終得到目標產物(Scheme 8)。值得注意的是,當使用非對稱的二芳基碘钅翁鹽時,相對缺電子的芳基部分優先轉移。
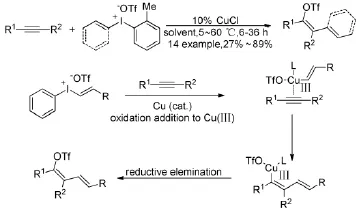
Scheme 8
2.3 二芳基碘钅翁鹽參與的sp3C-H芳基化反應
“非活化”的sp3C-H芳基化反應是有機合成中的一個巨大挑戰,現有的合成路線大多產率不高,且選擇性較差。Fei P等人[18]報道了在鈀催化下,利用二芳基碘钅翁鹽實現了8-氨基喹啉類化合物的sp3C-H芳基化(Scheme 9)。當具有位阻效應的非對稱二芳基碘钅翁鹽參與反應時,位阻小的芳基優先轉移。
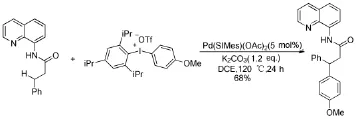
Scheme 9
3 無金屬催化的C-H芳基化反應
上述的C-H芳基化反應都需要金屬催化,最常使用的金屬催化劑就是Pd、Ru、Rh及Cu等過渡金屬。但是,使用金屬催劑也有一些缺點,比如價格昂貴,有一定毒性及形成過渡金屬雜質等。二芳基碘钅翁鹽因其自身缺電子性質和碘苯的易離去性,即使沒有過渡金屬催化,也能作為有效的芳基化試劑參與反應。
二芳基碘钅翁鹽不僅可以形成碳正離子與親核試劑發生反應,也可以在催化劑或其他條件下發生均裂產生苯基自由基從而進一步參與反應。Jun W等人[19]報道了一種新型簡單且無過渡金屬催化的C-H芳基化反應。芳烴或氮雜芳烴與二芳基碘钅翁鹽作用,僅僅在堿的作用下就實現了通常需要在金屬催化劑作用下才會發生的反應,而且還得到了較好的產率(Scheme 9)。隨后對反應機理進行了初步研究,加入自由基抑制劑TEMPO后,反應幾乎不進行;加入較弱的抑制劑1,1-二苯基乙烯,反應產率明顯下降,初步證明反應經歷的是自由基過程。
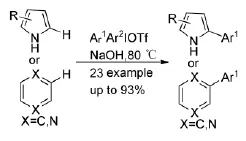
Scheme 9
Wang D等人[20]報道了萘醌或醌與二芳基碘钅翁鹽的反應,僅僅在堿的作用下就得到了芳基化的產物(Scheme 10),并通過自由基捕獲劑驗證了該反應的自由基機理。對于對稱的二芳基碘钅翁鹽,供電子基團取代的產率更高。在非對稱的二芳基碘钅翁鹽中,連有供電子的芳基優先轉移。
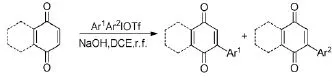
Scheme 10
Susana C[21]等人報道了萘的C-H芳基化反應(Scheme 11)。該反應無需過渡金屬催化或堿性條件,以普通萘類作為底物,在微波下就能實現。在體系中加入各種酸,也不能促進產物的生成。在自由基捕獲劑TEMPO存在下,反應不進行,因此,反應經歷的是自由基過程。該反應的選擇性良好,主要生成的是萘環α位芳基化的產物。
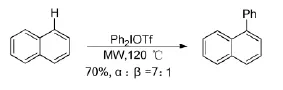
Scheme 11
4 雜原子親核試劑的芳基化反應
二芳基碘钅翁鹽在反應原位消除后釋放親電試劑Ar+以及中性的ArI,因此易與親核性強的胺類、醇酚類以及硫、氟等親核試劑發生親核取代反應。
二芳基碘钅翁鹽參與的反應不滿足原子經濟性的要求:只有其中一個芳基參與反應,另一個芳基生成芳基碘副產物。Modha SG等人[22]報道了吲哚類化合物C-Ar與N-Ar串聯芳基化偶聯的研究(Scheme 12)。該反應完全利用了二芳基碘钅翁鹽的兩個芳基,達到了最高的原子利用率。更有創新價值的是合成非對稱的苯基二甲基脲嘧啶碘钅翁鹽,在反應中芳基進行3位的偶聯,而雜環的二甲基脲嘧啶則實現了N芳基偶聯,雖然只有中等的產率,但是這卻是高原子經濟性的經典案例。
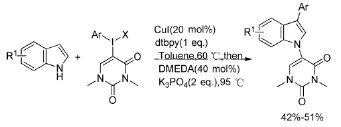
Scheme 12
Jalalian N等人[23]報道了氧親核試劑的芳基化反應。苯酚類化合物與二芳基碘钅翁鹽在堿的作用下,室溫下反應2 h或40℃反應,以很好的收率得到產物二芳基醚(Scheme 13)。反應不需要金屬催化劑,條件溫和,反應迅速,產率高。當苯酚鄰位有大位阻基團取代時,芳基化反應也能高效進行,這在金屬催化的交叉偶聯反應中是很難實現的。反應對鹵代的苯酚、含有易消旋氨基酸基團的酚類、雜環酚類都適用。
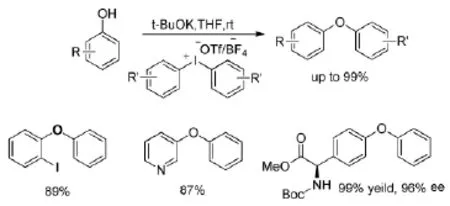
Scheme 13
Natalie U等人[24]以芳香亞磺酸鈉鹽為底物,與二芳基碘钅翁鹽偶聯生成二芳基砜(Scheme 14)。反應既不需要過渡金屬催化,也不需要加堿就能高產率地實現轉化。設計實驗研究了二芳基碘钅翁鹽地選擇性,發現反應在銅催化下和無金屬催化下表現出完全不同的區域選擇性。當非對稱的二芳基碘钅翁鹽的兩個芳基有位阻差異時,無金屬催化條件下大位阻的芳基部分優先轉移,而在碘化亞銅催化條件下則選擇性相反。
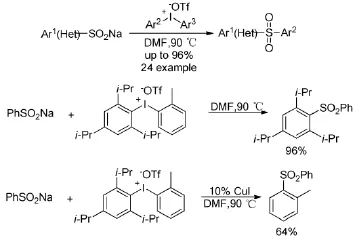
Scheme 14
非天然放射性18F獨特的性能是正極電子成像術(PET)理想的材料,二芳基碘钅翁鹽可以用來制備富電子18F代芳烴。CarrollM A等人[25]報道了Cs18F對二芳基碘钅翁鹽進行親核進攻從而生成放射性標記的化合物(Scheme 15),該方法的優點是通過改變反應底物二芳基碘钅翁鹽的種類可以得到不同的18F放射性標記的化合物。

Scheme 15
5 二芳基碘钅翁鹽參與的串聯環化反應
二芳基碘钅翁鹽的另一個重要應用就是它與其他反應底物發生環化反應,反應過程中生成的中間體(如自由基或正離子)自身發生關環或者與另一分子化合物進一步作用最終得到環化產物。比較常見的環化反應是二芳基碘钅翁鹽與腈、烯烴以及炔烴的環化反應。Li J等人[26]報道利用特殊的二芳基碘钅翁鹽(其中一個芳基為聯苯基)與腈類反應得到了菲啶化合物的骨架(Scheme 16)。該方法通過腈上N原子與二芳基碘钅翁鹽作用后,產生的中間體并沒有再與其他分子發生反應,而是與中間體自身的另一個苯環發生環化反應從而得到了菲啶的骨架。
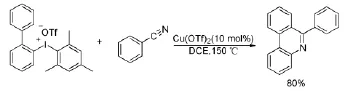
Scheme 16
Cahard E等人[27]報道了烯丙基酰胺與二芳基碘钅翁鹽的關環反應(Scheme 17)。二芳基碘钅翁鹽在銅催化下產生苯基正離子,隨后苯基正離子作為親電試劑與碳碳雙鍵反應,最后產生的碳正離子與羰基氧作用生產噁嗪類的六元雜環化合物。
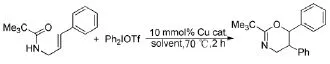
Scheme 17
在銅催化下,二芳基碘钅翁鹽也可以與脂肪族炔烴發生串聯環化反應。Jing P等人[28]報道了烷基炔烴的芳基化環化反應。通過炔基與惰性的sp3雜化的C-H鍵的C-C偶聯反應得到了環戊烯衍生物(Scheme 18)。該反應為用烷基炔烴構建碳環提供了一種新穎而簡便的方法。當上述反應底物中的sp3雜化碳的R取代基有一個是烷氧基時,反應的結果就發生了根本性的變化。Chen J[29]等人報道在銅催化作用下,烷氧基取代的炔烴化合物在二芳基碘钅翁鹽作用下形成乙烯正離子后,進一步的反應并不是與sp3雜化的C-H鍵發生反應,而是烷氧基的氧原子進攻碳正離子得到氧正離子,最后通過C-O鍵的斷裂最終完成整個反應過程生成五元或六元的環醚類化合物(Scheme19)。
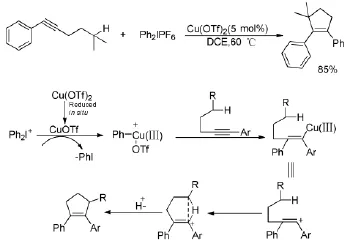
Scheme 18

Scheme 19
6 總結與展望
綜上所述,二芳基碘钅翁鹽因其易得、溫和、無毒且性質穩定,在有機合成中作為芳基化試劑得到廣泛應用。它參與的許多反應,反應條件溫和、官能團耐受性好且區域選擇性好。隨著越來越多的化學工作者對二芳基碘钅翁鹽參與的芳基化反應的研究,二芳基碘钅翁鹽參與的芳基化反應必定會在有機合成的發展中起到更為重要的作用。
[1]Zhdankin V V,Stang P J.Chemistry of polyvalent iodine [J].Chem.Rev.,2008,108(12):5299-5358.
[2]Merritt E A,Olofsson B.Diaryliodonium salts:A journey from obscurity to fame[J].Angew.Chem.,Int.Ed.,2010,41(7):9052-9070.
[3]Wen J,Zhang R Y,Chen SY,et al.Direct arylation of arene and n-heteroareneswith diaryliodonium saltswithout the use of transitionmetal catalyst[J].Cheminf.,2012,43(21):766-771.
[4]Phipps R,Mcmurray L,Ritter S,et al.Copper-catalyzed alkene arylation with diaryliodonium salts[J].J.Am.Chem. Soc.,2012,134(26):10773-10776.
[5]Chandan D,Erik L,Berit O.Metal-free C-arylation of nitro compounds with diaryliodonium salts[J].Org.Lett.,2015,17(18):4554-4557.
[6]李暉.二芳基碘钅翁鹽的合成與性質研究[D].天津:天津大學,2007.
[7]BielawskiM,Olofsson B.High-yielding one-pot synthesis of diaryliodonium triflates from arenes and iodine or aryl iodides[J].Chem.Commun.,2007,24(43):2521-2523.
[8]Ochiai M,Toyonari M,Nagaoka T,et al.Stereospecific synthesis of vinyl(phenyl)iodonium tetrafluoroborates via boron-iodane exchange of vinylboronic acids and esters with hypervalent phenyliodane[J].Tetrahedron Lett.,1997,38(38):6709-6712.
[9]Wen Q,Lu P,Wang Y.Recent advances in transitionmetal-catalyzed C.lb.CN bond activations[J].RSC Adv.,2014,4(88):47806-47826.
[10]Beringer FM.Diaryliodonium salts-XII:The phenylation of dimedone,dibenzoylmethane and tribenzoylmethane[J]. Tetrahedron,1960,8(1):49-63.
[11]Ryan JH,Stang P J.Directα-arylation of ketones:The reaction of cyclic ketone enolates with diphenyliodonium triflate[J].Tetrahedron Lett.,1997,38(28):5061-5064.
[12]Gao P,Portoghese PS.Monophenylation ofmorphinan-6-ones with diphenyliodonium iodide[J].J.Org.Chem.,1995,60(7):2276-2278.
[13]Gao P,Larson D L,Portoghese P S.Synthesis of 7-arylmorphinans.Probing the“address”requirements for selectivity at opioid delta receptors[J].J.Med.Chem.,1998,41(16):3091-3098.
[14]Phipps R J,Gaunt M J.A meta-selective coppercatalyzed C-H bond arylation[J].Science,2009,323(20): 1953-1957.
[15]Phipps R J,Grimster N P,Gaunt M J.Cu(II)-catalyzed direct and site-selective arylation of indoles under mild conditions[J].J.Am.Chem.Soc.,2008,130(26):8172-81744.
[16]Phipps R J,Mcmurray L,Ritter S,et al.Coppercatalyzed alkene arylation with diaryliodonium salts[J].J. Am.Chem.Soc.,2012,134(26):10773-10776.
[17]Suero Marcos G,Bayle Elliott D,Collins Beatrice S L,et al.Copper-catalyzed electrophilic carbofunctionalization of alkynes to highly functionalized tetrasubstituted alkenes[J]. J.Am.Chem.Soc.,2013,135(14):5332-5335.
[18]Fei P,Peng X S,Li SZ,et al.Directarylation of primary and secondary sp3C-H bonds with diarylhyperiodonium saltsviaPd catalysis[J].Org.Lett.,2013,15(18):4758-4761. [19]Jun W,Ruo Y Z,Shan Y C,et al.Direct arylation of arene and N-heteroarenes with diaryliodonium salts without the use of transitionmetal catalyst[J].J.Org.Chem.,2011,77(1):766-771.
[20]Wang D,Ge B,Li L,et al.Transition metal-free direct C-H functionalization of quinones and naphthoquinones with diaryliodonium salts:synthesis of aryl naphthoquinones asβ-secretase inhibitors[J].J.Org.Chem.,2014,79(18):8607-8613.
[21]Susana C,Fernández J J,Rubén V,et al.Base-and metal-free C-H direct arylations of naphthalene and other unbiased arenes with diaryliodonium salts[J].Chem. Commun.,2012,48(72):9089-9091.
[22]Modha SG,Greaney M F.Atom-economical transformation of diaryliodonium salts:tandem C-H and N-H arylation of indoles[J].J.Am.Chem.Soc.,2015,137:1416-1419.
[23]Jalalian N,Ishikawa EE,Silva L F,etal.Room temperature,metal-free synthesis of diaryl etherswith use of diaryliodonium salts[J].Org.Lett.,2011,13(6):1552-1555.
[24]Natalie U,Georg M.Metal-free synthesis of diaryl sulfones from arylsulfinic acid salts and diaryliodonium salts [J].Org.Lett.,2013,15(1):188-191.
[25]Carroll M A,Nairne J,Smith G,et al.Radical scavengers:a practical solution to the reproducibility issue in the fluoridation of diaryliodonium salts[J].J.Fluorine. Chem.,2007,38(20):127-132.
[26]Li J,Wang H,Sun J,et al.Synthesis of phenanthridine derivatives via cascade annulation of diaryliodonium salts and nitriles[J].Org.Biomol.Chem.,2015,46(12):7904-7908.
[27]Cahard E,Bremeyer N,Gaunt M J.Copper-catalyzed intramolecular electrophilic carbofunctionalization of allylic amides[J].Angew.Chem.,Int.Ed.,2013,52(35):9284-9288.
[28]Jing P,Chao C,Junjie C,et al.Cu-catalyzed arylcarbocyclization of alkyneswith diaryliodonium salts through CC bond formation on inert C(sp3)-H bond[J].Org.Lett.,2015,46(2):3776-3779.
[29]Chen J,Chen C,Chen J J,et al.Cu-catalyzed intramolecular aryl-etherification reactions of alkoxyl alkynes with diaryliodonium salts via cleavage of a stable C-O bond[J].Chem.Commun.,2015,51(7):1356-1359.
Progresses of Diaryliodonium Salts in Arylation Reactions
JIANG Long,YAN Yi-yan,XIE Yuan-yuan*
(College of Pharmaceutical Sciences,Zhejiang University of Technology,Hangzhou,Zhejiang 310014,China)
This review presents the arylation reaction by diaryliodonium salts,especially recent progresses in arylation of carbonyl compounds,arylation of C-H bond,arylation of hetero-atom nucleophiles,aswell as cascade reaction.
diaryliodonium salts;arylation;cascade reaction
1006-4184(2017)1-0001-06
2016-04-23
江龍(1988-),男,漢族,安徽安慶人,碩士研究生,研究方向:藥物中間體合成。
*通訊作者:謝媛媛,E-mail:xyycz@zjut.edu.cn。

