異鼠李素(Isorhamnetin)在肺癌中的研究進展
阮玉姝 曾凡軍 萬曉蓉
?
異鼠李素(Isorhamnetin)在肺癌中的研究進展
阮玉姝 曾凡軍 萬曉蓉
異鼠李素,又稱為3,5,7-三羥基-2-(4-羥基-3-甲氧基苯基)苯并吡喃-4-酮,屬于黃酮類物質的一種,主要來源是胡頹子科植物沙棘(Hippophae fhamnoides L)的果實,是源于銀杏的黃酮類的糖苷配基,也是槲皮素的直接代謝產物[1]。黃酮類是一組富含于種子,柑橘類水果,蔬菜,橄欖油,茶,紅酒等的化合物。許多的黃酮類物質已經用于癌癥的治療中[2],黃酮類物質的抗腫瘤特性和功效被越來越多的人肯定和研究。槲皮素是一種植物源的生物類黃酮,在體內和體外表現出抗炎癥,抗氧化,抗癌功效等生物學功能[3]。最新研究發現:槲皮素的中間代謝產物異鼠李素在結腸癌細胞中表現出更強的抗腫瘤功效,相對于槲皮素來說[4]。異鼠李素抗腫瘤的效果在很多不同類型的癌癥中都有研究,包括結腸直腸癌,皮膚癌,胃癌等[5-7]。據我們所知,異鼠李素在肺癌中還沒有被研究。因此,越來越多的研究開始關注異鼠李素在肺癌中的功效及相關作用機制。異鼠李素的結構示意圖(見圖1)。
在世界范圍內,肺癌是跟癌癥相關的死亡中最主要的原因,肺癌一般可劃分為小細胞癌和非小細胞癌兩種,其中非小細胞癌占所有肺癌的85%左右[8]。非小細胞肺癌又可以分為鱗癌,腺癌及大細胞癌,其中鱗癌占主導地位,按解剖學部位又可以分為中央型肺癌和周圍型肺癌。截止目前,盡管肺癌有多種治療手段,包括化學療法,放射療法以及手術切除等,但是非小細胞肺癌僅有5年存活的小于20%[9]。因此,去研發治療非小細胞肺癌的新型有效的藥劑和方法是非常迫切的!
異鼠李素的功效
近年來,越來越多的自然產物廣泛用于預防癌癥的發生和發展中,其中源于植物的抗腫瘤藥物被高度重視。植物來源的化合物不僅對發現新藥有巨大潛力,還可為設計更理想的新藥提供獨特的更加新型的化學結構,后者更可以被用來創造新藥的化合物[10]。最新的相關研究表明:一些從可食用的物質中分離出的活性物質,在動物體內和體外都表現出抗炎癥的功效。舉例來說,番茄紅素能抑制RAW 264.7細胞對脂多糖的炎癥反應,其機制是:通過抑制ERK/p38 MAP激酶和NF-KB途徑[11-12]。異鼠李素,一般能用于活血化瘀、止咳祛痰、消食化滯。銀杏提取物春蓼屬的東亞唐松草H,這種草本植物在傳統醫學中用于治療風濕,出血和癌癥[6-7],而異鼠李素是這種草藥植物的活性成分,表現出:抑制幾種不同種類的癌癥,包括胃癌,血癌,食道癌,皮膚癌。最新的研究發現:異鼠李素通過調節AKT和MEK信號通路,在乳腺癌中也有抗腫瘤的效果[13]。
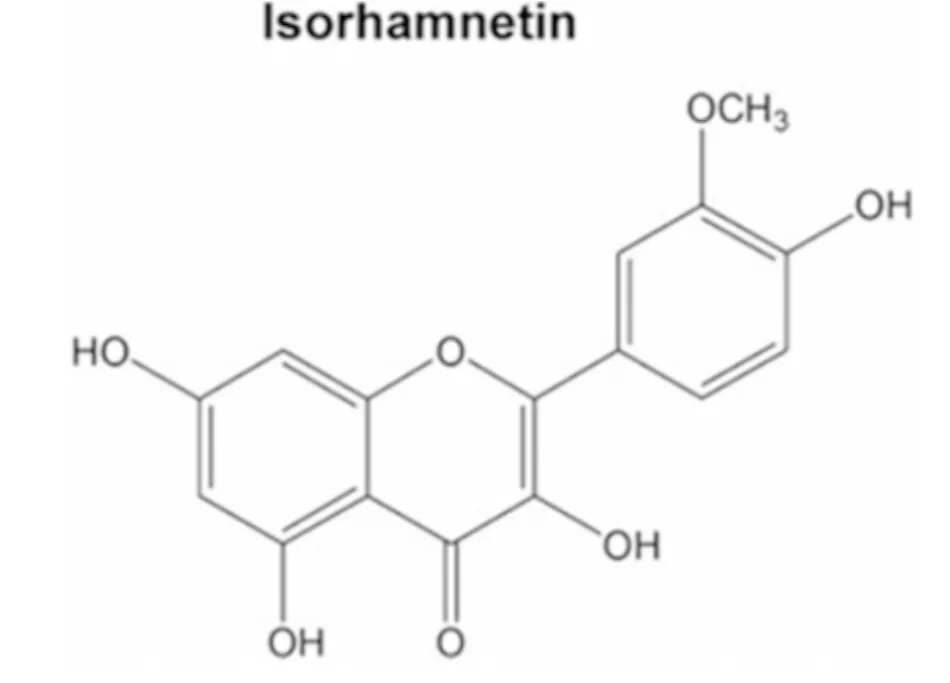
圖1 from Inhibitory Effects of Isorhamnetin on the Invasion of Human Breast Carcinoma Cells by Downregulating the Expression and Activity of Matrix Metalloproteinase-2/9
早期的研究表明:異鼠李素有抑制炎癥反應的功效在多種不同的模型中,例如,炎癥性腸病模型及爪腫脹模型等。能誘導這些模型的分子機理是:通過抑制NF-KB激活的不同發病機理。同時發現:異鼠李素通過MAPK 和 NF-KB 的信號通路對LPS誘發的急性肺損傷起保護性的作用[14-15]。
這幾年對異鼠李素的研究越來越廣泛和深入,發現其有較好的抗心肌等的缺血,缺氧,緩解心絞痛,抗心律失常,抗氧自由基,降低血清膽固醇等多種心血管效應。隨著自然科學的發展,眾多研究發現:異鼠李素在多種不同種類的腫瘤都有很好的抑制效果。在許多癌癥中的抗炎和抑制生長的特性已經被關注,包括皮膚,胃癌等,更有甚者異鼠李素在結腸癌中起的化學保護的作用,其相關的具體分子機制有待于進一步的探究。同時異鼠李亭下調一些參與炎癥反應的關鍵因子,如,COX2, PGE2, TNF-α 和NF-κB[16-17]。在心血管疾病中異鼠李素也有預防和治療效果。異鼠李素能保護源于低氧對上皮細胞的損傷,降低血壓以及缺血對心室肌細胞的損傷,保護人角質細胞免受紫外線的損傷,在體內和體外保護阿霉素誘導的心臟中毒同時,H2O2引起的H9c2心肌細胞的氧損傷也能被異鼠李素所阻止。尤其,異鼠李素在腫瘤中的功效備受重視,發現異鼠李素在許多腫瘤細胞系中是一個自然強有力的抗癌藥物[18-20]。
異鼠李素在肺癌中的作用及相關的分子機制
抗腫瘤藥物的生物機制包括抑制增殖,阻斷細胞生長的周期,增強細胞凋亡以及調節信號傳導通路[21]。異鼠李素是從黃酮類物質中分離出來的一種自然單體,有研究發現:異鼠李素能抑制肺癌細胞的增殖活性,在體內有抗腫瘤的效果。在體外用異鼠李素處理肺癌細胞,發現凋亡相關基因Bcl-2 和 PCNA的表達明顯下調,但Bax 和caspase-3的表達增加,因而導致Bcl-2/Bax的比例改變,P53的表達水平有少量減少,綜上所述:異鼠李素抗癌的作用是通過細胞凋亡誘導的,其中可能改變了凋亡相關基因的表達,如下調Bcl-2的表達及通過調節Bcl-2家族成員蛋白來改變Bcl-2/Bax的比例,同時發現異鼠李素誘導的凋亡是依賴于線粒體的[22]。這些結果說明:異鼠李素通過誘導依賴于線粒體的細胞凋亡具有抗癌的功效,但更詳細的分子機制有待于進一步研究[23]。
異鼠李素聯合順氯氨鉑和順羧酸鉑在肺癌中的研究
隨著治療非小細胞肺癌新型抗腫瘤藥物的不斷發現,提高肺癌治療和預后的療效是非常必要的,為此,人們開始考慮異鼠李素聯合其他藥物一起用于腫瘤的治療,相關研究發現:異鼠李素聯合順氯氨鉑及順羧酸鉑處理A549細胞,觀察到會顯著抑制細胞的增殖和生長活性[24]。近年來,許多植物化學物質被報導通過干擾細胞周期來抑制癌細胞的生長[21-25]。逃逸細胞周期停滯是腫瘤發展中普遍觀察到的現象,細胞周期由很多個檢驗點組成,扮演著一個監督機制。在細胞脅迫或DNA損傷時,這些機制也誘導細胞經歷細胞周期的停滯,激活修復系統或者誘導細胞凋亡。檢驗點G1/S 和G2/M的轉變是細胞周期中主要的調節開關[26-27]。用異鼠李素或異鼠李素聯合順氯氨鉑及順羧酸鉑處理,G2/M期的細胞數在總細胞中的比例大大增加,因此可以說,這些混合物誘導細胞有絲分裂障礙,引起細胞周期中G2/M期的停滯。在癌細胞中誘導凋亡也是通過很多各種各樣的自然植物化學物質抑制癌細胞的生長的一個強有力的機制,用異鼠李素和順氯氨鉑及順羧酸鉑聯合處理相對于對照來說,能很明顯的誘導細胞發生凋亡,表現為:質膜出泡,染色質皺縮等細胞凋亡的典型特點。
高侵略性腫瘤的特點是到正常組織的遷移能力增強,在轉移瘤中侵略性的癌細胞進入周圍組織和血管是初始步驟,這包括癌細胞趨化性的遷移,這個過程被細胞膜和細胞質來監管。抑制癌細胞的遷移在防止癌癥轉移中是一個極為有效的方法。通過限制初級腫瘤容易管理的形狀,使手術切除有更大的可行性。在轉移的初期,癌細胞滲透到周圍組織和血管,并且是一個有效的限制步驟,因此,抑制細胞遷移是一個非常有前景的治療方法在腫瘤轉移的治療中[28]。用異鼠李素聯合順氯氨鉑及順羧酸鉑處理肺癌細胞,發現:用異鼠李素聯合順氯氨鉑及順羧酸鉑處理相對于各自單獨處理來說在肺癌細胞的遷移中有更好的抑制效果。綜上所述,異鼠李素聯合順氯氨鉑及順羧酸鉑處理肺癌細胞能顯著減弱細胞的生長活性,誘導細胞周期停滯在G2/M期,抑制癌細胞遷移以及誘導有線粒體和半胱天冬酶參與的細胞凋亡,異鼠李素和它的聯合物各自誘導細胞早期和晚期的凋亡。用異鼠李素,順氯氨鉑,順羧酸鉑及它們的聯合物誘導肺癌細胞的凋亡,表現為誘導caspase 3 和 9,也會使線粒體的膜電位喪失,總的來說,異鼠李素及它和順氯氨鉑,順羧酸鉑的聯合物有很強的抗癌活性,是一個非常有潛力的肺癌化學治療藥物[29]。
[1] Park JC, Young HS, Yu YB, et al. Isorhamnetin sulphate fromthe leaves and stems of Oenanthe javanica in Korea[J]. Planta Med,1995,61(4):377-378.
[2] Asano N, Kuno T, Hirose Y, et al.Preventive effects of a flavonoid myricitrin on the formation of azoxymethane-induced prema -lignant lesions in colons of rats[J]. Asian Pac J Cancer Prev,2007,8(1):73-76.
[3] Khacha-ananda S, Tragoolpua K, Chantawannakul P, et al.Antioxidant and anti-cancer cell proliferation activity of propolis extracts from two extraction methods[J]. Asian Pac J Cancer Prev,2013,14(11):6991-6995.
[4] Manu KA, Shanmugam MK, Ramachandran L, et al.Isorhamnetin augments the anti-tumor effect of capeciatbine through the negative regulation of NF-κB signaling cascade in gastric cancer[J]. Cancer Lett,2015,363(1):28-36.
[5] Saud SM, Young MR, Jones-Hall YL, et al.Chemopreventive activity of plant flavonoid isorhamnetin in colorectal cancer is mediated by oncogenic Src and β-catenin[J]. Cancer Res,2013,73(17):5473-5484.
[6] Li C, Yang X, Chen C, et al. Isorhamnetin suppresses colon cancer cell growth through the PI3K?Akt?mTOR pathway[J]. Mol Med Rep,2014,9(3):935-940.
[7] Ramachandran L, Manu KA, Shanmugam MK, et al.Isorhamnetin inhibits proliferation and invasion and induces apoptosis through the modulation of peroxisome prolif ? erator?activated receptor gamma activation pathway in gastric cancer[J]. J Biol Chem,2012,287(45):38028-38040.
[8] Molina JR, Yang P, Cassivi SD, et al.Nonsmall cell lung cancer: Epidemiology, risk factors, treatment,and survivorship[J]. Mayo Clin Proc,2008,83(5):584-594.
[9] Tada H, Tsuchiya R, Ichinose Y, et al. A randomized trial comparing adjuvant chemotherapy versus surgery alone for completely resected pN2 nonsmall cell lung cancer (JCOG9304)[J]. Lung Cancer,2004,43(2):167-173.
[10] Kim JE, Lee DE, Lee KW, et al.Isorhamnetin suppresses skin cancer through direct inhibition of MEK1 and PI3-K[J]. Cancer Prev Res,2011,4(4):582-591.
[11] Lee W, Ku SK, Bae JW, et al. Inhibitory effects of lycopene on HMGB1-mediated pro-inflammatory responses in both cellular and animal models[J]. Food Chem Toxicol,2012,50(6):18262-1833.
[12] Feng D, Ling WH, Duan RD. Lycopene suppresses LPS-induced NO and IL-6 production by inhibiting the activation of ERK, p38MAPK, and NF-κB in macrophages[J]. Inflam Res,2010,59(2):1152-121.
[13] Hu S, Huang L, Meng L, et al. Isorhamnetin inhibits cell proliferation and induces apoptosis in breast cancer via Akt and mitogen?activated protein kinase kinase signaling pathways[J]. Mol Med Rep,2015,12(5): 6745-6751.
[14] Yang JH, Kim SC, Shin BY, et al. O-Methylated flavonolisorhamnetin prevents acute inflammation through blocking of NF-κB activation[J]. Food Chem Toxicol,2013,59:362-372.
[15] Dou W, Zhang J, Li H, et al. Plant lavonol isorhamnetin attenuates chemically induced inflammatory bowel disease via a PXRdependent pathway[J]. J Nutr Biochem,2014,25(9):923-933.
[16] Zhao G, Duan J, Xie Y, et al.Effects of solid dispersion and self-emulsifying formulations on the solubility, dissolution, permeability and pharmacokinetics of isorhamnetin, quercetin and kaempferol in total flavones of Hippophae rhamnoides L[J]. Drug Dev Ind Pharm,2013,39(7):1037-1045.
[17] Panda VS, Naik SR.Evaluation of cardioprotective activity of Ginkgo biloba and Ocimum sanctum in rodents[J]. Altern Med Rev,2009,14(2):161-171.
[18] Bao M, Lou Y.Isorhamnetin prevent endothelial cell injuries from oxidized LDL via activation of p38MAPK[J]. Eur J Pharmacol,2006,547(1-3):22-30.
[19] Ibarra M, Moreno L, Vera R, et al. Effects of the flavonoid quercetin and its methylated metabolite isorhamnetin in isolated arteries from spontaneously hypertensive rats[J]. Planta Med,2003,69(11):995-1000.
[20] Zhang N, Pei F, Wei H, et al.Isorhamnetin protects rat ventricular myocytes from ischemia and reperfusion injury[J]. Exp Toxicol Pathol,2011,63(1-2):33-38.
[21] Chen C, Kong AN. Dietary cancer-chemopreventive compounds: from signaling and gene expression to pharmacological effects[J]. Trends Pharmacol Sci,2005,26(6):318-326.
[22] Li Q, Ren FQ, Yang CL, et al.Anti-proliferation effects of isorhamnetin on lung cancer cells in vitro and in vivo[J]. APJCP,2015,16(7):3035-3042.
[23] Zhu L, Wang ZR, Zhou LM, et al. Effects and mechanisms of Isorhamnetin on lung carcinoma[J]. Space Med Med Eng,2005,18(2):381-383.
[24] Zhang BY, Wang YM, Gong H, et al. Isorhamnetin flavonoid synergistically enhances the anticancer activity and apoptosis induction by cis-platin and carboplatin in non-small cell lung carcinoma (NSCLC)[J]. Int J Clin Exp Pathol,2015,8(1):25-37.
[25] Aggarwal BB, Takada Y, Oommen OV. From chemoprevention to chemotherapy: common targets and common goals[J]. Expert Opin Investig Drugs,2004,13(10):1327-1338.
[26] Hartwell LH,Kastan MB.Cell cycle control and cancer[J]. Science,1994,266(5192):1821-1828.
[27] Kastan MB, Bartek J. Cell-cycle checkpoints and cancer[J]. Nature,2004,432(7015):316-323.
[28] Maggioni D, Nicolini G, Rigolio R, et al. Myricetin and naringenin inhibit human squamous cell carcinoma proliferation and migration in vitro[J]. Nutr Cancer,2014,66(7):1257-1267.
[29] Peng C, Zhou K, An S,et al. The effect of CCL19/CCR7 on the proliferation and migration of cell in prostate cancer[J]. Tumour Biol,2015,36(1):329-335.
10.3969/j.issn.1009-6663.2017.03.047
443003 湖北 宜昌,三峽大學第一臨床醫學院.宜昌市中心人民醫院呼吸內科
曾凡軍,Email:ruanyumei2003@163.com
2016-07-27]

