CAV1在人肺動脈成纖維細胞增殖調控中的作用
王昌國 曾大雄 雷偉 黃建安
?
CAV1在人肺動脈成纖維細胞增殖調控中的作用
王昌國 曾大雄 雷偉 黃建安
目的 研究小窩蛋白1(CAV1)在缺氧相關肺動脈成纖維細胞(PAFs)增殖調控中的作用。方法 將體外培養的人PAFs分為:對照組(C:21%O2);10%氧濃度組(10%O2);5%氧濃度組(5%O2)及2%氧濃度組(2%O2)進行細胞增殖實驗,選取細胞增殖最明顯組為缺氧組(H)進行后續實驗。并構建CAV1高表達質粒(pCAV1),然后再將PAFs分為對照組(C:21%O2),缺氧組(H),空白對照組(NC:缺氧+空質粒轉染組)和CAV1高表達組(pCAV1:缺氧+ pCAV1轉染組),采用Western-blot法檢測各組細胞中CAV1、細胞周期蛋白D1(cyclinD1)和細胞凋亡抑制蛋白2(c-IAP2)含量,四甲基偶氮唑藍(MTT)及增殖細胞核抗原(PCNA)免疫組化法檢測細胞增殖情況。結果 缺氧能刺激PAFs增殖,并呈濃度依賴性,于2%氧濃度刺激48小時PAFs增殖達峰值,與對照組相比差異有統計學意義(1.20+0.02vs0.54+0.04,P<0.01);缺氧組PAFs中CAV1表達下調(1.23±0.04vs0.90±0.02,P<0.01),cyclinD1 (0.19±0.03vs1.15±0.06,P<0.01)和c-IAP2(0.63±0.04vs0.78±0.09,P<0.01) 表達上調,細胞增殖增加(MTT:0.78±0.04vs1.20±0.02,P<0.01;PCNA:0.29±0.03vs0.54±0.03,P<0.01);CAV1在PAFs中高表達后(0.55±0.03vs0.90±0.03,P<0.01),cyclinD1 (0.88±0.02vs0.52±0.02,P<0.01)和c-IAP2 (0.87±0.02vs0.72±0.02,P<0.01) 表達下調,PAFs增殖減少(MTT:1.20±0.02vs1.00±0.06,P<0.01;PCNA:0.52±0.03vs0.38±0.03,P<0.01)。結論 缺氧能通過下調CAV-1在PAFs中的表達,促進PAFs的增殖、抑制其凋亡。cyclinD1和c-IAP2可能是CAV1調控PAFs增殖和凋亡的下游靶點。
缺氧;PAH;小窩蛋白1;肺動脈成纖維細胞
缺氧性肺動脈高壓(hypoxic pulmonary hypertension, HPH)是臨床常見疾病,可導致右心功能衰竭甚至死亡,目前尚缺乏有效治療手段。肺動脈重構是HPH的特征性改變,也是造成HPH不可逆的主要病理基礎。肺動脈重構過程中多種細胞組分參與其中,包括肺動脈內膜內皮細胞、中膜平滑肌細胞以及外膜成纖維細胞等均在細胞增殖、凋亡、分化、基質產生、細胞因子分泌等方面發生明顯變化。這些變化導致肺動脈內膜纖維性增厚、中膜增殖肥厚、外膜膠原沉積和纖維組織增多等多種解剖性改變[1-2]。但至今為止,HPH的相關研究主要集中在肺動脈內膜內皮細胞和中膜平滑肌細胞的功能變化方面,而對肺動脈外膜的相關研究甚少[3]。小窩蛋白-1(caveolin1, CAV1)為小窩表面標記蛋白, CAV1可綁定多種信號分子如 Src 家族酪氨酸激酶,G 蛋白,生長因子受體,G蛋白偶聯受體和內皮一氧化氮合酶等而產生一系列生物學效應,參與細胞增殖、凋亡、分化、血管生成以及腫瘤發生、發展等過程[4]。近年來研究發現,CAV1在特發性HPH的形成中發揮保護性作用,機制主要與CAV1調控肺動脈內皮細胞功能、平滑肌細胞功能、氧化應激、NO合酶等途徑有關[5-7]。但CAV1在低氧性HPH中的作用研究甚少,且存在爭議。根據上述研究結果,我們提出如下假設:在HPH形成過程中CAV1能通過調控肺動脈成纖維細胞(pulmonary artery fibroblasts, PAFs)的增殖參與肺動脈外膜的重構。為驗證假說,我們分別在缺氧及CAV1高表達質粒轉染情況下檢測PAFs的增殖以及CAV1、細胞周期蛋白D1(cyclinD1)和細胞凋亡抑制蛋白(cellular inhibitor of apoptosis protein, c-IAP2)在PAFs中的表達,分析兩者之間的關系,初步探討CAV1參與細胞增殖的可能機制,以期為HPH的治療提供新的潛在靶點。
資料與方法
一、主要材料
人PAFs購自上海生科院細胞庫;胰酶、RIPA裂解液、BCA蛋白濃度測定試劑盒均購自上海碧云天生物技術有限公司;胎牛血清購自美國Gibco公司;DAB顯色試劑盒購自北京中杉金橋生物技術有限公司;增殖細胞核抗原(proliferation cell nuclear antigen, PCNA)、CAV1、cyclinD1、c-IAP2抗體均購自美國Santa Cruz公司;PAFs培養基購自美國Sciencell公司;CAV1高表達質粒由上海生工生物工程有限公司合成。
二、細胞培養及實驗分組
將生長狀態良好的3-10代人PAFs置于含10%胎牛血清的成纖維細胞培養基中,于37℃、5%CO2細胞培養箱中培養,3-4天傳代一次,每次細胞處理前進行細胞周期同步化,然后進行后續處理。分組設計:首先將人PAFs分為:對照組(C:21%O2);10%氧濃度組(10%O2);5%氧濃度組(5%O2)及2%氧濃度組(2%O2)進行細胞增殖實驗,選取細胞增殖最明顯組為缺氧組(H),然后再將PAFs分為對照組(C:21%O2),缺氧組(H),空白對照組(NC:缺氧+空質粒轉染組)和CAV1高表達組(pCAV1:缺氧+ pCAV1轉染組)進行后續實驗。
三、細胞轉染
細胞轉染選用試劑脂質體2000,將PAFs接種至培養板進行培養,待細胞生長至70%左右時更換成纖維細胞培養基(無血清、無雙抗),待轉染。按照試劑盒說明書,將重組pCAV1質粒與脂質體2000混合后加入PAFs中,培養6 h后更換培養基,后續細胞同步化及分組處理同前述。
四、細胞增殖檢測(四甲基偶氮唑藍,MTT法)
將PAFs接種于96孔板,進行細胞培養及細胞周期同步化。然后按上述實驗分組處理后,在每孔中加入MTT孵育4 h棄去培養液,加入二甲基亞砜(DMSO),并于酶標儀上讀吸光度值(OD值)。每組增殖實驗重復3次。
五、細胞增殖檢測(PCNA免疫組化法)
將PAFs接種于預置玻片的24孔板中進行培養及細胞周期同步化,然后按上述實驗分組處理后制成細胞爬片進行免疫組化。以鼠PCNA多克隆抗體為一抗(1 ∶200倍稀釋),采用SP法,按照試劑盒說明操作,DAB顯色液顯色。細胞核呈現棕黃色為PCNA陽性表達。用PCNA陽性細胞比例反應細胞增殖。每組實驗重復3次。
六、Western-Blot檢測
Western-Blot法檢測目的蛋白的表達量。將PAFs細胞按上述分組處理后,收集細胞,按照蛋白提取試劑盒說明提取PAFs蛋白。用Bradford 法測定各樣品的總蛋白濃度。取各蛋白樣品30ug上樣,進行電泳、轉膜。分別以山羊抗CAV1單克隆抗體(1 ∶200倍稀釋),兔抗cyclinD1多克隆抗體(1 ∶500倍稀釋),兔抗c-IAP2多克隆抗體(1 ∶500倍稀釋)為一抗,以加入辣根過氧化物酶標記的兔抗羊或羊抗兔IgG為二抗(1 ∶5000倍稀釋),孵育后按照ECL試劑盒的說明書步驟,加入化學發光底物ECL,于暗室內進行膠片的曝光、顯影、定影。采用Quantity One 1.0 軟件對各個條帶的灰度值進行分析,以目的基因/相應的內參β-actin條帶的灰度值來表示該目的基因的相對表達量。每組實驗重復3次。
七、數據處理
SPSS16軟件計算各組數據的均數和標準差,結果以±s表示,t檢驗法進行統計學分析,P<0.05說明差異有統計學意義。
結 果
一、缺氧對PAFs增殖的影響
隨著氧濃度的下降及缺氧刺激時間的延長,PAFs增殖逐步增加,PAFs增殖峰值出現在2%氧濃度刺激48小時,與對照組相比差異有統計學意義(1.20+0.02vs0.54+0.04,P<0.01),(見圖1)。

圖1 缺氧對PAFs增殖的影響
A:不同氧濃度及缺氧暴露時間下PAFs的增殖情況;B:常氧情況下PAFs生長情況;C:低氧條件下PAFs生長情況;*表示與對照組相比差異有統計學意義P<0.01
二、缺氧對PAFs中CAV1、cyclinD1、c-IAP2表達及細胞增殖的影響
根據細胞增殖實驗結果,選取2%氧濃度組為缺氧組,細胞培養48小時后,分別檢測缺氧組及常氧組PAFs中CAV1、cyclinD1及c-IAP2的表達,結果:缺氧組PAFs中CAV1表達下調(1.23±0.04vs0.90±0.02,P<0.01),cyclinD1 (0.19±0.03vs1.15±0.06,P<0.01)和c-IAP2(0.63±0.04vs0.78±0.09,P<0.01) 表達上調,細胞增殖增加(MTT:0.78±0.04vs1.20±0.02,P<0.01;PCNA:0.29±0.03vs0.54±0.03,P<0.01),(見圖2)。
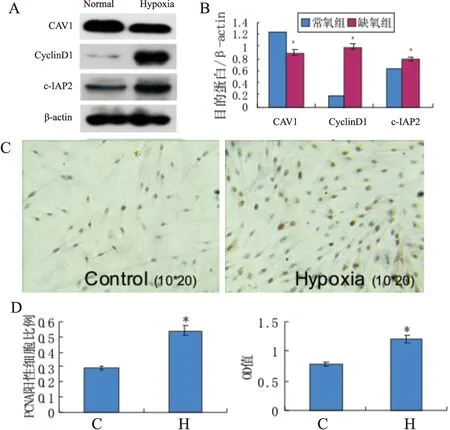
圖2 缺氧對PAFs中CAV1、CyclinD1、c-IAP2及細胞增殖的影響
A、B:對照組與缺氧組PAFs中CAV1、CyclinD1、c-IAP2的蛋白表達量;C:對照組及缺氧組PAFs的PCN免疫組化陽性表達情況;D、E:PCNA免疫組化法、MTT法檢測對照組及缺氧組細胞增殖情況。*表示與對照組相比,差異有統計學意義,P<0.01
三、高表達CAV1對PAFs中cyclinD1、c-IAP2表達及細胞增殖的影響
采用脂質體2000將CAV1高表達質粒及空質粒分別轉入pCAV1及NC組PAFs中,并于2%氧濃度下培養48小時,檢測兩組PAFs中CAV1、cyclinD1及c-IAP2的表達,以及細胞增殖情況,結果: pCAV1組CAV1表達明顯上調(0.55±0.03vs0.90±0.03,P<0.01),而cyclinD1(0.88±0.02vs0.52±0.02,P<0.01)和c-IAP2(0.87±0.02vs0.72±0.02,P<0.01) 表達下調,PAFs增殖減少(MTT:1.20±0.02vs1.00±0.06,P<0.01;PCNA:0.52±0.03vs0.38±0.03,P<0.01),(見圖3)。
討 論
肺動脈重構是HPH的特征性改變,也是HPH不可逆的主要病理基礎。研究發現肺動脈外膜的重構是HPH早期而顯著的變化,肺動脈外膜的重構主要包括外膜PAFs的異常增殖、遷徙、向肌成纖維細胞的轉化以及膠原和細胞外基質的大量沉積[1,3]。因此,本研究中我們選取PAFs作為研究對象。結果發現,缺氧條件下,PAFs的增殖較正常氧濃度下明顯增加,并呈濃度依賴性,說明缺氧能夠通過調控PAFs的增殖參與肺動脈重構及HPH的形成。
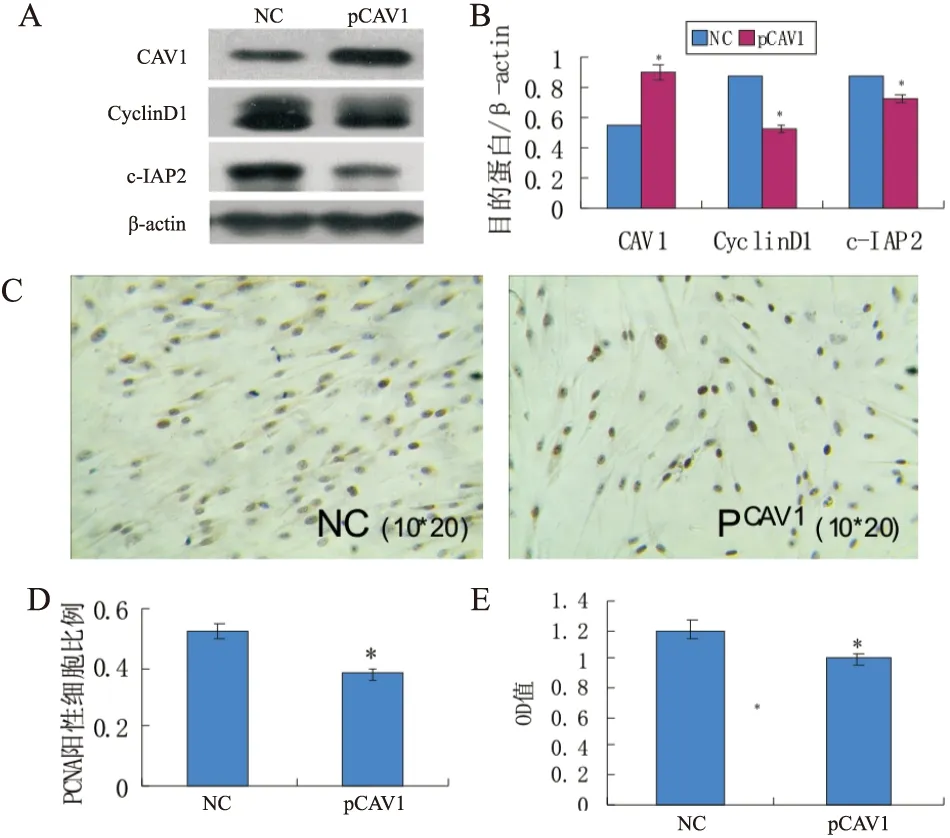
圖3 CAV1高表達質粒轉染對PAFs中CAV1、CyclinD1、c-IAP2及細胞增殖的影響
A、B:空白對照組與pCAV1組PAFs中CAV1、CyclinD1、c-IAP2的蛋白表達量;C:空白組對照組與pCAV1組PAFs的PCNA免疫組化陽性表達情況;D、E:PCNA免疫組化法、MTT法檢測空白對照組與pCAV1組細胞增殖情況。*表示與對照組相比,差異有統計學意義,P<0.01
CAV1為小窩表面標記蛋白,主要參與脂質的形成、胞吞和胞內物質運輸、信號通路的轉導等過程[8-9]。近來研究發現CAV1在肺組織及肺血管的多種細胞組分中均有表達,并參與多種肺部疾病,比如急性肺損傷、肺間質纖維化、肺癌等的發生發展[10]。但迄今為止, CAV1在HPH中的研究甚少,且存在爭議。Wang等研究發現,在特發性肺動脈高壓患者外周血中CAV1表達明顯下降,而在慢阻肺相關肺動脈高壓患者外周血中CAV1表達量較正常對照組有所下降,但未達到統計學差異[11]。提示CAV1可能僅參與了特發性肺動脈高壓的形成,而與HPH的相關性不大。而Cruz等研究發現,將CAV1基因敲除小鼠暴露于缺氧環境三周后,小鼠右室壓力下降并伴隨心輸出量下降、右室肥厚、右室間質纖維化以及右心功能的下降,提示CAV1在HPH的形成中同樣發揮重要作用[12]。通過本研究我們發現,缺氧能夠刺激PAFs的增殖,并伴隨CAV1的表達下降。而采用CAV1高表達質粒轉染PAFs,使CAV1在PAFs中高表達后,PAFs的增殖減少。說明CAV1能夠抑制缺氧引起的PAFs的增殖。因此,我們認為CAV1同樣參與HPH的形成,這與Cruz等研究結果相一致[12]。但CAV1調控PAFs增殖的具體機制,目前尚無相關的研究報道。
眾所周知,細胞周期蛋白是調控細胞周期,影響細胞增殖的重要因素。細胞周期由G1,S,G2,M四個期組成。G1期進入S期,G2期進入M期是整個細胞周期的2個關鍵時期,周期蛋白D是細胞G1/S期轉化的必需蛋白,其中cyclin D1是細胞周期蛋白D中最主要的一種。當cyclin D1高表達時細胞周期轉換加快,引起細胞增殖[13]。在本研究中,我們發現缺氧誘導CAV1在PAFs中低表達后, cyclinD1表達上調,PAFs增殖增加,而高表達CAV1后,cyclinD1在PAFs中的表達隨之下調,PAFs增殖減少。提示, cyclinD1可能是CAV1調控PAFs增殖的下游靶點之一。
既往研究發現,在HPH形成過程中,除了細胞增殖外,細胞凋亡也發揮重要作用[14-15]。細胞凋亡抑制蛋白2(c-IAP2)是IAP家族的主要成員之一。 c-IAP2能結合凋亡相關分子Caspases-3 、Caspases-7 和Caspase-9,并抑制其活性,也可通過其他多種途徑抑制細胞的凋亡過程[16]。因此,本研究中,我們選取c-IAP2作為細胞凋亡檢測的靶點。結果發現,缺氧誘導CAV1在PAFs中低表達后, c-IAP2表達上調,PAFs增加,而高表達CAV1后,c-IAP2表達隨之下調,PAFs減少。提示, CAV1同樣可以通過對c-IAP2的表達調控,影響PAFs的凋亡,進而參與肺動脈外膜的重構。
綜上所述,我們認為,在PAFs中,CAV1能夠通過對下游靶點cyclinD1及c-IAP2的調控影響細胞周期進程及凋亡過程,抑制細胞的增殖,進而抑制缺氧性肺動脈外膜重構及HPH的形成。值得注意的是,CAV1對缺氧的反應可能具有細胞特異性,低氧能促進CAV1在人肺腺癌細胞A549中高表達,并促進腫瘤細胞的粘附、遷徙和侵襲[14]。因此,缺氧狀態下,CAV1在肺動脈中的總體表達情況,以及其對HPH形成的具體調控,需要進一步體內實驗明確。
[1] Chaouat A, Naeije R, Weitzenblum E. Pulmonary hypertension in COPD[J]. Eur Respir,2008,32(5):1371-1385.
[2] Stenmark KR, Fagan KA, Frid MG. Hypoxia-induced pulmonary vascular remodeling cellular and molecular mechanisms[J]. Circulation research,2006,99(7):675-691.
[3] Chen C, Han X, Fan F, et al. Serotonin drives the activation of pulmonary artery adventitial fibroblasts and TGF-β1/Smad3-mediated fibrotic responses through 5-HT2A receptors[J]. Mol Cell Biochem, 2014,397(1-2):267-276.
[4] Goetz JG, Lajoie P, Wiseman SM, et al. Caveolin-1 in tumor progression: the good, the bad and the ugly[J]. Cancer Metastasis Reviews,2008,27(4):715-735.
[5] Patel HH, Zhang S, Murray F, et al. Increased smooth muscle cell expression of caveolin-1 and caveolae contribute to the pathophysiology of idiopathic pulmonary arterial hypertension.[J]. FASEB J,2007, 21(11):2970-2979.
[6] Bakhshi FR, Mao M, Shajahan AN, et al. Nitrosation-dependent caveolin 1 phosphorylation, ubiquitination, and degradation and its association with idiopathic pulmonary arterial hypertension[J]. Pulmonary Circulation, 2013,3(4):816-830.
[7] Sehgal PB, Lee JE. Protein trafficking dysfunctions: Role in the pathogenesis of pulmonary arterial hypertension[J]. Pulmonary Circulation,2011,1(1):17-32.
[8] Cohen AW,Razani B, Schubert W, et al. Role of caveolin-1 in the modulation of lip-olysis and lipid roplet formation[J].Diabetes,2004,53(5):1261-1270.
[9] Wang XM, Kim HP, Song R, et al. Caveolin-1 confers antiinflammatory effects in murine macrophages via the MKK3/p38 MAPK pathway[J]. Am J Respir Cell Mol Biol,2006,34(4):434-442.
[10] 左蓓, 刑敏, 孫珍貴, 等.低氧誘導的小窩蛋白-1 上調參與人肺腺癌細胞A549 遷移和侵襲[J]. 中國病理生理雜志,2014,30(10):1794-1799.
[11] Wang KY, Lee MF, Ho HC, et al. Serum Caveolin-1 as a Novel Biomarker in Idiopathic Pulmonary Artery Hypertension[J]. Biomed Res Int,2015,10:1-7.
[12] Cruz JA, Bauer EM, Rodriguez AI, et al. Chronic hypoxia induces right heart failure in caveolin-1-/- mice[J]. Am J Physiol Heart Circ Physiol,2012,302(12):H2518-H2527.
[13] 王苒, 徐永健, 劉先勝,等. 結締組織生長因子和周期蛋白D1在煙霧暴露大鼠肺血管重塑中的表達變化[J]. 中華結核和呼吸雜志,2010,33(9):679-683.
[14] Yang DL, Zhang HG, Xu YL, et al.Resveratrol inhibits right ventricular hypertrophy induced by monocrotaline in rats[J].Clin Exp Pharmacol Physiol,2010,37:150-155.
[15] Kolli MB, Manne ND, Para R, et al. Cerium oxide nanoparticles attenuate monocrotaline induced right ventricular hypertrophy following pulmonary arterial hypertension[J]. Biomaterials,2014,35(37): 9951-9962.
[16] Augello C, Caruso L, Maggioni M, et al. Inhibitors of apoptosis proteins (IAPs) expression and their prognostic significance in hepatocellular carcinoma[J]. BMC Cancer,2009,9(1):1-10.
The role of CAV1 in human pulmonary artery fibroblasts proliferation
WANGChang-guo,ZENGDa-xiong,LEIWei,HUANGJian-an
DepartmentofRespiratoryMedicine,theFirstAffiliatedHospitalofSoochowUniversity,Suzhou,Jiangsu215006,China
Objective To study the role of CAV1 in hypoxia associated proliferation of human pulmonary artery fibroblasts (PAFs). Methods The PAFs cultured in vitro were divided into four groups, the control group (C: 21%O2), the 10% oxygen group (10%O2), the 5% oxygen group (5%O2) and the 2% oxygen group (2%O2), and then they were given cells proliferation test and the maximal proliferation group was selected as the hypoxia group (H) for further study. The high expression of CAV1 plasmid (pCAV1) was constructed. After that, the PAFs were divided into the control group (C: 21%O2), the hypoxia group (H), the blank control group (NC: hypoxia+null plasmid group) and the high expression of CAV1 plasmid group (pCAV1), and then the cells proliferation was detected by MTT and PCNA immunohistochemistry, and the expression of CAV1, cyclinD1 and c-IAP2 by western-blot in each group respectively. Results Hypoxia induced the proliferation of PAFs in dose dependent manner, and the maximal PAFs proliferation were observed in the 2%O2group within 48 h while compared with the group C (1.20+0.02vs0.54+0.04,P<0.01). In the hypoxia group, the expression of CAV1 decreased (1.23±0.04vs0.90±0.02,P<0.01), while the expression of cyclinD1 (0.19±0.03vs1.15±0.06,P<0.01) and c-IAP2 (0.63±0.04vs0.78±0.09,P<0.01) increased, and PAFs proliferation increased (MTT: 0.78±0.04vs1.20±0.02,P<0.01; PCNA: 0.29±0.03vs0.54±0.03,P<0.01). When CAV1 was high expressed in PAFs (0.55±0.03vs0.90±0.03,P<0.01), the expression of cyclinD1 (0.88±0.02vs0.52±0.02,P<0.01) and c-IAP2 (0.87±0.02vs0.72±0.02,P<0.01) decreased, and PAFs proliferation decreased, too (MTT: 1.20±0.02vs1.00±0.06,P<0.01; PCNA: 0.52±0.03vs0.38±0.03,P<0.01). Conclusion Hypoxia can down-regulate CAV1 expression in PAFs, promote PAFs proliferation and inhibit PAFs apoptosis, and cyclinD1 and c-IAP2 may be the downstream targets of CAV1 in the regulation of PAFs proliferation and apoptosis.
hypoxia; PAH; CAV1; pulmonary artery fibroblasts
10.3969/j.issn.1009-6663.2017.03.003
蘇州市科教興衛青年科技項目(No KJXW2013006),蘇州市產業技術創新專項(應用基礎研究)項目(SYS201530)
215006 江蘇 蘇州, 蘇州大學附屬第一醫院呼吸科及危重癥醫學科
黃建安,E-mail:huang_jian_an@163.com
2016-10-21]

