乳腺腺樣囊性癌臨床病理分析
周 玨,汪春年,陳 潔,王少敏
(寧波市臨床病理診斷中心,浙江 寧波 315000)
?
乳腺腺樣囊性癌臨床病理分析
周 玨,汪春年,陳 潔,王少敏
(寧波市臨床病理診斷中心,浙江 寧波 315000)
目的 探討乳腺腺樣囊性癌(ACC)的病理診斷、免疫表型及臨床預后。方法 復習6例乳腺腺樣囊性癌的臨床病理資料,采用免疫組織化學SP法進行免疫表型檢測并進行分析,同時對患者進行隨訪。結果 6例均為女性,中位年齡58歲,左乳2例,右乳4例,最常見臨床表現為單側乳腺腫塊,影像學無特征性改變,大體境界清楚,也可呈浸潤性生長,鏡下病理形態學多樣,腫瘤成分包括腺上皮細胞(腺腔細胞)和肌上皮細胞(基底細胞)構成,免疫組化表型腺腔細胞表達CK7、E-Cadherin 、CK5/6、CD117,基底細胞表達P63、SMA、s-100, 6例均獲隨訪資料,未出現復發及遠處轉移。結論 乳腺腺樣囊性癌是一類少見類型的乳腺癌,有獨特的組織學形態特征及免疫表型,預后較好。
乳腺;腺樣囊性癌;免疫表型;病理形態;預后
腺樣囊性癌多發生于涎腺,發生于乳腺十分罕見,僅占乳腺癌的0.1%[1],其預后較其他類型乳腺癌好,屬于低度惡性腫瘤,其臨床特征及組織病理學均有一定特征性,但因其非常少見,病理誤診率較高,故診斷必須采用嚴格標準與其他類型的乳腺癌加以鑒別。本研究收集中心2012-2015年間病例6例進行了回顧性臨床病理觀察分析,包括免疫組化特征、診斷依據、治療及預后因素分析,并結合文獻總結,與大家共同探討學習。
1資料與方法
1.1資料
收集寧波市臨床病理診斷中心2011年7月至2015年5月4年間6例乳腺腺樣囊性癌病例,均為女性,年齡38~78(58±10)歲,中位年齡54歲。左側2例,右側4例,臨床癥狀發現乳腺腫塊就診5例,乳腺腫痛1例,術前1例行粗針穿刺活檢,術中5例行冰凍檢查。
1.2方法
手術標本經10%中性福爾馬林固定液固定,常規石蠟包埋,4μm切片,HE染色。復診6例所有病理切片,免疫組化采用Envision二步法,VETANA機染,選用的抗體為CK7、CK5/6、HER-2、CD34、s-100、ER、PR、E-Cadherin、CD117、P63、SMA、Ki-67(各抗體均按要求稀釋濃度比例)。所選試劑購自于羅氏公司(ER、PR、HER-2)及福州邁新生物技術開發有限公司(CD117、CK5/6、SMA、s-100、Ki-67)北京中杉生物技術開發有限公司(CK7、E-Cadherin、CD34、P63),并嚴格按照試劑說明書進行操作,染色結果判斷:細胞質、細胞膜、細胞核等出現棕黃色反應為陽性,HER-2染色結果參照《乳腺癌HER-2檢測指南》標準及方法進行判讀,Ki-67按陽性細胞的百分比計數。
2結果
2.1臨床表現及治療
6例患者均為女性,年齡38~78(58±10)歲,<58歲4例(66.7%),>58歲2例(33.3%),左側2例,右側4例,病程3 ~18個月不等,發現單側乳腺腫塊是最常見的臨床癥狀,2例出現乳腺腫痛。影像學檢查B超提示乳腺腫塊5例,乳腺不規則致密結節影1例。治療:6例中3例行乳腺癌改良根治術,2例行保乳手術,1例行乳腺單純切除術+術后放療; 6例均獲隨訪資料,隨訪5~24個月,未出現復發及遠處轉移;共清掃腋窩淋巴結62枚,均未見淋巴結轉移。
2.2病理改變
6例均為手術切除標本,除 1例術前行穿刺活檢組織外,5例均行冰凍檢查。腫塊大小從1.2×1.0×0.8cm3,到5×4×2.5cm3不等,肉眼觀均為實性腫塊,切面灰白、質地中等;大體標本2例界不清呈浸潤性生長,其余4例界清無包膜。1例穿刺活檢診斷為浸潤性癌,冰凍檢查3例診斷為浸潤性癌,2例則給出傾向性診斷意見,1例傾向腺樣囊性癌,1例傾向浸潤性篩狀癌。常規診斷按Ro等[2]的分級標準,管狀型和篩狀型不伴有實性成分的為Ⅰ級,伴有實性成分≤30%者為Ⅱ級,>30%為實性成分者為Ⅲ級。6例中4例為篩狀型(見圖1)、1例為管狀型、1例為實體型(見圖2);2例為Ⅰ級,3例為Ⅱ級,1例為Ⅲ級,2例可見神經侵犯。
2.3免疫組化
腺樣囊性癌的2類腫瘤細胞各自表達不同的免疫組化標記,腺上皮細胞均表達CK7(見圖3)、CK5/6、CD117,肌上皮細胞表達P63(見圖4)、SMA、s-100,6例中僅1例弱表達ER,其余5例ER、PR、HER-2均為陰性,Ki-67指數5%~30%不等,其中<10%陽性表達者4例,1例20%陽性表達,1例30%陽性表達。
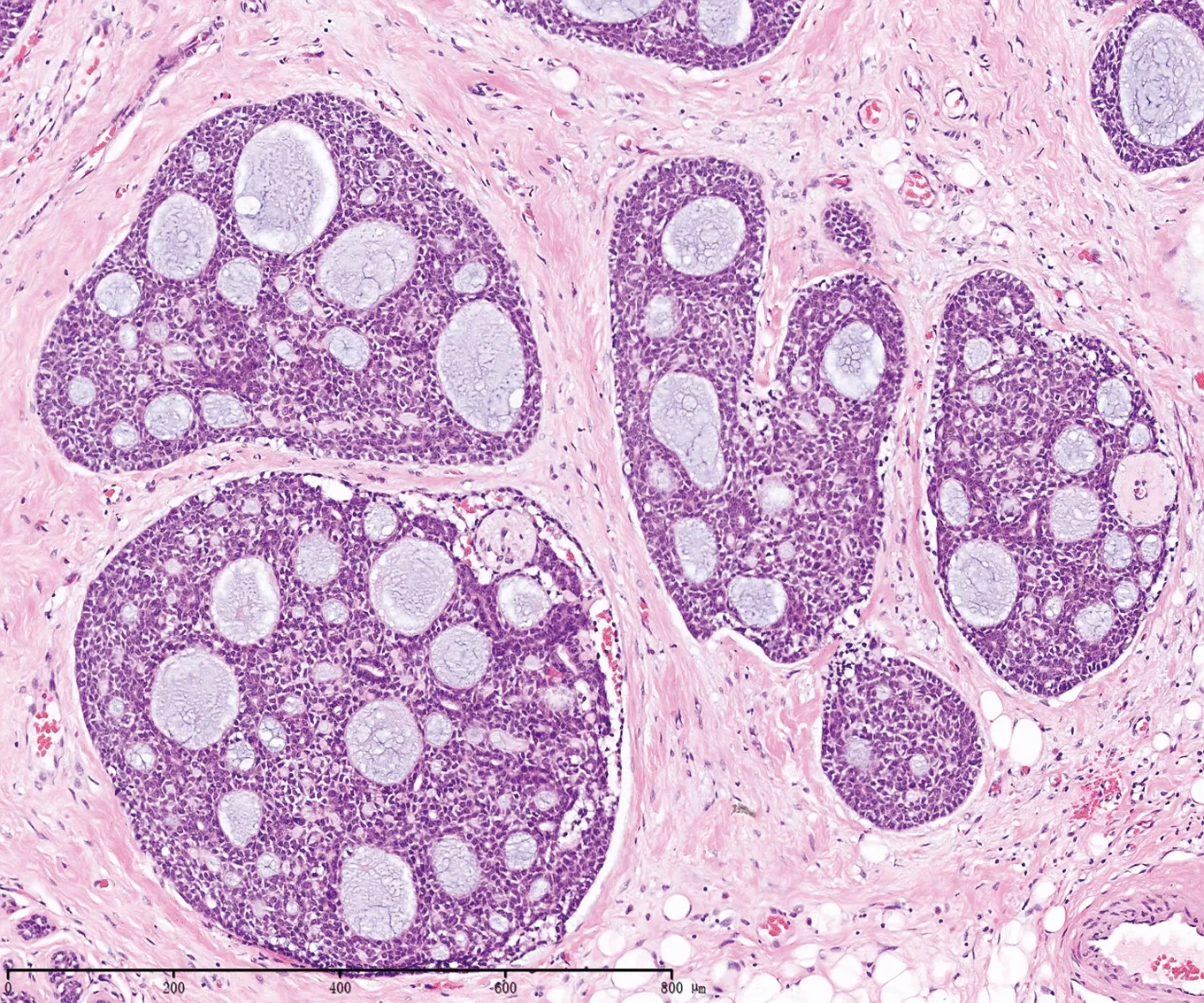
Table1CribriformstructrueofACCTable2SolidstructureofACCTable3CK7positiveinglandularep?ithelialcellsTable4P63positiveinmyoepithelialcells
3討論
3.1臨床特征
腺樣囊性癌(ACC)是唾液性源性腫瘤中較為常見的組織學類型,但發生于乳腺的腺樣囊性癌較為罕見。臨床表現缺乏特異性,為生長緩慢的乳腺實性結節,晚期如腫塊侵犯神經可出現疼痛感,少有乳頭溢液癥狀。絕大部分為女性患者,發病年齡多見于50~60歲之間,雙側乳腺發病幾率相等[3],約一半的腫塊位于乳暈下或乳暈周圍,腫塊質地較一般的乳腺腫瘤軟,界限相對清楚,也有明顯呈浸潤性生長方式的腫塊,一般以中晚期腫瘤常見,其影像學缺乏特征性改變,與其他類型惡性腫瘤較難鑒別,BI-RADS評估多為4,早期界限較清楚的腫塊還易與纖維腺瘤的影像學改變相混淆[4-5]。
3.2病理特征
大體切面常呈實性,灰白灰紅或褐色,可有微囊形成,形態學與唾液腺腫瘤相似,由腺上皮細胞(腺腔細胞)和肌上皮細胞(基底細胞)構成,腺上皮位于小管結構內層或均勻分布于篩狀結構中,常含有嗜酸性胞質,核圓形,偶見小核仁。肌上皮細胞邊界不清,呈短梭形或多角形,胞質嗜雙色或透亮,位于腫瘤團巢周邊和圍繞假腺腔分布。Tavassoli等[6]在14%的病例中發現有第三種細胞,第三種細胞由皮脂成分構成,本組病例中未見明確的第三種細胞。其鏡下形態學表現多樣,包括梁-管狀結構、篩狀結構以及實性結構,其中以篩狀結構最為多見,鏡下由形態單一的細胞巢或條索環繞囊樣腔隙,腔隙內充滿嗜堿性AB染色陽性粘液樣物質或均質嗜酸性PAS染色陽性基膜樣物質,大多數腔隙為假性腺腔,呈圓形或卵圓形,腺腔大小不一,也有小的真性腺腔形成,內含嗜伊紅分泌物。腫瘤組織周圍間質有時可見較為明顯的玻璃樣變性;梁-管狀結構中組成細胞與篩狀結構相似,腫瘤細胞圍繞小的囊樣腔隙,更易見到假性腺腔與膠原化間質相通的現象,真性腺腔也更明顯,有時膠原化間質可將小管壓成小梁狀。實性結構較為少見,可表現為地圖狀或島狀,腫瘤細胞的形態與篩狀型或管狀型相似,但細胞異型性更大,核分裂像也較多,也更容易出現腫瘤壞死成分。以上多種結構經常混合存在,其分級方式Ro等[2]根據腫瘤中實性成分所占比例進行分級,管狀型和篩狀型不伴有實性成分的為Ⅰ級,實性成分≤30%者為Ⅱ級,實性成分>30%為為Ⅲ級。Ⅰ級腺樣囊性癌(無實性區域)預后較好,而實性型則預后較差。也有文獻認為組織學分級可能與預后不一致[7]。而基于腫瘤基因表達譜進行的乳腺癌分子分型及免疫組化分型將腺樣囊性癌歸為基底樣亞型,但其預后與其他基底樣型腫瘤有明顯不同,預后好于其他類型如髓樣癌、化生性癌等基底樣腫瘤,5年和10年生存率分別為95.5%和93.5%,局部復發及淋巴結或遠處轉移均少見[8],故正確診斷該類腫瘤臨床意義十分明顯,能有效避免對患者的過度治療。
3.3腫瘤標記物表達
腺樣囊性癌常與腺肌上皮瘤、微腺體腺病、低級別汗腺癌伴隨存在,說明這些上皮-肌上皮來源的腫瘤互相之間有一定關聯,本組病例并未觀察到上述伴隨改變,可能是入組病例過少原因,Acs等報道17例微腺體腺病與腺樣囊性癌共存,也就是說腺樣囊性癌發生在不典型微腺體腺病的背景下,提示其可能在微腺體腺病的基礎上發生,因此對微腺體腺病尤其是不典型微腺體腺病應加強隨訪。免疫組化表型腺腔細胞表達CK7、E-Cadherin 、CK5/6、CD117,基底細胞表達P63、SMA、s-100,有關腺樣囊性癌的激素受體報道不一,大部分文獻提示腫瘤組織ER、PR、HER-2均為陰性表達,亦有少數ER陽性病例,Arpino等(2002年)對28例腺樣囊性癌病例進行ER及PR免疫結果分析顯示,46%ER陽性,本組病例6例中有1例弱陽性表達ER;Ki-67表達5-30%不等,Kleer等(1998年)研究顯示高核級腺樣囊性癌的Ki-67增值指數更高,但與預后無明確相關性。關于腫瘤組織對CD117的表達情況,大部分腫瘤陽性表達CD117,在實性型中常為強陽性,而在管狀型及篩狀型陽性表達相對較弱或缺如,可用于腺樣囊性癌的診斷及鑒別診斷。
3.4鑒別診斷
乳腺腺樣囊性癌主要與膠原小球病及乳腺浸潤性篩狀癌鑒別,前者形態學主要表現為圓形、無細胞、嗜酸性無定形物質充斥于小葉腺泡和小導管腔內,該物質可以用Ⅳ型膠原抗體識別,膠原小球病常與其他病變合并存在,如硬化性乳腺病等。后者腫瘤的浸潤成分具有明顯的篩狀結構,腺樣囊性癌常含雙層上皮結構,而浸潤性篩狀癌中肌上皮消失;此外,浸潤性篩狀癌ER、PR常為陽性,而腺樣囊性癌多為陰性,浸潤性篩狀癌常與小管癌合并存在。
3.5分子生物學研究
近年來分子生物學方面研究亦取得一定進展,Persson等(2009年)觀察涎腺、乳腺、淚腺等不同部位發生的ACC,發現都具有相同的染色體異位(t6;9),該異位導致了MYB和NFIB融合性基因的產生,檢測該基因的存在有助于其與其他形態類似腫瘤的鑒別,并可能為進展期的ACC提供新的治療途徑。
3.6臨床治療
乳腺腺樣囊性癌發病少見,難以實施前瞻性試驗比較不同的治療[9],故目前尚未標準的治療模式,鑒于其良好的預后,目前主張對乳腺腺樣囊性癌進行保乳手術或乳腺單純切除輔以放射治療[10]。Kulkarni等[11]回顧性分析了美國癌癥中心1998至2008年間933例腺樣囊性癌資料,認為腺樣囊性癌與非特殊類型浸潤性乳腺癌相比較,具有分級低、激素受體陰性、淋巴結轉移少見等特征,臨床治療更傾向于不進行腋窩清掃、保留乳房以及不行術后化療和內分泌治療的處理方法。乳腺腺樣囊性癌最常見的遠處轉移為肺轉移,肝、腎、骨轉移也有報道,但十分罕見[12]。有文獻報道腺樣囊性癌患者在術后6~12年出現遠處轉移,故該腫瘤仍需長期隨訪。
3.7臨床預后發展
發生于乳腺的腺樣囊性癌與發生于涎腺的腺樣囊性癌在形態學及免疫表型特征中均有很多的相似處,但兩者的生物學行為卻有區別[13],前者表現為較為惰性的臨床過程,很少發生淋巴結或遠處轉移,本組病例無一例發生淋巴結轉移。而后者則具有明顯的侵襲性。原因除了腫瘤微環境的相互作用不同導致同一形態腫瘤具有不同的侵襲性外,更重要的可能是MYB和NFIB融合性基因的產生決定了不同部位發生相同形態的腫瘤具有不同的演進模式,其關鍵位點的研究成為揭示該腫瘤本質的決定性因素。
[1]Kim M,Lee D W, Im J,etal. Adenoid cystic carcinoma of the breast: a case series of six patients and literature review[J].Cancer Res Treat,2014,46(1):93-97.
[2]Ro J Y,Silva E G,Gallager H S.Adenoid cystic carcinoma of the breast[J].Hum Pathol,1987,18(12):1276-1281.
[3]Law Y M,Quek S T,Tan P H,etal.Adenoid cystic carcinoma of the breast [J].Singapore Med J,2009,50(1):e8-e11.
[4]Fargahi S,Gu M.Adenoid cystic carcinoma of the breast diagnosed by fine needle aspiration[J].Cytopathology,2012,23(3):205-207.
[5]Righi A,Lenzi M,Morandi L,etal.Adenoid cystic carcinoma of the breast associated with invasive duct carcinoma:a case report [J].Int J Surg Pathol,2011,19(2):230-234.
[6]Tavassoli F A,Devilee P.World health orgnanimion classification of tumours.Pathology and genetics,tumours of the breast an d female genital organs [M].Lyon:IARC Press,2003:44-45.
[7] Miyai K,Schwartz M R,Divatia M K,etal.Adenoid cystic carcinoma of breast: recent advances[J].World J Clin Cases,2014,2(12):732-741.
[8]Thompson K,Grabowski J,Saltzstein S L,etal.Adenoid cystic breast carcinoma: is axillary staging necessary in all cases? results from the California Cancer Registry[J]. Breast J,2011,17(5):485-489.
[9]劉芮,顧雅佳.乳腺腺樣囊性癌臨床特點、影像學表現、病理及診治[J].國際醫學放射學雜志,2012,35(6):536-538.
[10]Coates J M,Martnez S R,Bold R J,etal.Adjuvant radiation therapy is associated with improved survival for adenoid cystic carcinoma of the breast[J].J Surg Oncol,2010,102(4):342-347.
[11]Kulkarni N,Pezzi C M,Greif J M,etal.Rare breast cancer: 933 adenoid cystic carcinomas from the National Cancer Data Base[J].Ann Surg Oncol,2013,20(7):2236-2241.
[12]Glazebrook K N,Reynolds C,Smith R L,etal. Adenoid cystic carcinoma of the breast[J]. AJR Am J Roentgenol,2010,194(5):1391-1396.
[13]朱鴻,傅靜,李科,等.乳腺腺樣囊性癌與涎腺腺樣囊性癌的臨床病理分析及比較[J].臨床與實驗病理學雜志,2011,27(9):924-928.
[專業責任編輯:張冠軍]
Clinicopathological analysis of breast adenoid cystic carcinoma
ZHOU Jue, WANG Chun-nian, CHEN Jie, WANG Shao-min
(Clinical Pathology Diagnostic Center of Ningbo City, Zhejiang Ningbo 315000, China)
Objective To investigate pathological diagnosis, immune phenotype and clinical prognosis of breast adenoid cystic carcinoma (ACC). Methods Clinical and pathological data of six cases of breast ACC were reviewed. Immune phenotype was detected by immunohistochemical SP method and then analyzed. The patients were followed up. Results All cases were female and median age was 58 years old. Lesions of two cases were in left breast and lesions of four cases in right breast. The most common clinical manifestation was unilateral breast lumps with no characteristic radiographic changes. Border was obvious, and invasive growth could also be seen. Diverse pathological pattern could be seen with microscope. Components of tumor consisted of glandular epithelial cells (glandular cells) and myoepithelial cells (basal cells). Immunohistochemistry showed glandular cells expressed CK7, E-Cadherin, CK5/6, and CD117, while basal cell expressed P63, SMA, and s-100. Follow-up data of all 6 patients were acquired, and no recurrence or distant metastases happened. Conclusion Breast ACC is a rare type of breast cancer with unique histological pattern and immune phenotype. Its prognosis is good.
breast; adenoid cystic carcinoma (ACC); immune phenotype; pathological pattern; prognosis
2016-05-03
周 玨(1976-),女,副主任醫師,主要從事病理診斷及研究工作。
10.3969/j.issn.1673-5293.2016.12.037
R655.8
A
1673-5293(2016)12-1540-03

