劑量密集型新輔助化療治療局部晚期宮頸癌的臨床分析
蘇 丹,何文靜,劉 屹,伏曉月,崔慢慢,謝 蘭
電子科技大學附屬醫學院·四川省人民醫院(成都 610000)
·論 著·
劑量密集型新輔助化療治療局部晚期宮頸癌的臨床分析
蘇 丹,何文靜,劉 屹,伏曉月,崔慢慢,謝 蘭△
電子科技大學附屬醫學院·四川省人民醫院(成都 610000)
目的 比較劑量密集型新輔助化療(10日療法)與傳統新輔助化療(21日療法)治療宮頸癌的臨床療效。方法 回顧性收集局部晚期宮頸癌進行新輔助化療+手術患者的臨床病理資料。劑量密集型組采用紫杉醇60 mg/m2+順鉑60 mg/m2靜脈滴注,間隔10 d。傳統化療組采用紫杉醇135 mg/m2+順鉑70 mg/m2靜脈滴注,間隔21 d。比較兩組患者臨床療效的差異。結果 所有患者在接受新輔助化療后2周進行評估,劑量密集型組患者臨床緩解率為78.6%、化療后手術率為89.3%,與傳統化療組(75.0%及93.8%)比較,差異無統計學意義(P>0.05)。兩組患者術后病檢測量的腫瘤直徑均較化療前CT測量直徑縮小[化療前:劑量密集型組:(4.5±1.4) cm,傳統化療組:(4.6±1.3) cm;化療后:劑量密集型組:(2.2±1.4) cm,傳統化療組:(2.3±1.5) cm]。術后病理結果顯示,兩組淋巴結陽性率、宮旁浸潤率、脈管浸潤率及深肌層浸潤率比較,差異無統計學意義(P>0.05)。劑量密集型組患者術后放療率及3年累積生存率分別為60.0%及76.0%,傳統化療組患者術后放療率及3年累積生存率分別為55.6%及82.0%,差異無統計學意義(P>0.05)。兩組化療副反應發生率比較,差異無統計學意義(P>0.05)。結論 劑量密集型新輔助化療與傳統新輔助化療對宮頸癌患者的臨床效果相似,且可縮短手術前化療時間,是一種治療宮頸癌的有效新輔助化療方法。
新輔助化療; 宮頸癌; 劑量密集型
宮頸癌是最常見的婦科惡性腫瘤之一,其發病率在婦女的惡性腫瘤中位居第二[1].其中,局部晚期宮頸癌(locally advanced cervical cancer, LACC, 腫瘤直徑≥4cm,FIGO ⅠB2、ⅡA2及ⅡB期)常伴盆腔淋巴結轉移,預后差。國外治療方法多以放、化療為主,但我國由于放療設備有限,新輔助化療(neoadjuvant chemotherapy)聯合手術治療仍是其主要治療方法之一。新輔助化療是在手術前給予全身化療,其目的是減少腫瘤負荷和消滅微小轉移灶[2],為患者提供手術機會。最常用的化療方案是以鉑類藥物為主的21日療法[3]。為了縮短新輔助化療時間,有學者提出了劑量密集型化療方案,如 10日療法等[4]。本研究比較劑量密集型新輔助化療(10日療法)和傳統新輔助化療(21日療法)對LACC的臨床治療效果。
1 資料與方法
1.1 臨床資料
回顧性選取2009年1月至2015年12月在四川省人民醫院收治并病理確診的LACC患者76例。 納入標準:1)原發腫瘤;2)病理活檢證實為宮頸癌;3)未接受過抗腫瘤治療;4)按照國際婦產科聯盟FIGO分期為ⅠB2,ⅡA2及ⅡB期;5)婦科查體子宮頸局部腫瘤直徑≥4 cm;6)患者年齡20~70 歲;7)健康狀態評分為WHO 0~2分;8)骨髓功能良好(血常規結果:中性粒細胞≥2×109/L,血小板≥100×109/L),肝腎功能正常,心電圖正常。排除標準:1)原發宮頸癌曾進行過其他治療;2)嚴重疾病進展期(包括心臟病、糖尿病未控制理想、重度高血壓、有出血傾向等);3)傳染病、雙癌、曾有化療藥物過敏史;3)妊娠期和哺乳期婦女。化療前患者行常規檢查,并行盆、腹腔CT檢查測定術前腫瘤直徑。根據患者入院日期的奇、偶數將其隨機分入劑量密集型組(10日療法)及傳統化療組(21日療法)。
1.2 治療方法
1.2.1 化療方案 患者采用順鉑(cisplatin,豪森制藥集團)+紫杉醇(paclitaxel,太極制藥集團)化療,即TP方案,用藥間隔分為10日療法及21日療法兩種。10日療法用藥方法:紫杉醇60 mg/m2靜脈滴注,第1天;順鉑60 mg/m2靜脈滴注,第1天。21日療法用藥方法:紫杉醇135 mg/m2靜脈滴注,第1天;順鉑70 mg/m2靜脈滴注,第1天。兩種用藥方案均使用兩個療程。
1.2.2 化療療效及副反應評價 療效評定按世界衛生組織(WHO)實體瘤的評定標準[3],完全緩解(complete response,CR):腫瘤病灶完全消失;部分緩解(partial response,PR):腫瘤病灶縮小50%;腫瘤穩定(stable disease,SD):腫瘤病灶無明顯變化;腫瘤進展(progressive disease,PD):腫瘤病灶較前增大。以完全緩解和部分緩解為有效,以無變化和腫瘤進展為無效。化療副反應按美國國立癌癥研究所(NCI)常見毒性分級標準進行評價。統計兩組3~4度消化道反應(惡心嚴重,不能明顯進食;嘔吐≥6次/24 h;腹瀉≥7次/24 h或嚴重腹痛或需胃腸外支持治療)、3~4度骨髓抑制(WBC<2.0×109/L, PLT<50×109/L,NEU<1.0×109/L,Hb<80 g/L)、3~4度便秘(嚴重或腸絞痛>96 h)、≥2度非感染性發熱(體溫≥38.1 ℃)的患者人數,并進行比較。
1.2.3 手術方法及病理檢查 化療結束2周后根據婦科檢查、B超、CT等情況綜合判定局部腫瘤變化情況,并決定能否手術。不能手術者建議放療,其余能手術者均行廣泛子宮全切術+盆腔淋巴結清掃術+腹主動脈旁淋巴結取樣或切除術。年齡≤40歲的鱗癌患者,保留卵巢行卵巢移位術。術后病理結果分析包括:腫瘤直徑、淋巴結浸潤、宮旁浸潤、脈管浸潤及深肌層浸潤等。
1.2.4 術后治療 術后根據患者病理結果決定是否補充放療。若患者有淋巴結浸潤、陰道斷端陽性、脈管浸潤或宮旁浸潤等,建議補充放療。其余患者術后均接受2~4個療程化療。
1.3 隨訪
隨訪期限設定為從首次診斷為宮頸癌至2015年12月。從開始治療至患者死于宮頸癌(或存活者至末次隨訪)時間為總生存時間。隨訪期間行婦科檢查、淺表淋巴結觸診、宮頸斷端細胞學檢查、盆腹腔B超、盆腹腔CT等。未規律復查者行電話隨訪。用3年累積生存率進行評價。
1.4 統計學方法
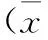
2 結果
2.1 兩組一般資料比較
兩組年齡、臨床分期、病理學類型及組織學分型比較,差異均無統計學意義(P>0.05)(表1)。
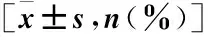
表1 兩組一般資料比較
2.2 兩組療效比較
化療前根據盆腹腔CT測得腫瘤直徑:劑量密集型組為(4.5±1.4) cm,傳統化療組為(4.6±1.3) cm,兩組比較,差異無統計學意義(P>0.05)。化療后根據病理結果測定腫瘤直徑:劑量密集型組為(2.2±1.4) cm,傳統化療組為(2.3±1.5) cm,均較術前明顯減小(P<0.05)。
劑量密集型組化療有效率為78.6%(22/28),傳統化療組為75.0%(36/48),兩組比較,差異無統計學意義(2=1.402,P=0.705)(表2)。化療后手術率:劑量密集型組有25例可以手術,傳統化療組有45例可以手術,兩組手術率分別為89.3%(25/28)及93.8%(45/48),差異無統計學意義(2=0.485,P=0.664)。兩組各有3例不能手術,原因在于局部腫瘤化療后無明顯改變,無法手術。這6名患者行放療。手術后放療:術后根據患者病理結果,劑量密集型組有15例行術后放療,傳統化療組有25例,其放療率分別為60.0%(15/25)和55.6%(25/45),差異無統計學意義(2=0.128,P=0.721)。
2.3 兩組病理結果分析
兩組淋巴結陽性率、宮旁浸潤率、脈管浸潤率及深肌層浸潤率比較,差異均無統計學意義(P>0.05)(表3)。

表2 兩組化療療效比較[n(%)]
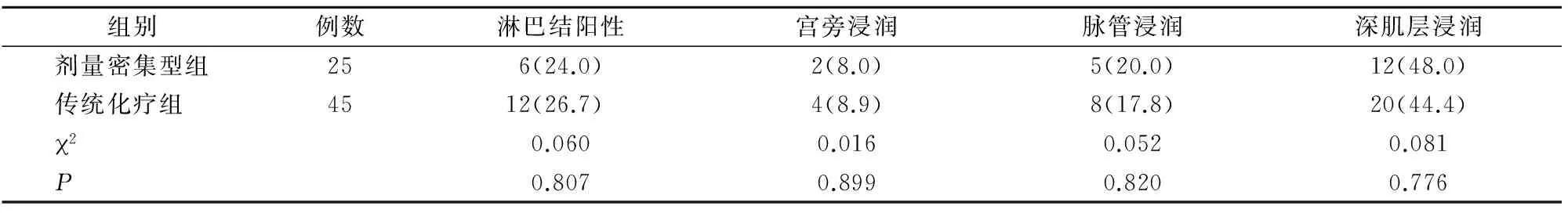
表3 兩組病理結果比較[n(%)]
2.4 兩組生存分析
兩組共76例患者,隨訪期內失訪7例;另有6例化療后不能手術,未按原計劃行新輔助化療+手術治療,按刪失數據處理;隨訪期內死于其他疾病的有5例,部分患者與上述刪失患者重疊;刪失數據共14例。死亡共10例,生存時間5個月~69個月。劑量密集型組和傳統化療組3年累積生存率分別為76.0%和82.0%,其差異無統計學意義(2=0.870,P=0.351)。其中第1年死亡人數:劑量密集型組和傳統化療組各2例;第2~3年分別為1例及3例;3年以上各1例,兩組比較,差異無統計學意義(2=0.314,P=0.623)(圖1)。
2.5 兩組安全性分析
兩組所有患者均出現不同程度的化療副反應,給予對癥治療后,患者臨床癥狀明顯改善,無1例死亡或因副反應放棄治療。兩組各種副反應發生率比較,差異均無統計學意義(P>0.05)(表4)。
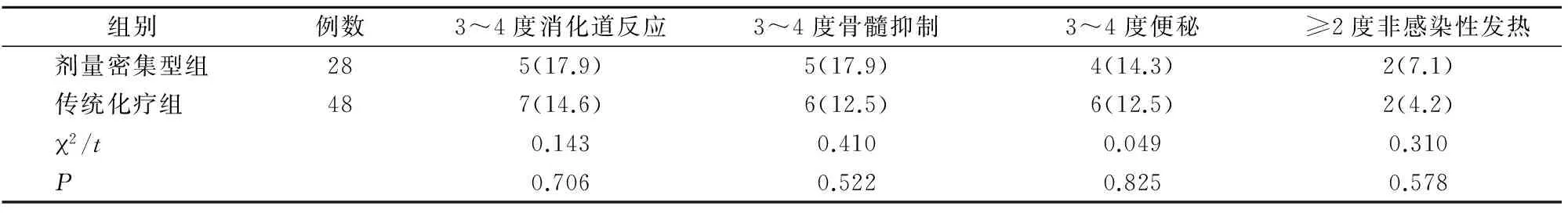
表4 兩組化療副反應比較[n(%)]
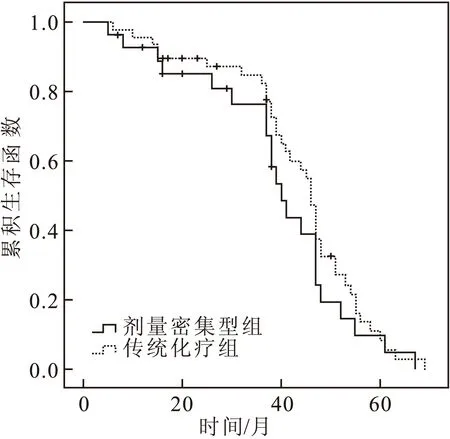
圖1 兩組宮頸癌患者生存曲線圖
3 討論
宮頸癌是全球婦女發病率第二高的惡性腫瘤。全世界每年新發病例約5千萬,中國約占29%[5]。近年來,LACC的發病率逐年上升,且其發病越來越年輕化。在發達國家和地區,LACC的治療方式是放化療為主,但中國部分地區缺少放療設備,并且部分患者擔心放療副反應,如嚴重損害女性的卵巢及陰道功能等,因此選擇新輔助化療聯合手術治療的患者仍很多。世界上除了中國外,其余亞洲國家、部分南美國家、意大利等國對LACC患者也仍采用新輔助化療聯合手術治療[6-7]。2015年NCCN宮頸癌治療指南也肯定了新輔助化療的效果。
目前仍無公認的宮頸癌新輔助化療最佳方案。Osman 等[8]在1項包含30個臨床試驗的Meta分析中發現,博來霉素+長春新堿+順鉑治療宮頸癌的5年無進展生存率和5年累積生存率分別為56.5%~78.7%和61%~82%;吉西他濱+順鉑方案的2年無進展生存率和2年累積生存率分別為65%~81%和69%~88.9%;5-氟尿嘧啶+順鉑方案的5年無進展生存率和5年累積生存率分別為71%~72.7%和76.4%~84.6%;紫杉醇+順鉑+異環磷酰胺的2年無進展生存率和累積生存率分別為87.5%和90%;由此可見紫杉醇+順鉑+異環磷酰胺的患者預后最好。而Li等[9]將紫杉醇+順鉑和紫杉醇+順鉑+異環磷酰胺進行比較后發現,兩者效果接近。紫杉醇+順鉑能獲得較高的有效率和完全緩解率(86.1%和27.8%)。Yang 等[10]報道,紫杉醇+卡鉑的臨床有效率是71.3%,完全緩解率是15.7%,化療后手術率是89.2%,5年累積生存率為85%。本研究劑量密集型組(紫杉醇+順鉑)的有效率是78.6%,3年累積生存率是76.0%,與上述報道的臨床效果接近。
目前主要的新輔助化療方案是以紫杉醇+鉑類藥物為主。大多數紫杉醇+順鉑的新輔助化療方法采用的是21日療法,共使用2~3個療程[3],整個新輔助化療完成需約2個月。研究[1]報道,對于通過新輔助化療能獲得臨床緩解的患者,2個月可能使她們獲得手術機會,提高治療效果;而對于不能獲得臨床緩解的患者,2個月的化療推遲了她們的手術時間,可能耽誤病情。曾有報道[11]顯示,間隔周期<14 d,順鉑劑量每周 > 25 mg/m2即可延長LACC患者的生存率。因此,有學者提出了劑量密集型化療。本研究采用TP方案10日療法,從化療開始距手術時間約為35 d,較21日療法縮短近1個月。與傳統21日療法比較,結果顯示:化療后兩組患者臨床緩解率、手術率、化療副反應發生率等比較,差異均無統計學意義(P>0.05)。對化療后行手術患者的病理結果進行分析后發現,兩組患者的病理特征,如腫瘤直徑、淋巴結陽性率、宮旁浸潤、脈管浸潤、深肌層浸潤等方面比較,差異無統計學意義(P>0.05)。術后兩組放療率比較,差異也無統計學意義(P>0.05)。對患者的長期隨訪顯示,兩組的3年累積生存率相近。
目前,對不同時間間隔的宮頸癌劑量密集型新輔助化療均有文獻報道。Chou等[12]就將40 mg/m2順鉑和4種不同劑量的紫杉醇(50,60,70,80 mg/m2)聯用對ⅠB2~ⅡA2期宮頸癌患者行新輔助化療,時間間隔選用7日,共3個療程,結果顯示,緩解率為50%,此外,58.3%患者進行了術后放療。10日療法也有部分文獻報道。Eddy等[13]用VP 方案(長春新堿1 mg/m2和順鉑 50 mg/m2)進行10日療法,共3個療程,最后臨床緩解率僅52%。本研究利用TP方案10日療法,兩個療程后臨床緩解率為78.6%。另有研究[14]報道的TP方案10日療法(紫杉醇 60 mg/m2和 順鉑 60 mg/m2,5個療程)治療ⅠB2~ⅢB期患者,其臨床緩解率為52.6%,手術率為86.4%,3~4級骨髓抑制率為18%。本研究的手術率和臨床緩解率較高,其原因可能為本研究納入患者為ⅠB2~ⅡB期,病情較上述報道輕。有研究進行了5個療程新輔助化療,有91%的患者堅持完成了治療,部分患者中途放棄。本試驗進行了兩個療程,全部患者均完成了整個治療。化療療程短使患者治療完成率高,依從性增強。
影響宮頸癌預后的因素包括:宮頸深肌層浸潤、宮旁浸潤、盆腔淋巴結轉移、陰道切緣是否陽性以及脈管癌栓等。這些高危因素明顯增加了宮頸癌術后復發風險,并影響患者生存[14]。Wang等[15]報道,未行術后放化療的患者,其術后復發率增高,術后化療是宮頸癌復發的獨立影響因素。因此,本研究所有術后患者均進行了化療。本研究兩種療法對這些高危因素作用效果相似,新輔助化療后手術率、術后放療率及3年累積生存率均相似,說明可以在臨床中使用紫杉醇+順鉑10日療法進行新輔助化療。但本研究樣本量較小,仍需擴大樣本進一步驗證。
綜上所述,采用紫杉醇聯合順鉑對LACC患者實施10日療法的新輔助化療與傳統的21日療法在臨床緩解率、化療后手術率、手術病理特征及患者預后方面效果相似,同時可縮短化療時間,使新輔助化療后患者手術時間提前,為患者爭取更好的治療效果。
[1]Chen H, Liang C, Zhang L,etal. Clinical efficacy of modified preoperative neoadjuvant chemotherapy in the treatment of locally advanced (stage IB2 to IIB) cervical cancer: a randomized study[J]. Gynecologic Oncology, 2008, 110(3): 308-315.
[2]Kim H S, Sardi J E, Katsumata N,etal. Efficacy of neoadjuvant chemotherapy in patients with FIGO stage IB1 to IIA cervical cancer: an international collaborative meta-analysis[J]. Eur J Surg Oncol, 2013, 39(2):115-124.
[3]Yang Z, Chen D, Zhang J,etal. The efficacy and safety of neoadjuvant chemotherapy in the treatment of locally advanced cervical cancer: A randomized multicenter study[J]. Gynecol Oncol, 2016, 141(2): 231-239.
[4]Benedetti Panici P, Palaia I, Marchetti C,etal. Dose-Dense Neoadjuvant Chemotherapy plus Radical Surgery in Locally Advanced Cervical Cancer: A Phase II Study[J]. Oncology, 2015, 89(2):103-110.
[5]Kim K, Zang R, Choi S C,etal. Current status of gynecological cancer in China[J]. J Gynecol Oncol, 2009, 20(2):72-76.
[6]González-Martín A, González-Cortijo L, Carballo N,etal. The current role of neoadjuvant chemotherapy in the management of cervical carcinoma[J]. Gynecologic Oncology, 2008, 110(2): 36-40.
[7]Lissoni A A, Colombo N, Pellegrino A,etal. A phase II, randomized trial of neo-adjuvant chemotherapy comparing a three-drug combination of paclitaxel, ifosfamide, and cisplatin (TIP) versus paclitaxel and cisplatin (TP) followed by radical surgery in patients with locally advanced squamous cell cervical carcinoma: the Snap-02 Italian Collaborative Study[J]. Ann Oncol, 2009, 20(4):660-665.
[8]Osman M. The role of neoadjuvant chemotherapy in the management of locally advanced cervix cancer: a systematic review[J]. Oncol Rev, 2014, 8(250):60-66.
[9]Li Y, Wang X, Li J,etal. Combination therapy of liposomal paclitaxel and cisplatin as neoadjuvant chemotherapy in locally advanced cervical cancer[J]. Eur J Gynaecol Oncol, 2014, 36(1): 54-58.
[10] Yang L, Guo J, Shen Y,etal. Clinical efficacy and safety of paclitaxel plus carboplatin as neoadjuvant chemotherapy prior to radical hysterectomy and pelvic lymphadenectomy for Stage ⅠB2-ⅡB cervical cancer[J]. Int J Clin Exp Med, 2015, 8(8):13690-13698.
[11] Neoadjuvant Chemotherapy for Cervical Cancer Meta-Analysis Collaboration (NACCCMA) Collaboration. Neoadjuvant chemotherapy for locally advanced cervix cancer[J]. Cochrane Database Syst Rev, 2004(2): CD001774.
[12] Chou H H, Huang H J, Lin H,etal. Phase I Dose-Escalation Study of Weekly Paclitaxel and Cisplatin Followed by Radical Hysterectomy in Stages IB2 and IIA2 Cervical Cancer[J]. Am J Clin Oncol, 2014, [Epub ahead of print].
[13] Eddy G L, Bundy B N, Creasman W T,etal. Treatment of (“bulky”) stage IB cervical cancer with or without neoadjuvant vincristine and cisplatin prior to radical hysterectomy and pelvic/para-aortic lymphadenectomy: a phase III trial of the gynecologic oncology group[J]. Gynecologic Oncology, 2007, 106(2): 362-369.
[14] Liu M T, Hsu J C, Liu W S,etal. Prognostic factors affecting the outcome of early cervical cancer treated with radical hysterectomy and post-operative adjuvant therapy[J]. Eur J Cancer Care, 2008,17(2):174-181.
[15] Wang H, Zhu L, Lu W,etal. Clinicopathological risk factors for recurrence after neoadjuvant chemotherapy and radical hysterectomy in cervical cancer[J]. World J Surg Oncol, 2013, 11:301.
A Study on the Clinical Efficacy of High-dose density Neoadjuvant Chemotherapy on Locally Advanced Cervical Cancer
SuDan,HeWenjing,LiuYi,FuXiaoyue,CuiManman,XieLan△.
SchoolofMedicineofUESTC,SichuanProvincialPeople′sHospital,Chengdu610000,China
Objective To compare the clinical efficacy of high-dose density neoadjuvant chemotherapy (HDNC) and classic neoadjuvant chemotherapy (CNC) on locally advanced cervical carcinoma. Methods 76 patients with locally advanced cervical carcinoma were treated with operations and neoadjuvant chemotherapy between January of 2009 and December of 2015 in Sichuan Provincial People′s Hospital and selected as research subjects in this study. The clinicopathological data were analyzed retrospectively. The patients were divided into the HDNC group, in which the patients received 2 cycles of intravenous drip of 60 mg/m2cisplatin and 60 mg/m2paclitaxel with 10-day intervals, and the CNC group, in which the patients received 2 cycles of intravenous drip of 70 mg/m2cisplatin and 135 mg/m2paclitaxel with 21-day intervals. The data were compared to analyze the differences of clinical efficacy between the two groups. Results After all the patients received neoadjuvant chemotherapy for 2 weeks, the clinical remission rate and the surgical rate of the HDNC group were 78.6% and 89.3% respectively, while those of the CNC group were 75% and 93.7% respectively, which showed no statistical significance between the two groups. The diameter of the tumors was reduced after neoadjuvant chemotherapy. The postoperative pathological results showed that there were no significant differences between the two groups in the positive rate of lymph node and the rate of the parametrial infiltration, the lymphovascular space invasion and the deep stromal invasion. The postoperative radiotherapy rate and the 3-year cumulative survival rate of the HDNC group were 60% and 76% respectively, while those of the CNC group were 55.6% and 82%, which showed no significant differences between the two groups. Conclusion The neoadjuvant chemotherapy with high-dose density of cisplatin and paclitaxel for the patients with locally advanced cervical carcinoma has the same clinical efficacy as the classic neoadjuvant chemotherapy, but it can shorten the chemotherapy time before operation. Therefore, it is an effective neoadjuvant chemotherapy for locally advanced cervical carcinoma.
Nneoadjuvant chemotherapy; Cervical cancer; High-dose density
http://www.cnki.net/kcms/detail/51.1705.R.20160825.0835.002.html
10.3969/j.issn.1674-2257.2016.06.012
R711
A
△通信作者:謝蘭,E-mail:841423692@qq.com

