放養密度對大雜交鱘生長性能的影響及生理應答機制
張 墨, 李吉方, 溫海深, 步 艷, 倪 蒙, 任遠源, 來長青, 劉傳忠
?
放養密度對大雜交鱘生長性能的影響及生理應答機制
張 墨1, 李吉方1, 溫海深1, 步 艷1, 倪 蒙1, 任遠源1, 來長青2, 劉傳忠2
(1. 中國海洋大學水產學院海水養殖教育部重點實驗室, 山東青島 266003; 2. 山東鱘龍漁業科技開發有限公司, 山東泗水 273211)
為探討放養密度對魚類生長及生理應答機制的影響規律和作用, 作者以大規格大雜交鱘(達氏鰉()♀×施氏鱘()♂)為實驗材料, 研究了平均初始體質量約為243 g/尾, 放養密度分別為6 (SD1組)、9 (SD2組)、12 (SD3組)、15 kg/m3(SD4組)條件下, 不同放養密度處理70 d后的實驗魚生長性能變化及生理應答機制。結果顯示, 放養密度對大雜交鱘肥滿度影響不顯著, SD2組魚類具有最大的特定生長率和生長效率, 隨著放養密度增加, 日增質量顯著降低(<0.05), 特定生長率和生長效率下降。測定了血液甲狀腺素(T4)、三碘甲腺原氨酸(T3)和皮質醇水平變化, 發現放養密度能引起大雜交鱘3個血液生理指標發生顯著改變; 隨著養殖時間推移, T3和皮質醇濃度顯著升高, T4濃度顯著下降 (<0.05)。這些結果說明神經內分泌活動的變化引起大雜交鱘血液生理指標變化, 進而影響實驗魚生長性能。因此, 在該養殖條件下推薦的養殖密度為9 kg/m3。
大雜交鱘(達氏鰉()♀×施氏鱘()♂); 擁擠脅迫; 特定生長率; 肥滿度; 甲狀腺激素; 皮質醇
魚類作為水生低等變溫脊椎動物, 外界環境的變化對其生存起著至關重要的作用。環境因子的重要影響表現在: 水環境指標(水體富營養化、溶解氧濃度、水體pH值、金屬元素含量、水溫變化等)、種間和個體間對空間的競爭、放養密度的大小等[1]。而放養密度過大會造成養殖對象的生存壓力, 即擁擠脅迫。應激反應就是當魚類體內內環境穩態發生變化時, 能感受到這些變化并做出有利于保持其體內新的穩態, 維持生命活動的應答。如在高密度養殖環境下, 魚體自身會分泌一些激素來調節其生理機制, 適應該生境[2]。
激素由細胞分泌到體液中, 在經過血液或組織液傳送而發揮調節作用, 皮質醇和甲狀腺素不僅是調節生長發育的重要的內分泌激素, 而且在應激反應中作為主要的參與者和判定其程度的標準, 對維持魚體內分泌穩態、分配能量物質、調整新陳代謝速率、促進魚體的生長發育, 增加魚體自身抗病能力等有重要的作用[3-5]。國內外關于擁擠脅迫和激素之間的關系研究已有較多報道[6], 擁擠脅迫對生理生化[7-8]、血液學[9]、新陳代謝[10-11]等許多方面均有直接影響。但對鱘魚養殖中, 擁擠脅迫和生理指標之間的關系研究資料較少。
大雜交鱘是黑龍江流域達氏鰉♀()與施氏鱘♂()的子一代雜交種。其養殖特點是對環境的適應性強、生長周期短、抗病能力強、魚肉富含豐富營養等特點, 近來引起養殖業者的重視, 消費者需求量也逐年上升[12]。作者以流水池塘養殖大雜交鱘為對象, 研究不同放養密度條件下, 實驗魚生長性能狀況及血清皮質醇和甲狀腺素等生理指標的相應變化。通過分析大雜交鱘特定生長率、攝食率、肥滿度等變化規律, 認識放養密度過高而產生的應激脅迫效應機制, 為建立科學合理的流水池塘魚類養殖模式, 優化大雜交鱘魚最佳放養密度, 提高池塘養殖經濟效益提供科學依據。
1 材料和方法
1.1 實驗魚來源與飼養
實驗所用的大規格大雜交鱘是達氏鰉♀()與施氏鱘♂()的子一代雜交種。實驗地點在山東省濟寧市鱘龍漁業科技開發有限公司。采用工廠化流水養殖方式。所選用的實驗魚規格較整齊、體質健壯、無病無傷、體質量(234.4±5.17) g、體長(31.3±0.23) cm。實驗用水為當地地下井水, 水質無污染, 經曝氣池曝氣, 光照充足。進水口水流速為3.30 m3/h。
1.2 實驗方法
魚種放養前3 d將池水排至15 cm深, 用500 mL甲醛溶液全池潑灑。魚種下池前檢查, 確定池水毒性消失后再放魚種。
大雜交鱘魚種放入池后的前3 d不投喂。3 d后開始投喂飼料。投喂時以大部分魚搶食行為減慢食飽散開, 最后幾顆餌料在水中稍停留仍能被攝食的程度, 并記錄每次投餌量。每天8: 00、16: 00、23: 00各喂1次。飼料為寧波天邦股份有限公司生產的人工配合飼料。根據工廠化養殖的實際經驗和前期預實驗結果, 實驗設計4個放養密度處理組, 分別為6、9、12、15 kg/m3, 用SD1、SD2、SD3和SD4表示, 其中SD1組密度受脅迫影響較小。每個實驗組均設3個重復。用美國HACH公司生產的溶解氧測定儀, 每天9: 00和17: 00監測2次水中溶解氧、pH值、水溫。實驗共歷時70 d。
對實驗用魚停食12 h后采血。隨機挑選各密度下的大雜交鱘5尾, 快速放入含有MS-222(200 mg/L)的水桶中進行麻醉。保證將實驗用魚在捕撈過程中因劇烈掙扎而引起的應激程度降到最小。麻醉一段時間后, 在大雜交鱘尾靜脈用1 mL無菌一次性注射器抽血, 血樣室溫放置, 分層后, 用4℃離心機12 000 r/min下, 離心10 min, 用移液槍將血清轉入離心管中, 密封于–80℃保存備用。
采用天津九鼎醫學生物工程有限公司所研制的試劑盒, 使用液相平衡競爭放射免疫分析法(RIA)。在γ-放射免疫計數儀(中國上海, SN-695B) 上測定皮質醇、三碘甲腺原氨酸(T3)、甲狀腺素(T4), 批號為S10940110(皮質醇)、S10930055(T3)、S10930056(T4)。樣品和加入的125I-Cor共同與一定量的特異性抗體產生競爭性免疫反應, 并表現在劑量反應曲線上。具體方法是: 將樣品血清加入標記物和抗體, 充分混勻靜置在37℃水中, 溫育45 min, 之后加入分離劑充分混勻, 4℃離心機3 600 r/min下, 離心20 min, 棄上清液測量沉淀物cpm值。
相關生長指標及其計算公式如下:
肥滿度=/3×100;
日增質量= (2–1) /(2–1);
特定生長率= 100(ln2–ln1) /(2–1);
生長效率= 100(2–1)/;
飼料轉化率=/[(2–1)];
攝食效率= 200/[(2+1)(2–1)];
單位時間內凈增質量= (2/s–1/s)/(2–1);
式中,為平均體質量;為體長(cm);為食物總攝入量(g);1與2為時間;1與2為平均體質量(g);為池塘面積(m2); ;為實驗魚尾數。
1.3 數據處理
實驗數據用SPSS17.0統計軟件進行處理分析, 利用單因素方差分析(One-ANOVA)和Duncan多重比較來檢驗放養密度對大雜交鱘激素、生長等指標的差異性,<0.05為顯著性水平, 所得數據均用平均值±標準差(Mean±SD)表示。
2 實驗結果
2.1 水質指標
大雜交鱘生存的水溫范圍較廣(0~30℃)且其耐低溶解氧[13]。本實驗過程中, 水溫、溶解氧濃度、pH值等均處于大雜交鱘的適宜養殖環境條件下。由表1可知, 實驗期間水質指標均維持在大雜交鱘生長的安全范圍之內。
2.2 激素指標
三碘甲腺原氨酸(T3)在實驗前30 d各密度組含量均呈上升趨勢, 并在30 d時達到最大值, 且各組之間差異顯著(<0.05), 且隨著密度的升高, T3值降低。最高值出現在SD4組, 平均濃度值為4.05 ng/mL, 隨后, 各密度組均呈回落趨勢且高密度組值都高于低密度組, 60 d后趨于平緩, 但低密度組的T3含量始終高于高密度組(圖1)。
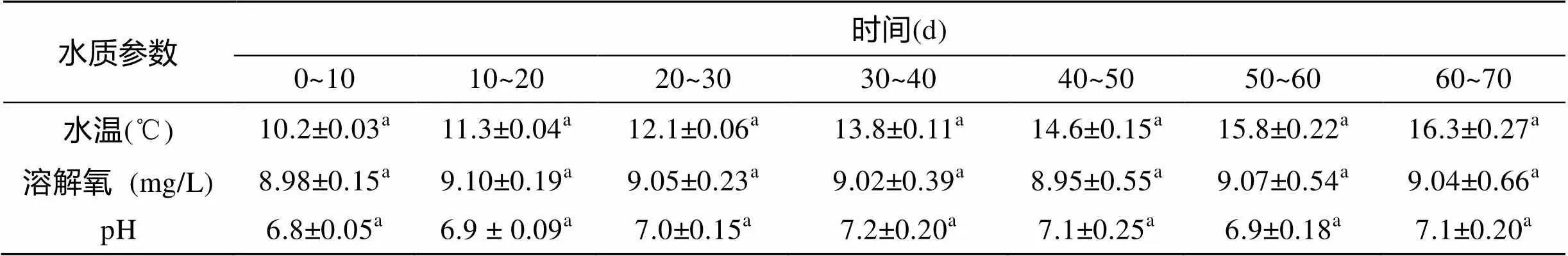
表1 水質參數
注: 同一行中參數上方字母不同代表有顯著性差異(<0.05), 相同則無顯著性差異(>0.05)(下表同)
由圖2可知, 甲狀腺素(T4)的含量隨著時間的增加各組呈上升趨勢, 30 d時T4水平急劇升高, 40 d時各密度組都達到了最大值隨密度的升高各組值呈下降趨勢, 且差異顯著(<0.05); 而這時三碘甲腺原氨酸隨著各密度的升高呈升高趨勢(圖1); T4最高值出現在SD1組, 為2.44 μg/dL。之后則開始明顯降低, 60 d后回落趨勢緩慢。4個密度的值接近, 此時差異不顯著(>0.05)。
擁擠脅迫后大雜交鱘血液皮質醇濃度也呈現先升高后降低的趨勢。10 d時平均值為(0.49±0.11) μg/dL,說明放養環境是安靜的, 應激實驗條件相近。各密度組均在脅迫后30 d達到各組實驗最高值, 且SD4組平均值最高, 為0.768 μg/dL, 與其他各組均有顯著性差異(<0.05)。之后同樣, 各處理組皮質醇水平開始回落, 但高密度組始終維持在最高水平(圖3)。
2.3 放養密度對大雜交鱘生長性能的影響
實驗開始時, 大雜交鱘的肥滿度為0.64~0.67, 實驗結束時, 肥滿度為0.68~0.74。實驗過程中, 肥滿度最高值為0.74出現在SD2 組, 各密度組的肥滿度指標無明顯差異(>0.05)。實驗過程中各密度的大雜交鱘體質量、體長均有所增長, 隨著放養密度的升高, 增長幅度越小(表2)。
養殖70 d后, 各個處理組的生長性能可以看出(表3): 日增質量、食物轉化率、特定增長率、生長效率、攝食效率均有顯著差異(<0.05)。其日增質量、特定增長率、生長效率都隨放養密度的增大而降低。日增質量在SD1組最高, 特定生長率、生長效率在SD2組最高, 凈增質量SD3組最高。日增質量、飼料轉化率、特定增長率、生長效率、攝食效率在SD4組與其他組之間均有顯著差異(<0.05)。
3 討論與小結
魚類的內分泌神經系統在自身生理活動調節中占據主導地位的是下丘腦-垂體-甲狀腺軸(HPT)[14], 下丘腦促甲狀腺激素釋放激素(TRH)經垂體門脈運至腺垂體, 在促甲狀腺細胞的作用下, 由甲狀腺濾泡上皮細胞分泌兩種甲狀腺激素, 即三碘甲狀腺原氨酸(T3)和大量甲狀腺素(T4), 主要作用是促進能量代謝和物質交換、促進骨骼發育。甲狀腺激素保證魚體大腦和身體的正常發育和生長[15-16]。本實驗結果表明, 大雜交鱘在高放養密度下血液中T3和T4水平降低, HPT軸活性與放養密度呈負相關, 與Vijayan等[17]對溪紅點鮭()的研究結果一致。可能是由于該放養密度下, 大雜交鱘對于餌料的攝入量減少, 進而使得血液中激素水平降低, 在密度脅迫下T4不斷向T3轉化, 皮質醇濃度反而隨之增加。在高密度放養的脅迫下, 能量流動和物質循環通過分解作用和對自身生理機制的調整來實現, 其主要表現就是魚體對于甲狀腺素的調節作用[3, 18]。
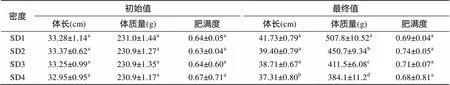
表2 不同放養密度下體長、體質量和肥滿度的初始值和最終值
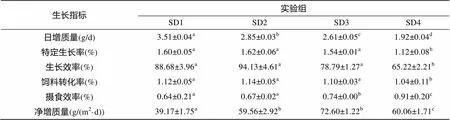
表3 大雜交鱘魚在不同放養密度下的生長指標
當魚類為適應其生活的水體環境, 神經內分泌系統即按環境需求對自身生理活動進行調節。這時, 下丘腦-垂體-腎間組織軸(HPI)[19]變得尤為重要。當周圍水體環境對魚體產生脅迫效應時, 在魚體下丘腦會刺激腦垂體前葉分泌促腎上腺皮質激素釋放激素(CRH), 由神經細胞分泌促腎上腺皮質激素(ACTH), 傳遞給腎間組織。腎間組織主要分泌的激素是皮質醇[20-21], 其對魚類生理學研究有著至關重要的作用: 提高血液中葡萄糖的合成速率; 尤其在肝臟、肌肉等組織中, 抑制核酸合成過程, 提高肌肉中蛋白質的分解速率; 提高血液中合成的氨基酸速率; 提高組織中脂肪的氧化速率等。有研究表明, 皮質醇含量過高時, 會造成生物生長終止、體內脂肪合成速率降低, 肌肉消退, 最終導致機體消瘦[22]。但是作為一種至關重要的激素, 皮質醇與應激效應有著緊密的聯系[23-25]。在魚體受到脅迫的情況下, 皮質醇最先做出反應, 因此描述皮質醇水平的變化被公認為反應魚體應激情況的指標[26]。例如, 尼羅羅非魚() 隨著擁擠脅迫的增大, 皮質醇含量顯著增加[27]。對真鯛()的研究發現, 當擁擠脅迫持續30 d左右時, 皮質醇濃度顯著升高[28], 與本實驗結果相近。這可能是由于皮質醇能促進血糖的合成和加速脂肪的氧化有關。因此, 當魚體內大量產生皮質醇時, 合成的能量物質可以有效地抵抗擁擠脅迫產生的壓力。本實驗中, 40 d后由于大雜交鱘也開始適應慢性擁擠脅迫, 各密度組的皮質醇濃度開始回落。有研究表明[17]皮質醇對應激過程中產生的化學能傳遞進行了再次作用。本實驗中, 擁擠脅迫初期, 魚體內的血漿皮質醇濃度會顯著升高, 但隨著時間的增加, 大雜交鱘自身開始適應周圍的水體環境。此時, 皮質醇又會下降并接近原有的水平, 出現了激素指標先升高后降低的趨勢, 在整個實驗過程中SD1、SD2組的皮質醇水平較低, 表明該實驗組的鱘魚受到的擁擠脅迫影響相對較小。同樣有研究表明[29], 虹鱒()在過高的放養密度下, 皮質醇濃度會突然升高, 8 d后下降并接近最初值, 該結論也與本實驗結果相似。
魚類的生長率、存活率和飼料轉化率等受擁擠脅迫影響較大且呈負相關趨勢[4]。虹鱒的生長效率在較高的環境密度脅迫下會顯著降低[30]。施氏鱘稚魚研究表明, 其特定生長率隨擁擠脅迫的增加而顯著降低; 隨放養密度其飼料轉化率顯著增加[31]。本實驗大雜交鱘最終體長、最終體質量、日增質量、生長效率和凈增質量都隨放養密度的增大而顯著性降低, 表明擁擠脅迫對大雜交鱘生長性能產生了不同程度的抑制。SD4組的攝食效率顯著高于其他處理組, 但其飼料轉化率最低, 而SD2組攝食效率較低, 但飼料轉化率最高, 且該組生長效率、凈增質量均達到最高, 也表明SD2組在該條件下有明顯的生長優勢。這與李大鵬等[31]所做的施氏鱘在不同放養密度實驗中生長效率、凈增質量在最高密度組為最大的結果不同。肥滿度與魚體的體質量和體長有關, 賈瑞錦[32]指出, 氣候、攝食條件和個體之間的生長差異和生理變化等因素和肥滿度密切相關, 而擁擠脅迫對其影響較小, 本實驗中的實驗結果也證明了這一論點。
有學者認為[33]生長率下降的主要原因可能是隨著放養密度的增加, 當放養密度過大時, 隨著飼料轉化率的降低, 會最終導致魚體生長的滯后。神經內分泌系統分泌的皮質醇其主要作用是保護免疫系統和維持體內物質代謝的正常進行。當放養密度過大造成擁擠脅迫時, 皮質醇大量分泌, 會造成魚體自身內環境的改變, 消耗大量體內儲存的能量, 為了維持血糖平衡, 能量物質無法儲存, 最終阻礙魚體正常生長[3]。還有研究表明[34], 飼料轉化率降低和對生存空間的競爭會隨著擁擠脅迫的加劇而增加, 當飼料不能作為有效的能量來源提供營養時, 魚體的生長速度就會下降, 并可能引發疾病和較高的死亡率、種間斗爭。慢性擁擠脅迫對高密度組特定生長率值影響顯著, 這樣的結果第一可能是由于高密度組大雜交鱘攝食水平相對不均, 搶食現象嚴重, 導致高密度組一小部分鱘魚個體生長速率較大, 而另外的絕大部分個體生長速率一直處于較低水平, 影響了整池試驗對象的生長速度偏低; 第二是由于試驗對象為了適應高密度的水體環境, 通過神經內分泌系統的一系列化學變化, 引起生理和生化指標的調控, 免疫學指標的變化, 進而通過大量消耗魚體自身產生的能量來調節生理活動, 最終阻礙了魚體的生長。本研究還發現, 特定生長率和生長效率在高密度組最低, 表明大雜交鱘在較高的放養密度下相互間的確存在著明顯的負面影響, 因此, 一味提高放養密度并不會始終提高養殖對象產量, 對魚體來說反而是一種生存壓力, 這與Baker等[35]的觀點一致。
以上研究均表明, 大雜交鱘的生長性能和生理應答機制在慢性擁擠脅迫下發生了不利變化, 進而使其生理狀態發生階段性改變。因此, 在該養殖條件下推薦的養殖密度為9 kg/m3。然而在實際養殖生產過程中, 大雜交鱘應激程度的大小的評定和應激后需要采用的有效修復措施, 是值得進一步研究的重要領域。
[1] Pickerng A D, Duston J. Administration of cortisol to brown trout, Salmo tutta L, and its effects on the susceptibility toinfection and furunculosis[J]. Journal of Fish Biology, 1983, 23: 163-175.
[2] 張廷軍, 楊振才, 孫儒泳. 魚類對高密度環境的適應[J]. 水產科技情報, 1998, 25(3): 110-113. Zhang Tingjun, Yang Zhencai, Sun Ruyong. The acclimation of fishes to high stocking density[J]. Fisheries Science & Technology Information, 1998, 25(3): 110- 113.
[3] Kazim S, Hasan Y, Cemal O, et al. The effect of lycopene on antioxidant status in rainbow trout () reared under high stocking density[J]. Aquaculture, 2014, 418: 132-138.
[4] Bj?rn B, Agnar S, Matthías O, et al. Optimal stocking density of juvenile Atlantic cod (L.) reared in a land-based farm[J]. Aquaculture, 2012, 356: 342-350.
[5] Sumpter J P, Dye H M, Benfey T J. The effect of stress on blood ACTH,a-MSH and cortisol levels in salmonid fishes[J]. General and Comparative Endocrinology, 1986, 62(3): 377-385.
[6] Cristina E T, Amalia E M, Manuel H. Physiological effects of crowding in rainbow trout,, selected for low and high stress responsiveness[J]. Aquaculture, 2006, 258(1-4): 583-593.
[7] 于淼, 樊啟學, 程鵬, 等. 急性擁擠脅迫對鯉血液中皮質醇及幾項生化指標的影響[J]. 淡水漁業, 2008, 38(4): 20-24. Yu Miao, Fan Qixue, Cheng Peng, et al. Effects of acute crowding stress on cortisol and several biochemical indexes inserum[J]. Fresh Water Fisheries, 2008, 38(4): 20-24.
[8] Eva V K, Harald G, Ellen M F, et al. Changes in muscle and blood plasma proteomes of Atlantic salmon () induced by crowding[J]. Aquaculture, 2010, 309(1-4): 272-279.
[9] Ruane N M, Huisman E A, Komen J. Plasma cortisol and metabolite level profiles in two isogenic srtains of common carp during confinement[J]. Journal of Fish Biology, 2001, 59(1): 1-12.
[10] 王文博, 李愛華, 汪建國, 等. 擁擠脅迫對草魚非特異性免疫功能的影響[J]. 水產學報, 2004, 28(2): 139-144. Wang Wenbo, Li Aihua, Wang Jianguo, et al. The effect of crowding stress on non-specific immune functions of[J]. Journal of Fisheries of China, 2004, 28(2): 139-144.
[11] Fagerlund U H M, McBride J R, Stone E T. Stress-related effects of hatchery rearing density on coho salmon[J]. Transactions of the American Fisheries Society, 1981, 110: 644-649.
[12] 郝世超, 黃璞祎, 于洪賢. 攝食水平對雜交鱘生長的影響[J]. 東北林業大學學報, 2008, 36(12): 43-45. Hao Shichao, Huang Puyi, Yu Hongxian. Effect of ration level on growth of hybrid sturgeon[J]. Journal of Northeast Forestry University, 2008, 36(12): 43-45.
[13] 孫大江, 曲秋芝, 張穎, 等. 中國的鱘魚養殖[J]. 水產學雜志, 2011, 24(4): 67-70. Sun Dajiang, Qu Qiuzhi, Zhang Ying, et al. Sturgeon aquaculture in China[J]. Chinese Journal of Fisheries, 2011, 24(4): 67-70.
[14] Kuhn E R, Geris K L, Geyten S. Inhibition and activation of the thyroidal axis by the adrenal axis in vertebrates[J]. Comparative Biochemistry and Physiology, 1998, 120A: 169-174.
[15] 沈同, 王鏡巖. 生物化學[M]. 北京: 高等教育出版社, 1991: 420-460. Shen Tong, Wang Jingyan. Biochemistry[M]. Beijing: Higher Education Press, 1991: 420-460.
[16] 于道德, 寧璇璇, 任貴如, 等. 甲狀腺激素在魚類繁殖中的作用[J]. 海洋科學, 2010, 34(7): 106-110. Yu Daode, Ning Xuanxuan, Ren Guiru, et al. Functions of thyroid hormone in fish reproduction[J]. Marine Sciences, 2010, 34(7): 106-110.
[17] Vijayan M M, Leatherland J F. High density affects cortisol secretion and tissue distribution in brook charr,[J]. Journal of Endocrinology, 1990, 124: 311-318.
[18] Ader R, Felten D L, Cohen N. Phychoneuroimmunology[M]. New York: Academic Press Inc, 1991: 12-18.
[19] Bernier N J, Perter R E. The hypothalamic-pituitary- interrenal axis and the control of food intake in teleost fish[J]. Comparative Biochemistry and Physiology, 2001, 129B: 639-644.
[20] Jeney Z, Jeney G, Maule A G. Cortisol measurements in fish[M]. USA: SOS Publications, 1992: 157- 166.
[21] 徐長安, 李軍, 張士璀. 激素誘導歐氏六線魚性腺發育的初步研究[J]. 海洋科學, 1998, 12(3): 4-5. Xu Changan, Li Jun, Zhang Shicui. Initial study on gonad development of Otaki’s gneenling induced by different hormone[J]. Marine Sciences, 1998, 12(3): 4-5.
[22] 王樹啟, 許友卿, 丁兆坤. 生長激素對魚類的影響及其在水產養殖中的應用[J]. 水產科學, 2005, 24(7): 42-46. Wang Shuqi, Xu Youqing, Ding Zhaokun. Effects of growth hormone on fishes and its application in aquaculture[J]. Fisheries Sciences, 2005, 24(7): 42-46.
[23] McKenzie D J, H?glund E, Dupont-Prinet A, et al. Effects of stocking density and sustained aerobic exercise on growth, energetics and welfare of rainbow trout[J]. Aquaculture, 2014, 338: 216-222.
[24] Jennifer M R, Grant W F, Zoltan M V, et al. Whole-body cortisol is an indicator of crowding stress in adult zebrafish,[J]. Aquaculture, 2006, 258: 565-574.
[25] Gisella P, Giovanna P, Maria D, et al. Effect of stocking density and group size on growth performance, carcass traits and meat quality of outdoor-reared rabbits[J]. Meat Science, 2013, 93: 162-166.
[26] Chattopadhyay D N, Mohapatra B C, Adhikari S, et al. Effects of stocking density ofon survival, growth and production in cages[J]. Aquaculture International, 2013, 21: 19-29.
[27] Thomasl L W, Chhorn L, Mediha Yildirim-Aksoy, et al. Growth, immune function and disease and stress resistance of juvenile Nile tilapia()fed graded levels of bovine lactoferrin[J]. Aquaculture, 2007, 262: 156-162.
[28] Rotllant J, Tort L. Cortisol and glucose responses after acute stress by net handling in the sparid red porgy ()previously subjected to crowding stress[J]. Journal of Fish Biology, 1997, 51: 21-28.
[29] Barton B A, Peter R E, Paulencu C R. Plasma cortisol 1evels of fingerling rainbow trout () at rest and subjected to handling confinement, transport and stocking[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1980, 27: 805-811.
[30] Ellis T, North B, Scott A P, et al. The relationship between stocking density and welfare in farmed rainbow trout[J]. Journal of Fish Biology, 2002, 61: 493-531.
[31] 李大鵬, 莊平, 嚴安生, 等. 光照、水流和放養密度對史氏鱘稚魚攝食、行為和生長的影響[J]. 水產學報, 2004, 28(1): 54-61. Li Dapeng, Zhuang Ping, Yan Ansheng, et al. The influences of illumination, water current and stocking density on feeding, behavior and growth in juveniles[J]. Journal of Fisheries of China, 2004, 28(1): 54-61.
[32] 賈瑞錦, 陳超, 孔祥迪, 等. 饑餓對條紋鋸鮨仔魚的存活、攝食及生長的影響[J]. 海洋科學, 2014, 38(4): 44-49. Jia Ruijin, Chen Chao, Kong Xiangdi, et al. Effects of starvation on suriving, feeding and growth of the Yolk-sac larval of[J]. Marine Sciences, 2014, 38(4): 44-49.
[33] 李玉全, 王仁杰, 姜令緒. 密度脅迫對日本囊對蝦生長和水環境的影響[J]. 海洋科學, 2013, 37(10): 53-57. Li Yuquan, Wang Renjie, Jiang Lingxu. Effects of density-stress on water quality and growth of[J]. Marine Sciences, 2013, 37(10): 53-57.
[34] Bodil K L, Peter V S, David J M, et al. The effects of stocking density and low level sustained exercise on the energetic efficiency of rainbow trout () reared at 19℃[J]. Aquaculture, 2012, 324: 226-233.
[35] Baker R F, Ayles G B. The effects of varying density and loading level on the growth of arctic charr(L.) and rainbow trout[J]. Journal of the World Aquaculture Society, 1990, 121, 313-326.
Effect of stocking density on growth performance and mechanism of physiological response in hybrid sturgeon
ZHANG Mo1, LI Ji-fang1, WEN Hai-shen1, BU Yan1, NI Meng1, REN Yuan-yuan1, LAI Chang-qing2, LIU Chuan-zhong2
(1. Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China; 2. Shandong Xunlong Sci-tech CO.LTD, Sishui 273211, China)
To study the effect of stocking density on growth performance and mechanism of physiological response in hybrid sturgeon, an experiment was performed on large-sized hybrid sturgeon (♀ ×♂), with an initial weight of 243 g per fish, at a stocking density of 6 (SD1 group), 9 (SD2 group), 12 (SD3 group), and 15 kg/m3(SD4 group) over a 70-day period. Results showed that daily weight gain decreased significantly (<0.05) with increasing stocking density. Moreover, increasing density resulted in a decrease in specific growth rate and growth efficiency, with the best specific growth rate and growth efficiency in the SD2 group. However, density had an indistinguishable effect on relative fatness. In the study, serum thyroxine (T4), triiodothyronine (T3), and cortisol were significantly affected by stocking density. T3and cortisol levels increased significantly (<0.05), whereas the T4level decreased (<0.05) over breeding time. The results indicate that the change in neuroendocrine activity affect the serum physiological indices, which can influence growth performance in experimental fish. Therefore, we suggest that 9 kg/m3as an appropriate stocking density for aquaculture.
Hybrid sturgeon; crowding stress; specific growth rate; relative fatness; thyroid hormones; cortisol
(本文編輯: 譚雪靜)
[Special Fund for Agro-scientific Research in the Public Interest, No.20103055]
May 12, 2015
S917.4
A
1000-3096(2016)08-0035-07
10.11759//hykx20150512001
2015-05-12;
2015-07-27
公益性行業 (農業) 科研專項經費資助項目(201003055)
張墨 (1987-), 男, 天津人, 碩士研究生, 主要從事魚類生理學研究, E-maiL: 575839558@qq.com; 李吉方, 通信作者, 副教授, E-mail: lijif@ouc.edu.cn

