大黃素甲醚對胰腺癌SW1990細胞的殺傷作用及其機制
楊 勇
大黃素甲醚對胰腺癌SW1990細胞的殺傷作用及其機制
楊 勇*
目的 觀察大黃素甲醚對胰腺癌SW1990細胞增殖、細胞周期及凋亡的影響,并探討其作用機制。方法 Western印跡檢測不同濃度大黃素甲醚干預后PI3K/Akt信號通路蛋白水平,MTT檢測不同濃度、時間下,大黃素甲醚對SW1990細胞增殖的影響。流式細胞術檢測大黃素甲醚對SW1990周期及凋亡的影響。結果 與NC組比較,Physcion組mTOR及p-Akt表達水平呈劑量依賴性下降,Akt表達呈劑量依賴性上升,其中5、50 μmol/L組與NC組比較差異有統計學意義(P<0.05);Physcion組細胞存活率呈時間依賴性下降,在48、72、96 h時,與NC組比較差異有統計學意義(P<0.05)。Physcion組SW1990存活率呈劑量依賴性下降,其中0.5、5、50 μmol/L組與NC組比較差異有統計學意義(P<0.05);與NC組比較,Physcion組停留在G1、G2期細胞比例減少,S期細胞比例升高(P<0.05);Physcion組凋亡率高于NC組(P<0.01)。結論 大黃素甲醚通過抑制Akt磷酸化,調控PI3K/Akt通路,降低胰腺癌細胞存活率,促進其凋亡。
胰腺癌;大黃素甲醚;凋亡
0 引言
胰腺癌的發病率在全球呈現逐年上升及年輕化的趨勢,是消化系統惡性腫瘤中預后最差的腫瘤之一,5年生存率低于5%,大部分胰腺癌發現時均失去手術機會[1]。目前的化療藥物及靶向藥物對于不能手術的胰腺癌及轉移復發的胰腺癌治療效果較差,而且較容易發生耐藥,中藥治療胰腺癌從以往的復方用藥發展到現在的單藥治療,取得了一定的研究進展[2]。PI3K/Akt信號通路是腫瘤細胞內重要傳導通路之一,該通路被激活后,會抑制腫瘤細胞凋亡,促進腫瘤細胞增殖,調控腫瘤的發生發展[3]。中藥大黃在前列腺癌、結腸癌及乳腺癌等惡性腫瘤中應用的研究表明,大黃中的成分如大黃素及蒽醌類可以抑制惡性腫瘤細胞增殖,促進其凋亡,具有一定的抗腫瘤作用[4]。對大黃含有的單劑成分的研究是抗癌中藥的研究方向。大黃素乙醚是近期在掌科大黃根中提取出來的,具有對人體低毒低反應的特點。有研究顯示,其對結直腸癌及乳腺癌具有抑癌作用[5],但其在胰腺癌中的作用尚無相關報道。本研究采用大黃素乙醚干預胰腺癌細胞,觀察細胞增殖、凋亡及細胞周期變化,目的在于觀察大黃素乙醚單劑對胰腺癌細胞的殺傷作用,探討其機制,為臨床應用提供實驗依據。
1 材料與方法
1.1 材料 人胰腺癌細胞株SW1990購自中科院上海細胞庫,采用貼壁細胞培養法,加入含100 U/mL的青霉素及鏈霉素,在37 ℃、5% CO2飽和濕度培養箱中培養。以0.25%胰蛋白酶消化傳代,取對數生長期細胞進行以下實驗,所有實驗均重復3次,取平均值進行統計分析。大黃素甲醚(CAS No:521-61-9)購自南京景竹生物科技有限公司,DAB顯色試劑盒、ECL發光試劑盒及BCA定量試劑盒購自南京凱基生物公司,mTOR多克隆抗體、p-Akt多克隆抗體及Akt多克隆抗體購自美國Santa Cruz生物技術公司,MTT試劑盒購自美國Invitrogen公司,Annexin V-FITC/PI試劑盒購自美國GeneCopoeia公司。實驗細胞分為給予大黃素甲醚干預的Physcion組及不給予干預的正常對照組(NC組)。
1.2 方法
1.2.1 Western印跡 Physcion組以5、10、15、20、25 μmol/L濃度梯度的大黃素甲醚分別作用48 h,NC組不給予干預培養48 h,按照蛋白提取試劑盒說明書進行不同濃度梯度大黃素甲醚細胞及NC組細胞的蛋白提取,10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離蛋白,電轉移至PVDF膜。5%脫脂奶粉室溫下封閉90 min后分別加入不同一抗,孵育過夜加入相應二抗,再次孵育后采用化學發光法進行顯色,以β-actin作為內參照。應用BioRad圖像分析系統測定蛋白條帶吸光度,目標蛋白吸光度/內參照蛋白吸光度=蛋白相對表達量。
1.2.2 MTT法檢測不同濃度、不同時間大黃素甲醚干預后的細胞存活率 兩組細胞以6×104/mL加入96孔板,培養6 h。細胞貼壁后,Physcion組加入0.05、0.5、5、50 μmol/L濃度梯度的大黃素甲醚,作用48 h;NC組給予DMSO干預,培養48 h,作為加藥組,進行平行對照,每個濃度均設3個復孔。48 h后,于每孔內加入5 mg/L的10% MTT液,于37 ℃溫箱中孵育4 h,棄上清,加入150 μL DMSO,震蕩20 min后測定光密度值(OD值),計算細胞存活率。另取細胞,待貼壁后,Physcion組加入5 μmol/L大黃素甲醚,NC組給予DMSO作為平行對照,分別在細胞培養24、48、72、96 h后進行MTT檢測,測定細胞在不同時點的存活率。
1.2.3 流式細胞術檢測細胞周期及凋亡 Physcion組(5 μmol/L大黃素甲醚干預24 h)及NC組SW1990培養48 h,移至EP管,1 mL預冷后PBS洗滌,加1 mL預冷70%乙醇,4 ℃條件下固定24 h。1 100 g離心5 min后棄上清。每個樣品PBS重懸,加0.5% PI 30 μL、15 μL RNase A (10 mg/mL),4 ℃避光溫浴30 min。流式細胞儀檢測細胞周期。另取培養48 h的Physcion干預細胞及NC組細胞,依照Annexin V-FITC/PI試劑盒說明書步驟檢測細胞凋亡,應用軟件Cell Quest分析,計算早期凋亡陽性細胞比例。

2 結果
2.1 大黃素甲醚干預后相關蛋白的表達 Western blot檢測不同濃度大黃素甲醚干預前后PI3K-Akt-mTOR信號通路相關蛋白變化,與NC組對比,Physcion組mTOR、p-Akt表達水平呈劑量依賴性下降,在5、50 μmol/L時差異有統計學意義(P<0.05,P<0.01);Akt表達呈劑量依賴性上升,在5、50 μmol/L時差異有統計學意義(P<0.05,P<0.01),見圖1。

圖1 Western blot檢測PI3K-Akt-mTOR信號通路相關蛋白表達
2.2 大黃素甲醚干預后SW1990細胞的存活率 MTT顯示,在不給予干預條件下,Physcion組(5 μmol/L)及NC組SW1990細胞培養24、48、72、96 h后,Physcion組細胞存活率呈時間依賴性下降趨勢,與NC組比較,在48、72、96 h差異有統計學意義(P<0.05,P<0.01),見圖2。Physcion組加入0.05、0.5、5、50 μmol/L的大黃素甲醚作用48 h后,與NC組(Physcion濃度為0)對比,SW1990存活率呈劑量依賴性下降,在濃度0.5、5、50 μmol/L時差異有統計學意義(P<0.05,P<0.01),見圖3。
2.3 大黃素甲醚干預后SW1990細胞周期變化 流式細胞儀檢測Physcion組(5 μmol/L)及NC組培養48 h后SW1990細胞周期變化。與NC組比較,Physcion組停留在G1及G2期的比例減少,在S期的比例升高,差異有統計學意義(P<0.05),見表1。

圖2 不同時間大黃素甲醚(5 μmol/L)處理后細胞存活率

圖3 不同濃度大黃素甲醚處理后(培養48 h)細胞存活率
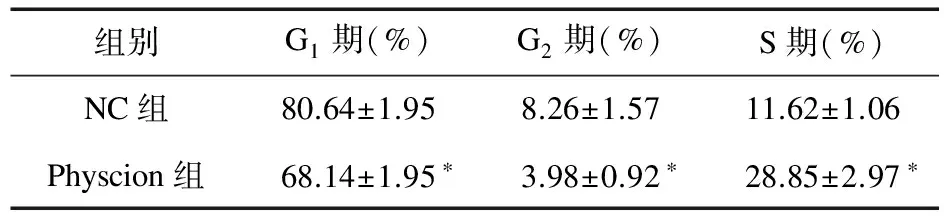
組別G1期(%)G2期(%)S期(%)NC組80.64±1.958.26±1.5711.62±1.06Physcion組68.14±1.95?3.98±0.92?28.85±2.97?
注:*與NC組比較,P<0.05
2.4 大黃素甲醚干預后SW1990細胞凋亡變化 流式細胞儀檢測Physcion組(5 μmol/L)及NC組培養48 h后SW1990細胞凋亡變化,結果顯示,Physcion組凋亡率高于NC組(42.65% vs.24.81%),差異有統計學意義(P<0.01),見圖4。

圖4 流式細胞儀檢測SW1990凋亡
3 討論
胰腺癌在確診時,大部分患者已失去手術時機,以手術為基礎的綜合治療在70%的患者中不能實現[6]。化療及靶向治療藥物對胰腺癌的敏感性差,易發生耐藥,中藥在胰腺癌的治療中取得了一定進展,由復方制劑轉為單劑治療是中西醫結合治療的方向[7]。大黃對惡性腫瘤的抑制作用已經在多項研究中證實,但是其成分中起主要抗癌作用的單劑,目前還不清楚。Chen等[8]研究表明,大黃中的大黃素甲醚可以通過下調EMMPRIN表達誘發結直腸癌細胞凋亡,降低存活率,且此作用呈劑量、時間依賴性。EMMPRIN是PI3K/Akt信號通路下游靶基因之一,與多種腫瘤相關,如肺癌、結腸癌、乳腺癌、胰腺癌及子宮內膜癌等[9]。
本研究顯示,大黃素甲醚干預后,mTOR及p-Akt表達呈劑量依賴性下降,Akt表達呈現劑量依賴性上升,說明大黃素甲醚對Akt磷酸化具有抑制作用。有研究認為,mTOR活性與Akt Ser473位點磷酸化有關,Akt磷酸化會影響mTOR表達,調控PI3K-Akt信號通路,決定惡性腫瘤細胞的生物行為[10]。本研究顯示,大黃素甲醚對胰腺癌細胞存活率具有時間及劑量依賴性抑制作用,隨著大黃素甲醚作用時間的延長或劑量的增加,胰腺癌細胞存活率會下降,表明大黃素甲醚能夠抑制胰腺癌細胞增殖,降低存活率。大黃素甲醚干預的胰腺癌細胞停留在G1期及G2期比例降低,在S期比例升高,細胞凋亡率也明顯增高,表明大黃素甲醚對細胞周期具有調控作用,能夠促進更多腫瘤細胞停止分裂增殖,進入程序化死亡過程。Yu等[10]研究認為,mTOR過表達會通過改變蛋白合成、異常調節細胞周期及抑制細胞凋亡等途徑促進腫瘤的發生和發展。而大黃素甲醚通過抑制Akt磷酸化,導致mTOR的過表達而抑制腫瘤細胞增殖,促進更多細胞停留在G1期,進入程序化死亡。Xie等[11]通過對大黃素甲醚對肺癌A549細胞作用的研究也顯示,大黃素甲醚能夠誘導細胞增殖停頓,凋亡增加。劉素華等[12]研究認為,大黃的另一種蒽醌類提取物大黃素葡萄糖苷通過調節Bcl-2水平誘導卵巢癌SKOV3細胞凋亡,Bcl-2也是PI3K/Akt信號通路的主要下游靶基因之一,該通路迅速短暫被激活后,通過多種途徑減少腫瘤細胞受損,維持細胞存活,促進DNA損傷修復。Hong等[13]在乳腺癌細胞中的研究也顯示,大黃素甲醚可以通過下調Cyclin D1、Cyclin A、CDK4、CDK2及c-Myc表達,抑制Rb蛋白磷酸化,從而使乳腺癌細胞增殖停滯,細胞更容易受損,存活率降低,VEGF釋放降低,腫瘤血管減少,血管內皮細胞更容易被破壞,促進腫瘤組織中微血管血栓形成,從而導致腫瘤壞死,發揮抗腫瘤活性。
目前,聯合放療、化療及中藥治療是胰腺癌綜合治療的探索方向[14],而大部分中藥提取物單劑的藥理作用目前尚不明確,但是為了發揮中藥的藥效,減少毒副作用,單劑是目前中藥研究的熱點課題。本研究顯示,在體外試驗中,大黃素甲醚能夠通過PI3K/Akt信號通路抑制胰腺癌細胞增殖,促進凋亡,對胰腺癌細胞具有殺傷作用,可能作為胰腺癌治療的中藥單劑之一,其抗腫瘤作用需進一步在體試驗論證。
[1] Pourhoseingholi MA,Vahedi M,Baghestani AR.Burden of gastrointestinal cancer in Asia-an overview[J].Gastroenterol Hepatol Bed Bench,2015,8(1):19-27.
[2] 潘會君,聶緒強,劉朵,等.4種中藥單體對人胰腺癌PANC-1細胞移植瘤生長的影響及分子機制探討[J].中國中藥雜志,2013,38(2):245-248.
[3] Xie HX,Xu ZY,Tang JN,et al.Effect of Huaier on the proliferation and apoptosis of human gastric cancer cells through modulation of the PI3K/AKT signaling pathway[J].Exp Ther Med,2015,10(3):1212-1218.
[4] 趙一俊,鄧剛,馬立彬,等.大黃素前列腺癌抗腫瘤作用機制研究進展[J].醫學研究雜志,2013,42(1):17-19.
[5] Han YT,Chen XH,Gao H,et al.Physcion inhibits the metastatic potential of human colorectal cancer SW620 cells in vitro by suppressing the transcription factor SOX2[J].Acta Pharmacol Sin,2016,37(2):264-275.
[6] Ansari D,Gustafsson A,Andersson R.Update on the management of pancreatic cancer:surgery is not enough[J].World J Gastroenterol,2015,21(11):3157-3165.
[7] 方靖,阮善明,沈敏鶴.胰腺癌中醫臨床治療研究概況[J].中醫學報,2015,30(3):316-318.
[8] Chen X,Gao H,Han Y,et al.Physcion induces mitochondria-driven apoptosis in colorectal cancer cells via downregulating EMMPRIN[J].Eur J Pharmacol,2015,764:124-133.
[9] Zhao D,Sui Y,Zheng X.miR-331-3p inhibits proliferation and promotes apoptosis by targeting HER2 through the PI3K/Akt and ERK1/2 pathways in colorectal cancer[J].Oncol Rep,2016,35(2):1075-1082.
[10]Yu G,Huang B,Chen G,et al.Phosphatidylethanolamine-binding protein 4 promotes lung cancer cells proliferation and invasion via PI3K/Akt/mTOR axis[J].J Thorac Dis,2015,7(10):1806-1816.
[11]Xie QC,Yang YP.Anti-proliferative of physcion 8-O-β-glucopyranoside isolated from Rumex japonicus Houtt.on A549 cell lines via inducing apoptosis and cell cycle arrest[J].BMC Complement Altern Med,2014,14(10):377.
[12]劉素華.大黃素-8-O-β-D-葡萄糖苷對人卵巢癌細胞系SKOV3細胞凋亡及Bcl-2表達的影響[J].中華醫學雜志,2015,95(43):3541-3544.
[13]Hong JY,Chung HJ,Bae SY,et al.Induction of cell cycle arrest and apoptosis by physcion,an anthraquinone Isolated from rhubarb (rhizomes of rheum tanguticum),in MDA-MB-231 human breast cancer cells[J].J Cancer Prev,2014,19(4):273-278.
[14]李榮,李稱才,何濤,等.聯合手術、術中后區域化療、中藥治療胰腺癌臨床研究[J].中國醫藥科學,2013,11:186-187.
Mechanism and inhibitory effect of physcion on pancreatic cancer cell SW1990
YANG Yong*
(Department of Emergency,Benxi Central Hospital,Benxi 117022,China)
Objective To observe the effect of physcion on proliferation and apoptosis of pancreatic cancer cell SW1990 and discuss the mechanism.Methods The PI3K-Akt-mTOR signaling pathway was detected by western blot;the proliferation of SW1990 interfered with different concentration of physcion at different time points was observed by MTT assay;the cell cycle and apoptosis affected by physcion was detected by flow cytometry.Results Compared with NC group,the expression of mTOR and p-Akt in physcion groups was dose-dependently decreased,while the expression of Akt was dose-dependently increased;there were significant differences at 5 μmol/L and 50 μmol/L (P<0.05).The cell viability in physcion groups was decreased in a time-dependent or dose-dependent manner,the differences being significant at 48,72 and 96 h (P<0.05) or 0.5,5 and 50 μmol/L(P<0.05).Physcion group has fewer cells staying in phase G1and G2and more cells staying in phase S than NC group (P<0.05) with higher apoptosis rate (P<0.01).Conclusion Physcion decreases the cell viability of pancreatic cancer and promotes the apoptosis by inhibiting the phosphorylation of Akt and controlling the PI3K/Akt pathway.
Pancreatic cancer;Physcion;Apoptosis
2016-04-02
本溪市中心醫院急診科,遼寧 本溪 117022
*通信作者
10.14053/j.cnki.ppcr.201612007

