測定飲料中咖啡因含量的綜合性實驗
張文珠, 王添爽, 趙 洋, 馮晴晴, 潘玉珍, 劉瀟彧
(大連理工大學 化工與環境生命學部 基礎化學實驗中心,遼寧 大連 116024)
?
測定飲料中咖啡因含量的綜合性實驗
張文珠, 王添爽, 趙 洋, 馮晴晴, 潘玉珍, 劉瀟彧
(大連理工大學 化工與環境生命學部 基礎化學實驗中心,遼寧 大連 116024)

結合有機化學實驗內容,采用蒸餾法用乙醇溶劑從茶葉中提取咖啡因晶體,用高效液相色譜儀考察了流動相組成對樣品分離效果的影響,發現增大甲醇濃度,咖啡因的保留時間隨之減少。咖啡因濃度20~100 μg/mL,線性方程為A=2.38C+33.4,R2=0.991。最后,通過高效液相色譜法(HPLC)測定市售綠茶飲料、可樂和功能飲料中的咖啡因含量,所得色譜圖中無干擾疊加峰,并且在幾種飲料中均含有一定量的咖啡因,建議需適量攝取含咖啡因的飲料。
咖啡因; 高效液相色譜法; 提取
0 引 言
咖啡因多存在于茶葉、咖啡豆、可可等植物組織中,是一種黃嘌呤生物堿化合物[1],作為中樞神經興奮劑,適度食用具有驅走睡意、消除疲勞、興奮神經等作用[2],因此有咖啡因成分的咖啡、茶、軟飲料及能量飲料十分暢銷。但是,大劑量或長期使用,有抗藥性及成癮性,會損害人體健康,被列入受國家管制的精神藥品范圍,因此對食品中咖啡因含量的檢測非常必要[3-4]。本實驗從溶劑提取入手,首先提取了茶葉中的咖啡因作為標準品。然后利用高效液相色譜法(HPLC),測定了一定量市售綠茶、可樂和功能飲料實際樣品中咖啡因的含量[5-7]。
1 實驗部分
1.1 儀器和試劑
Agilent 1100高效液相色譜儀(安捷倫科技有限公司)。Hypersil ODS2 (200 mm×4.6 mm,5 μm)(中國科學院大連化學物理研究所)。20 μL微量進樣器。
甲醇為色譜純(Sigma公司)。咖啡因標準品由茶葉提取后,升華提純,經熔點儀結合色譜儀檢驗為色譜純。水為超純水。其他試劑均為分析純。綠茶飲料、可樂和功能飲料樣品均購自當地超市。
1.2 實驗條件
流動相為甲醇∶水=30∶70(體積比);流速0.5 mL/min;進樣量10 μL;紫外檢測波長275 nm;柱溫為室溫。
1.3 茶葉中咖啡因的提取
方法一:稱取10 g研細的茶葉,10 g碳酸鈣轉入盛有150 mL蒸餾水的燒杯中,用小火加熱煮沸30 min(期間加入少量的蒸餾水以彌補蒸發了的水分)。趁熱過濾,將濾液倒入干凈的燒杯中,濃縮至10 mL左右,轉入蒸發皿并加入2 g氧化鈣,用小火焙干后研細備用(焙干時溫度不宜過高,避免升華)。取一支合適的短頸漏斗,頸部用脫脂棉塞住,罩在隔以刺有許多小孔的濾紙的蒸發皿上,小心加熱進行升華(適當控制火焰,盡可能使升華速度放慢,提高結晶純度),升華結束后冷卻至室溫,再揭開漏斗和濾紙,收集產品[8]。
方法二:稱取10 g研細的茶葉末和75 mL 95%乙醇,放入圓底燒瓶中,水浴加熱,連續提取2~3 h,停止加熱[9-11]。冷卻至室溫后,改成蒸餾裝置,回收提取液中的大部分乙醇,趁熱將瓶中的殘液傾入蒸發皿中,拌入3~4 g生石灰粉,使成糊狀,在蒸氣浴上蒸干,期間應不斷攪拌,并壓碎塊狀物。將蒸發皿放在石棉網上,用小火焙炒片刻,使水分全部除去。冷卻后,擦去粘在邊上的粉末,以免在升華時污染產物。取一只口徑合適的玻璃漏斗,罩在隔以刺有很多小孔濾紙的蒸發皿上,用沙浴小心加熱升華。控制沙浴溫度在220 ℃左右[12]。當濾紙上出現許多白色針狀結晶時,暫停加熱,讓其自然冷卻至100 ℃左右。小心取下漏斗,揭開濾紙,用刮刀將紙上和器皿周圍的咖啡因刮下,稱重。
1.4 飲料中咖啡因的測定
1.4.1 標準曲線的繪制
咖啡因母液的配置:準確稱取咖啡因純品0.010 g于10 mL容量瓶中,用超純水定容至刻度,搖勻冷藏待用。
咖啡因標準溶液的配置:分別用移液槍移取200、400、600、800和1 000 μL咖啡因母液于5個10 mL容量瓶中,用超純水定容至刻線,搖勻[13]。進樣前用0.25 μm濾膜過濾。
標準曲線的測定:分別用微量進樣器抽取10 μL上述標準樣品進樣分析,并繪制標準曲線。
1.4.2 樣品前處理及測定
取25 mL的綠茶飲料于50 mL容量瓶中,用超純水稀釋至刻度,搖勻。取25 mL的可樂于50 mL容量瓶中先超聲脫氣15 min,以去除可樂中的CO2,加入超純水稀釋至刻度,搖勻[14]。取3 mL的功能飲料于50 mL容量瓶中,用超純水稀釋至刻度,搖勻。進樣前用0.25 μm濾膜過濾上述樣品溶液分別置于離心管中,依次抽取10 μL進樣分析。
2 結果與討論
2.1 茶葉中提取咖啡因的結果分析
實驗中所用的方法一為茶葉加入碳酸鈣后,加水煮沸提取,經多次實驗后幾乎沒有產物產生。而方法二有大量針狀晶體生成。對實驗過程進行分析,發現方法一的缺點在于咖啡因在水中的溶解度小于在熱的乙醇中的溶解度,因此用水作為提取溶劑不利于咖啡因的提取。另外,加入氧化鈣焙干時也難以控制反應溫度和時間。方法二中沙浴升華時,升華時間過長或溫度過熱會導致粉末碳化,影響產率。所以,提取實驗的關鍵步驟是控制好實驗條件,如提取溶劑、反應時間和反應溫度等。
2.2 流動相中甲醇比例對咖啡因分離的影響
在液相色譜建立標準曲線實驗之前,為了保證實際樣品中咖啡因色譜峰與雜質成分色譜峰之間互不干擾,首先考察了流動相中甲醇比例對咖啡因分離的影響。分別將流動相中甲醇濃度調節為20%、30%和40%。如圖1所示,當甲醇濃度從20%升高到40%,咖啡因的保留時間也隨之減少。考慮到實際樣品中其他組分對咖啡因出峰的影響和分析時間的節省,最終選用了甲醇∶水=30∶70為本次實驗的流動相。從圖2可以看出,即使是不同飲料的實際樣品也不會有干擾疊加峰[15-16]。
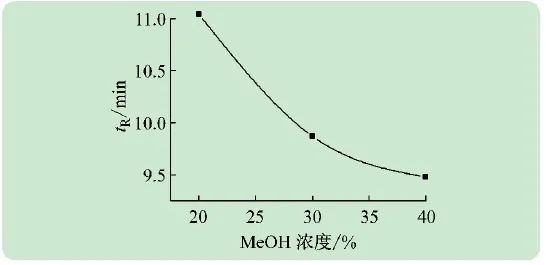
圖1 流動相中甲醇比例對咖啡因保留行為的影響
2.3 咖啡因標準曲線的繪制
分別取20、40、60、80和100 μg/mL的咖啡因標準溶液進樣分析,以咖啡因濃度為橫坐標,色譜峰面積為
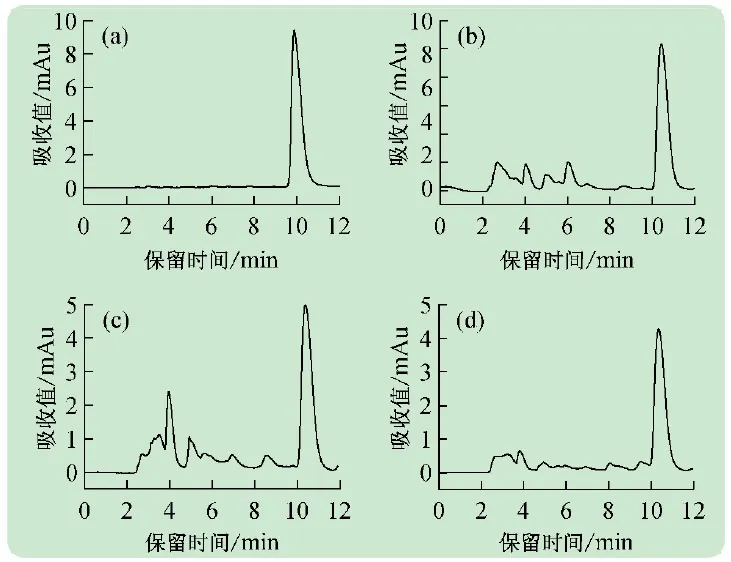
圖2 咖啡因標準溶液(a)和不同樣品可樂(b)、綠茶(c)、功能飲料(d)的液相色譜圖
縱坐標,得到實驗所需標準曲線,如圖3所示。從圖中可以看出,線性擬合良好,線性方程為A=2.38C+33.4,線性范圍20~100 μg/mL,R2=0.991。
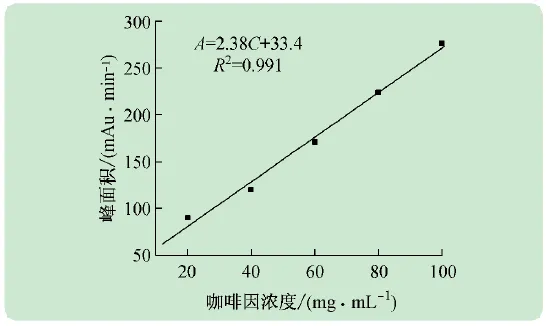
圖3 咖啡因濃度和峰面積線性關系圖
2.4 實際樣品中咖啡因含量的測定
以市場上隨機購買的綠茶飲料、可樂和功能飲料作為實際樣品,利用上述標準曲線法測定了不同飲料中咖啡因的含量,測定結果見表1。發現,不僅咖啡、茶葉中含有咖啡因,在可樂、綠茶和功能飲料中均含有一定量的咖啡因。盡管飲用含咖啡因的飲料可以幫助人們在短期內擺脫睡意,振奮精神,但長期大量飲用還是具有一定風險,對人體存在著諸多不利影響,譬如:咖啡因會影響人體對鈣質的吸收,刺激中樞神經系統[17-19]等。因此建議每日需適量攝取含咖啡因的飲料;老人、兒童和孕婦最好減少對含咖啡因飲料的攝取。
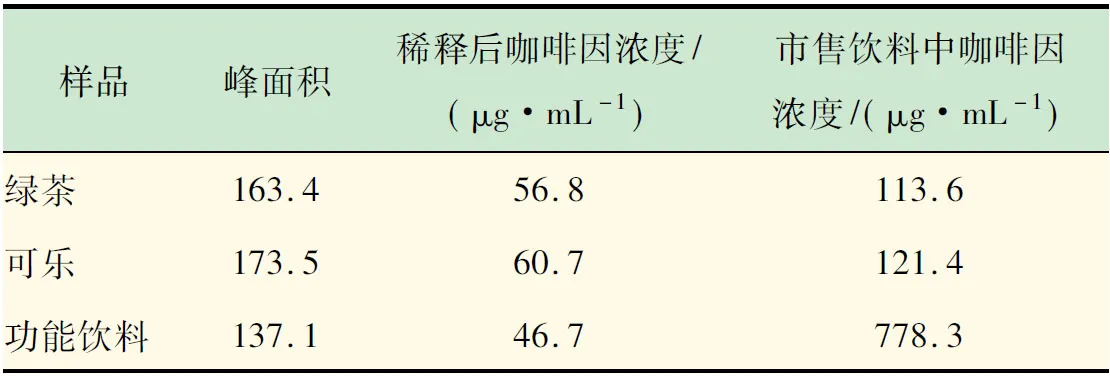
表1 實際飲料樣品中咖啡因的測定結果
3 結 語
本實驗將有機實驗和儀器分析實驗結合在一起,實驗中所用到的色譜純咖啡因標樣是以茶葉為原料由學生自己動手制備提純所得,既提高了學生的實驗技能,又很好地解決了實驗中所需標準樣品購買昂貴、手續復雜的問題。用液相色譜儀通過建立外標法,測定了一系列飲料中的咖啡因含量,液相色譜儀的使用能夠有效地避免實際樣品中其它組分的干擾,準確地進行定量分析。
[1] 薛 山. 咖啡因生理功效、脫除技術及研究趨勢[J]. 食品與機械, 2013, 29(1): 232-235.
[2] Barry R J, Clarke A R, Johnstone S J. Timing of caffeine’s impact on autonomic and central nervous system measures : Clarification of arousal effects[J]. Biological Psyclology, 2008, 77(3): 304-316.
[3] 黃 敏, 高建義, 翟志剛. 基于藥代動力學和代謝組學研究咖啡因對異丙嗪鎮靜作用的影響[J]. 高等化學學報, 2013, 34(4): 829-836.
[4] 劉艷霞,李文娟.從茶葉中提取咖啡因[J]. 廣東化工, 2013, 40(1): 53.
[5] 寧麗峰, 王慧萍, 何 軒. 高效液相色譜法測定飲料中咖啡因的含量[J]. 中國衛生檢驗雜志, 2009, 19(3): 560-562.
[6] 張秀真,沈玉華,謝安建. 高效液相色譜法內標法的實驗教學探索[J]. 實驗技術和管理, 2012, 29(11): 109-110.
[7] 蔡向忠, 王秀紅, 李銀生. 改革儀器分析實驗教學培養學生創新能力 [J]. 實驗室研究與探索, 2014, 33(11): 169-171.
[8] 趙衛星, 姜紅波, 馮國棟. 茶葉中咖啡因的提取研究進展[J]. 化學與生物工程, 2010, 27(9): 17-20.
[9] 高占先.有機化學實驗[M]. 4版.北京:高等教育出版社,2004: 172-173.
[10] 關燁第,李翠娟,葛樹峰.有機化學實驗[M]. 北京:北京大學出版社,2002: 241-242.
[11] 呂守茂, 祝 巨, 俞遠志. 茶葉中提取咖啡因實驗裝置的改進[J]. 實驗室研究和探索,2009, 28(5): 33.
[12] 楊祖幸, 湯 潔, 孫 群. 從茶葉中提取咖啡因實驗方法及裝置的改進[J]. 實驗室研究與探索, 2008, 27(3): 43-44.
[13] 王元蘭.儀器分析實驗[M]. 北京:化學工業出版社,2014: 56-57.
[14] 屈 鋒, 覃 浩, 馬文韜.毛細管膠束電動色譜分析飲料中的咖啡因開放實驗的實踐[J]. 實驗技術與管理,2008, 25(12): 28-29.
[15] 潘中達,趙保丹,周 進. 水溶液中染料吸光度與濃度的非線性關系[J]. 實驗室研究與探索,2014, 33(2): 23-26.
[16] 李 祥,陳宗姮,袁 硯. 亞硝酸鹽對紫外分光光度法測定硝酸鹽的影響[J]. 實驗室研究與探索,2014, 33(11): 11-14.
[17] 陳青川,于文蓮,王 靜. 高效液相色譜同時測定多種食品添加劑[J]. 色譜, 2001, 19(2): 106-108.
[18] 李群安.不同年齡男性唾液咖啡因的藥物動力學研究[J]. 藥學實踐雜志,2007, 25(6): 403-404.
[19] 邱明華,張枝潤,李忠榮. 咖啡化學成分與健康[J]. 植物科學學報,2014, 32(5): 540-550.
Comprehensive Experiment for Determination of Caffeine Content in Beverages
ZHANGWen-zhu,WANGTian-shuang,ZHAOYang,FENGQing-qing,PANYu-zhen,LIUXiao-yu
(Faculty of Chemical, Environmental and Biological Science and Technology,Dalian University of Technology, Dalian 116024, China)
This experiment for determination of caffeine content was designed in the paper. Firstly, using solvent extract method, caffeine crystal was extracted from tea by ethanol as a solvent. Then the effect of mobile phase in sample separation has been investigated by HPLC. As increasing the concentration of methanol, the retention time of caffeine decreased accordingly. Next, the external standard method was established to detect the caffeine concentrations in high-performance liquid chromatography. The linear equationA=2.38C+33.4 held a good linear fitting in the range of 20—100 μg/mL. and the square of the correlation coefficient was 0.991. Finally, caffeine concentrations in several beverages such as green tea, coke and energy drinks bought from supermarket were detected by HPLC, No interference peaks were observed in the chromatograms. Caffeine was found in all of these beverages, so the public should reduce intake of caffeine containing drinks.
caffeine; high-performance liquid chromatography; extraction
2015-03-19
國家自然科學基金項目(No.21205009);大連理工大學教學改革基金項目(HG201427)
張文珠(1973-),女,湖北蘄春人,博士,副教授,研究方向:色譜和熒光、電化學發光探針的研究以及教學與管理。
Tel.:0411-84706291;E-mail:wzhzhang@dlut.edu.cn
O 657.7+2
A
1006-7167(2016)01-0013-03

